В природе достаточно часто коррозия идет под действием двух окислителей Н+ и О2, всегда присутствующих совместно во всех водных растворах.
Для примера, рассмотрим коррозию цинка и меди, контактирующих между собой и находящихся в водном растворе с рН=2 (рис.3.3).

Рис.3.3. Коррозия дух металлов в контакте под действием двух окислителей.
H2Cu и H2Zn – идеальные поляризационные кривые выделения водорода на меди и цинке, соответственно; О2Cu и О2Zn – идеальные поляризационные кривые восстановления кислорода на меди и цинке (SZn<SCu); ∑KZn – суммарная идеальная поляризационная кривая катодных процессов на цинке; ∑KCu – суммарная идеальная поляризационная кривая катодных процессов на меди; ∑ ∑K – общая поляризационная кривая; Zn – анодная идеальная поляризационная кривая растворении цинка; Cu – анодная идеальная поляризационная кривая растворении меди; 1 – реальная поляризационная кривая цинка; 2 – реальная поляризационная кривая меди
Если бы металлы не были в контакте и корродировали отдельно друг от друга, то на их поверхности реализовались бы потенциалы Ест1 и Ест2 . Цинк корродировал бы как под действием ионов водорода, так и по коррозии с кислородной деполяризацией за счет растворенного кислорода. Медь корродировала бы только под действием растворенного кислорода. В случае, если коррозия цинка и меди происходит в контакте, а электропроводность среды достаточно велика, на поверхности обоих металлов реализуется стационарный потенциал коррозии Ест. При таком потенциале медь не корродирует совсем, так как Ест < ЕравнCu , т.е. весь анодный процесс локализуется на поверхности цинка.
Катодный процесс протекает как на меди, так и на цинке, причем на обоих электродах наблюдается восстановление обоих видов окислителей:
2Н++2е→1/2 Н2 (1)
О2+4Н+ +4е→2 Н2О (2)
Реакция (1) протекает с большей скоростью на меди, так как перенапряжение выделения на ней значительно ниже, чем на цинке. Лимитирующей стадией реакции (2) является диффузия, поэтому определяющее значение для расположения поляризационных кривых О2Cu и О2Zn имеет величина поверхности металла. В случае, если SZn<SCu, реакция (2) протекает с большей скоростью на меди, чем на цинке (рис.3.3).
Таким образом, независимо от количества окислителей при контакте двух металлов стационарный потенциал коррозии более отрицательного металла сдвигается в положительном направлении и скорость коррозии его увеличивается. Стационарный потенциал коррозии более положительного металла сдвигается в отрицательном направлении и скорость его коррозии уменьшается, или он совсем прекращает корродировать.
На рис. 3.3 приведены также реальные поляризационные кривые 1 и 2 (выделены жирными линиями), экспериментально получаемые в ходе выполнения настоящей работы, где 1– реальная поляризационная кривая, получаемая на более отрицательном; 2– реальная поляризационная кривая, получаемая на более положительном металле. Методика снятия таких кривых приведена в разделе 3.2.
Ход выполнения работы
В настоящей лабораторной работе контактную коррозию предлагается исследовать с помощью установки, представленной на рис.3.4. Согласно схеме рис. 3.4, при разомкнутом ключе К1 металлы работают без контакта. Измеряя в этом случае потенциалы металлов, можно определить стационарные потенциалы коррозии металлов М1 и М2 , работающих без контакта (Е  и Е
и Е 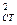 ). Далее металлы приводятся в контакт через амперметр и мост сопротивлений R (начальное значение R = 100000 Ом). За счет постепенного уменьшения сопротивления моста R постепенно улучшается контакт двух металлов. Измеряя при каждом значении сопротивления R внешний ток и величину потенциалов металлов, снимают поляризационные кривые (1 и 2), выделенные на рис 3.3 жирными линиями.
). Далее металлы приводятся в контакт через амперметр и мост сопротивлений R (начальное значение R = 100000 Ом). За счет постепенного уменьшения сопротивления моста R постепенно улучшается контакт двух металлов. Измеряя при каждом значении сопротивления R внешний ток и величину потенциалов металлов, снимают поляризационные кривые (1 и 2), выделенные на рис 3.3 жирными линиями.
Рис. 3.4. Схема установки для исследования контактной коррозии:
М1 и М2 – контактирующие металлы; А – амперметр; R – магазин сопротивлений; К1, К2 – ключи; mV – цифровой вольтметр; к.л. – капилляр Луггина; п.м.– переходной мостик
Снятые поляризационные кривые могут быть представлены в виде коррозионной диаграммы Шултина – Вагнера (рис. 3.5) или коррозионной диаграммы Эванса (рис.3.6).
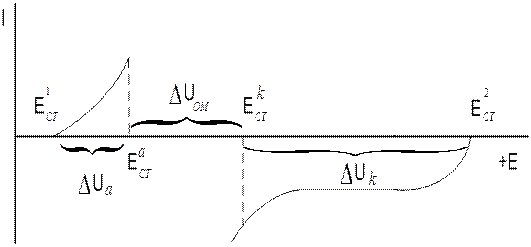
Рис.3.5. Коррозионная диаграмма Шултина – Вагнера

Рис.3.6. Коррозионная диаграмма Эванса
Из диаграмм, представленных на рис. 3.5 и рис.3.6, можно определить долю катодного, анодного и омического контролей, т.е. определить фактор, наиболее ограничивающий скорость коррозии. Например, доля катодного контроля, определяется следующим образом:
 .
.
Аналогичным образом определяется доля анодного и омического контролей.
Снятие поляризационных кривых при исследовании контактной коррозии производится в следующей последовательности:
– подготовить образцы металлов к работе (зачистить, обезжирить);
– провести монтаж образцов в ячейке и собрать схему, после сборки схемы поляризующая цепь должна быть разомкнута;
– залить в сосуд электролит;
– измерить стационарные потенциалы обоих металлов, корродирующих без контакта друг с другом при разомкнутой цепи;
– поставить максимальное сопротивление на мосту (R), замкнуть поляризующую цепь и замерить значение тока и потенциалов отдельных электродов;
– последовательно уменьшая значение сопротивления R (в 1,5–2 раза), и, измеряя при каждом значении сопротивления величину потенциалов электродов и внешний ток, снять поляризационные кривые.
- при сопротивлении меньшем 500 ом сопротивление уменьшать более плавно. Время выдержки электродов при каждом значении сопротивления должно быть одинаковым и составлять 15 – 20 секунд;
- при необходимости снятие поляризационных кривых провести вновь
– обработать экспериментальные данные.
Экспериментальные данные заносятся в табл. 3.1.
Таблица 3.1
Зависимость потенциалов контактирующих металлов и внешнего тока
от сопротивления цепи
|
Изменя-ющийся фактор
|
Величина внешнего сопротивления R, Ом
|
Величина тока, I, мА
| Потенциал по отношению к электроду сравнения
| Потенциал по водородной шкале
|
Примечание
|
| Еа
| Ек
| Еа
| Ек
|
| | | | | | | | |
На основании экспериментальных данных строятся коррозионные диаграммы (зависимость потенциала катода и анода от силы тока) и графики зависимости максимального тока защиты от значений переменной.
Из коррозионных диаграмм определяются стационарные потенциалы отрицательного Еста и положительного Естк металлов и рассчитывается степень анодного, катодного и омического контролей.
Выводы по работе должны содержать объяснение полученных результатов и предполагаемые электродные реакции на каждом из металлов.




 и Е
и Е 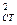 ). Далее металлы приводятся в контакт через амперметр и мост сопротивлений R (начальное значение R = 100000 Ом). За счет постепенного уменьшения сопротивления моста R постепенно улучшается контакт двух металлов. Измеряя при каждом значении сопротивления R внешний ток и величину потенциалов металлов, снимают поляризационные кривые (1 и 2), выделенные на рис 3.3 жирными линиями.
). Далее металлы приводятся в контакт через амперметр и мост сопротивлений R (начальное значение R = 100000 Ом). За счет постепенного уменьшения сопротивления моста R постепенно улучшается контакт двух металлов. Измеряя при каждом значении сопротивления R внешний ток и величину потенциалов металлов, снимают поляризационные кривые (1 и 2), выделенные на рис 3.3 жирными линиями.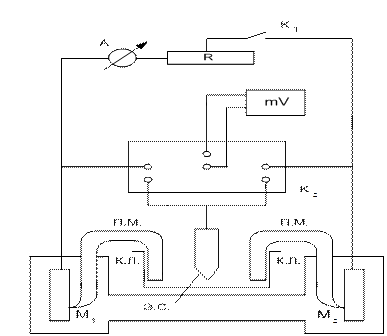
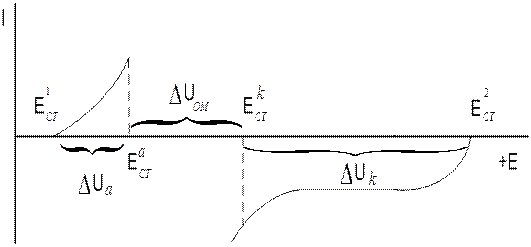

 .
.

