

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...
Топ:
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Интересное:
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
m = K × I × t = K × Q (1)
где m – масса вещества на электроде, г; I – сила тока, А; t – время протекания тока через электролизер, с; Q = I × t – количество электричества;
K – коэффициент пропорциональности, значение которого зависит от выбранной системы единиц. Если Q = 1 Кл, то m = K. Количество вещества, выделяющееся при прохождении одного кулона электричества, называется электрохимическим эквивалентом. Следовательно, коэффициент пропорциональности (K) можно рассматривать как электрохимический эквивалент.
II закон Фарадея
При пропускании равного количества электричества через растворы разных электролитов масса каждого из веществ (mi), претерпевающих превращение, пропорциональна его химическому эквиваленту, т.е
m1: m2: m3 … = Э1: Э2: Э3… (где Э – химический эквивалент вещества). Таким образом, для выделения на электроде 1 г-экв любого вещества необходимо затратить одно и то же количество электричества, равное постоянной Фарадея (F = 96485 Кл/г-экв, F» 96500 Кл/г-экв).
Действительно, 1 г-экв вещества содержит количество частиц, равное числу Авогадро (NA = 6,02205 × 1023 частиц): чтобы восстановить такое количество ионов на катоде, необходимо затратить количество электричества
F = NA  = 6,022205 × 1023 × 1,6022 × 10-10 = 96485 Кл/г-экв.
= 6,022205 × 1023 × 1,6022 × 10-10 = 96485 Кл/г-экв.
где  – заряд электрона,
– заряд электрона,  = 1,6022 × 10-10 Кл.
= 1,6022 × 10-10 Кл.
Приближенное значение F» 96500 Кл/г-экв.
Обобщая два закона Фарадея, можно записать
 , (2)
, (2)
так как электрохимический эквивалент “ K ” равен отношению химического эквивалента “ Э ” к числу Фарадея “ F ”:
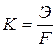 . (3)
. (3)
Процессы в электролизере и в гальваническом элементе объединены в химическом источнике тока - аккумуляторе, который широко распространен во многих производствах, в том числе на мебельных предприятиях, в автотранспорте и др. Так, в автокаре находится аккумулятор, работа которого связана с обратимыми процессами (разрядки и зарядки аккумулятора).
|
|
При работе свинцового аккумулятора на электродах происходят процессы разрядки и зарядки аккумулятора, которые можно выразить в виде обратимого химического уравнения:
|



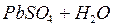
Процесс разрядки связан с работой гальванического элемента, зарядки - с процессом электролиза.
Реактивы и оборудование
1. Электролизер (U-образная трубка).
2. Графитовые стержни.
3. Внешний источник тока.
4. Потенциометр или амперметр.
5. Соединительные проводники.
6. Набор растворов электролитов.
Экспериментальная часть
Для проведения электролиза растворов электролитов необходимо собрать установку, схема которой приведена на рис. 1. Для этого в U-образную трубку (электролизер) наливают раствор исследуемого электролита, выданного преподавателем. В раствор помещают угольные электроды, один из которых служит анодом (А), а другой катодом (К). Концы электродов должны быть погружены в раствор электролита на 4…5 см. Электроды необходимо соединить проводниками с источником постоянного тока, последовательно соединив с амперметром. Составленную схему установки необходимо показать преподавателю или лаборанту.
После подключения источника тока необходимо замерить силу тока (А) и пропускать его через исследуемый раствор электролита в течение времени, указанного преподавателем. Студенту следует описать явления, наблюдаемые на электродах, и составить схему электролиза (уравнения реакций, протекающих на электродах, и суммарный процесс электролиза).
Используя законы Фарадея, рассчитать массу веществ, образующихся на электродах, по формуле (2):

 ,
,
где  – масса образовавшегося на электроде вещества, г;
– масса образовавшегося на электроде вещества, г;  – химический эквивалент вещества, г/моль;
– химический эквивалент вещества, г/моль;  – число Фарадея (96500 Кл/моль);
– число Фарадея (96500 Кл/моль);
|
|
 – сила тока в цепи, А;
– сила тока в цепи, А; 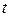 – время прохождения тока, с.
– время прохождения тока, с.
После проведения расчетов сделайте выводы, в которых дайте определение процесса электролиза, и покажите, какие продукты и в каком количестве образуются в результате электролиза для исследуемого раствора электролита.
Вопросы для самоконтроля и повторения
1. Дать определение процессу электролиза. Каково устройство электролизера?
2. В чем отличие процессов в гальваническом элементе и электролизере?
3. Какие продукты на аноде и катоде образуются при электролизе раствора NaOH, CaCl2, ZnSO4, AgNO3? Поясните ответ.
4. Дайте определение I, II и объединенного законов Фарадея.
5. Напишите химические уравнения, соответствующие зарядке и разрядке свинцового кислотного аккумулятора.
Лабораторная работа № 15
|
|
|

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!