

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Интересное:
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Лабораторная работа № 12
Окислительно-восстановительные реакции
Цель работы
1. Ознакомиться с понятиями степень окисления, окислитель и восстановитель, окисление и восстановление, а также с типами окислительно-восстановительных реакций и методами их составления.
2. Изучить окислительные свойства ионов Fe+3 и Cr+6, а также восстановительные свойства иона Fe+2.
3. Сравнить окислительные свойства перманганата калия в зависимости от реакции среды.
4. Составить полные уравнения проведенных окислительно-восстановительных реакций. Определить окислитель и восстановитель.
Теоретическая часть
Степень окисления относится к числу формальных понятий химии и введена для характеристики состояния атома в соединении.
Степень окисления – это условный заряд атомов элемента в соединении, который определяется из предположения ионного строения вещества. Степень окисления может быть положительной и отрицательной. Она указывается арабской цифрой со знаком плюс или минус над символом атома, например, K+1Cl-1. Для определения степени окисления элементов пользуются общими правилами. Рассмотрим их.
В простых веществах степень окисления элемента всегда равна нулю. Например, нулевые значения степени окисления имеют атомы в молекулах водорода (Н2), кислорода (О2) и др.
Постоянную степень окисления имеют щелочные металлы (+1), щелочноземельные металлы (+2), алюминий (+3), фтор (–1). Для водорода в большинстве соединений характерна степень окисления + 1, кроме его соединений с металлами, где она равна –1. Степень окисления кислорода, как правило, равна –2, за исключением пероксидов, где она равна –1, и фторида кислорода ОF2, где она равна –2.
|
|
Степень окисления элементов с непостоянной степенью окисления рассчитывают, зная формулу соединения и учитывая, что сумма степеней окисления всех атомов в молекуле равна нулю. Например, в соединении KMnO4 необходимо определить степень окисления Mn:  . Cуммируем степени окисления атомов всех элементов, входящих в соединение, и приравниваем эту сумму к нулю (+1) + Х + ((-2)×4) =0. Определяем Х: Х = + 7.
. Cуммируем степени окисления атомов всех элементов, входящих в соединение, и приравниваем эту сумму к нулю (+1) + Х + ((-2)×4) =0. Определяем Х: Х = + 7.
Все химические реакции можно разделить на две группы. В реакциях первой группы степень окисления всех элементов реагирующих вещество остается неизменной, а в реакциях второй группы степень окисления одного или нескольких элементов изменяется.
Примером реакций первой группы является реакция нейтрализации:
HCl + NaOH = NaCl + Н2О.
Примером реакции второй группы может служить взаимодействие металла с кислотой:
Zn + 2HCl = ZnCl2 + Н2.
Реакции, в которых происходит изменение степени окисления атомов элементов, называются окислительно-восстановительными. Эти реакции имеют очень большое значение в химических, биохимических, биологических процессах (фотосинтез, дыхание, пищеварение), а также в технике, например, в металлургии.
Протекание окислительно-восстановительных реакций и, следовательно, изменение степени окисления атомов обусловлено переходом электронов от одних атомов к другим. В ходе окислительно-восстановительных реакций различают два процесса – окисление и восстановление. Процесс отдачи электронов, сопровождающийся повышением степени окисления элемента, называется окислением, например в реакциях
2Na + J2 = 2NaJ 2NaJ + Cl2 = NaCl + J2
2Na0 – 2  = 2Na+; 2J– – 2
= 2Na+; 2J– – 2  = J20.
= J20.
Процесс присоединения электронов, сопровождающийся понижением степени окисления элемента, называется восстановлением, например, в предыдущих реакциях
Cl20+ 2  = 2Cl–; Fe3+ +
= 2Cl–; Fe3+ +  ® Fe2+.
® Fe2+.
В реакции 2FeCl3 + Hg ® 2FeCl2 + HgCl2
J20 + 2  = 2J–.
= 2J–.
Вещества, которые в ходе химической реакции отдают электроны, называются восстановителями (в приведенных реакциях Na0, J–). Во время реакции они окисляются. Вещества, которые принимают электроны (в приведенных реакциях J2, Cl2, Fe+3), называются окислителями. Во время реакции они восстанавливаются.
|
|
Все вещества по своей окислительно-восстановительной способности делятся на три группы. К первой группе относятся вещества, которые могут выступать только в роли восстановителей. К ним в первую очередь относятся свободные атомы металлов. Их восстановительные свойства объясняются способностью атомов металлов отдавать валентные электроны. Только восстановителями могут быть также элементы в форме существования с наиболее отрицательными степенями окисления, например,  ,
,  ,
,  ,
,  и др. Если металл имеет несколько степеней окисления, то его соединения, в которых они проявляют низшую из них, также обычно являются восстановителями, например,
и др. Если металл имеет несколько степеней окисления, то его соединения, в которых они проявляют низшую из них, также обычно являются восстановителями, например,  ,
,  ,
,  .
.
К важнейшим восстановителям относятся атомы металлов (особенно щелочных), водород Н2, углерод С, СО, Н2S, SO2, H2SO3, HI, HBr, SnCl2, FeSO4, электрический ток на катоде.
Ко второй группе относятся вещества, которые могут быть только окислителями. К ним относятся атомы некоторых неметаллов, для которых характерно присоединение электронов, например, кислород и фтор. Только окислителями могут быть также атомы элементов с наивысшими положительными степенями окисления в соединениях, например,  ,
,  ,
,  ,
,  ,
,  ,
,  и др.
и др.
К важнейшим окислителям относятся галогены, кислород, озон, K2Cr2O7, KMnO4, H2O2, конц. H2SO4, HNO3, электрический ток на аноде.
К третьей группе относятся вещества, которые в зависимости от условий могут проявлять как окислительные, так и восстановительные свойства. К ним относятся атомы и молекулы неметаллов главных подгрупп IV и VII групп, бор, водород, а также атомы элементов с промежуточными (между низшим и высшим) значениями степени окисления в соединении.
При составлении окислительно-восстановительных реакций необходимо учитывать, что в окислительно-восстановительных реакциях происходит только эквивалентный обмен электронов между восстановителем и окислителем, т.е. суммарное число электронов, отдаваемых восстановителем и присоединяемое окислителем равны.
Если в окислительно-восстановительной реакции освобождается кислород в состоянии О-2, то в кислых растворах он связывается ионами Н+ с образованием молекул воды, а в нейтральных или щелочных растворах он реагирует с образованием гидроксид-ионов
|
|
О-2 + 2Н+ = Н2О НОН + О-2 = 2ОН-
кислый раствор нейтральный или щелочной раствор
Если исходные соединения суммарно содержат меньшее число атомов кислорода, чем образующееся соединение, то недостаток их пополняется в кислых и нейтральных растворах за счет соответствующих количеств атомов кислорода из молекул воды, а в щелочных растворах – за счет ионов ОН-.
Для составления уравнений окислительно-восстановительных реакций в основном используют два метода: метод электронного баланса и метод полуреакций.
Метод электронного баланса основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции. Основное требование этого метода состоит в том, что число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем.
В качестве примера рассмотрим реакцию окисления сульфита калия дихроматом калия в кислой среде. Сначала определяют изменяющиеся степени окисления атомов элементов
 +
+  + H 2 SO 4 ®
+ H 2 SO 4 ®  +
+  + Н 2 О.
+ Н 2 О.
Затем составляют электронный баланс. Для этого подсчитывают число электронов, которое нужно присоединить всеми атомами окислителя, и число электронов, которые отдает восстановитель, и определяют наименьшее кратное. Затем делят наименьшее кратное на число полученных и отданных электронов и получают коэффициенты в уравнении реакции.
Например,

 окислитель 2Сr+6 + 6
окислитель 2Сr+6 + 6  = 2Cr+3 1 процесс восстановления
= 2Cr+3 1 процесс восстановления
восстановитель S+4 – 2  = S+6 3 процесс окисления
= S+6 3 процесс окисления
Полученные коэффициенты ставят перед окислителем и восстановителем и перед продуктами их окисления и восстановления, затем уравнивают ионы металла, не изменяющие своей степени окисления. Определяют коэффициент перед серой, уравнивают число атомов водорода и проверяют правильность подбора коэффициентов подсчетом числа атомов кислорода слева и справа в уравнении реакции.
В окончательном виде полное уравнение окислительно-восстановительной реакции будет иметь вид
K 2 Cr 2 O 7 + 3 K 2 SO 3 + 4 H 2 SO 4 = Cr 2(SO 4)3 + 4 K 2 SO 4 + 4 H 2 O.
Метод полуреакции или ионно-электронный метод предусматривает раздельное составление ионных уравнений для процесса окисления и для процесса восстановления с последующим суммированием их в общем ионном уравнении. Например, для реакции
|
|
HJ + H 2 SO 4 ® J 2 + H 2 S + H 2 O
процесс окисления: 2 J – = J 2 + 2 
процесс восстановления: SO 4-2 +10 H ++ 8  = H 2 S + 4 H 2 O
= H 2 S + 4 H 2 O

 2 J – = J 2 + 2
2 J – = J 2 + 2  4
4
SO 4-2 + 10 H ++ 8  = H 2 S + 4 H 2 O 1
= H 2 S + 4 H 2 O 1
При суммировании окислительного и восстановительного процессов получаем
8 J - + SO 4-2+ 10 H + = 4 J 2 + H 2 S + 4 H 2 O.
Молекулярное уравнение окислительно-восстановительной реакции будет иметь вид
8 HJ + H 2 SO 4 = 4 J 2 + H 2 S + 4 H 2 O.
Различают три основных типа окислительно-восстановительных реакций: межмолекулярные, внутримолекулярные и реакции диспропорционирования.
К межмолекулярным относятся реакции, в которых окислитель и восстановитель находятся в разных веществах. Например,
Н 20 +  = Сu 0 +
= Сu 0 +  ,
,  +
+ 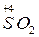 = 3 S 0 + 2 H 2 O.
= 3 S 0 + 2 H 2 O.
К внутримолекулярным относятся такие реакции, в которых окислитель и восстановитель находятся в одном и том же веществе, например
 =
=  +
+  ,
,  =
=  + 2 H 2 O.
+ 2 H 2 O.
К реакциям диспропорционирования относятся реакции, которые сопровождаются одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента. При этом исходное вещество образует соединения, одно из которых содержит атомы с более высокой, а другое с более низкой степенями окисления. Эти реакции возможны для веществ, содержащих атомы с промежуточной степенью окисления, например
 + 2 H 2 O =
+ 2 H 2 O =  +
+  + 4 KOH,
+ 4 KOH,
 =
= 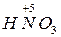 +
+ 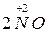 + H 2 O.
+ H 2 O.
Экспериментальная часть
Опыт 1. Окислительные свойства иона железа Fe+3
Налить в пробирку 1…2 мл раствора трихлорида железа и добавить по несколько капель раствора иодида калия и крахмального клейстера. Наблюдать появление синего окрашивания. Написать уравнение реакции восстановления иона Fe+3 в ион Fe+2.
Опыт 2. Восстановительные свойства иона железа Fe+2
В пробирку налить 1…2 мл 2 н раствора перманганата калия, добавить 2…3 капли 2 н раствора серной кислоты, затем по каплям добавить 0,5 н раствор сульфата железа (III). Что происходит? Напишите уравнение реакции.
Опыт 3. Окисление иона Cr+3 в Cr+6
Налить в пробирку 1…2 мл раствора соли трехвалентного хрома и добавить раствор гидроксида натрия (или калия) до растворения образующегося вначале осадка тригидроксида хрома. Написать уравнение образования хромита. Полученный раствор разделить на две пробирки. В одну добавить хлорной воды, а в другую – раствор пероксида водорода. Обратить внимание на изменение цвета раствора. Написать уравнения реакций окисления хромита в хромат.
Опыт 4. Окислительные свойства иона Cr+6
1. Налить в пробирку 1…2 мл раствора дихромата калия К2Cr2О7, подкислить серной кислотой (2…3 капли) и добавить 1…2 мл раствора сульфита натрия. Наблюдать появление зеленой окраски, характерной для ионов Cr+3. Написать уравнение реакции.
|
|
2. Налить в пробирку 1…2 мл раствора К2Cr2О7, подкислить серной кислотой и прилить 1…2 мл свежеприготовленного раствора соли железа (II). Наблюдать изменение окраски раствора. Написать уравнение реакции.
Опыт 5. Окислительные свойства иона Mn+7 в зависимости от реакции среды
1. В пробирку с 1…2 мл раствора перманганата калия (КMnО4), подкисленного несколькими каплями серной кислоты, прилить 2…3 мл раствора сульфита натрия. Наблюдать исчезновение окраски. Написать уравнение реакции восстановления Mn+7 в Mn+2.
2. Налить в пробирку 1…2 мл раствора перманганата калия и добавить 2…3 мл раствора сульфита натрия. Наблюдать изменение окраски раствора. Написать уравнение реакции восстановления Mn+7 в Mn+4.
3. Налить в пробирку 1…2 мл раствора перманганата калия и добавить 0,5…1 мл концентрированного раствора гидроксида натрия или калия и 2…3 мл раствора сульфита натрия. Наблюдать появление зеленой окраски. Написать уравнение реакции восстановления Mn+7 в Mn+6.
Контрольные вопросы и упражнения
1. Что такое степень окисления? Укажите основные правила ее определения.
2. Дайте определение окислительно-восстановительным реакциям, процессам окисления и восстановления.
3. Что такое окислитель и восстановитель? Какие Вы знаете важнейшие окислители и восстановители
4. Какие методы существуют для составления окислительно-восстановительных реакций?
5. Установите, какие из приведенных ниже реакций относятся к окислительно-восстановительным и укажите окислитель и восстановитель:
а) Fe + H2SO4 = FeSO4 + H2;
б) 2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O;
в) FeO + H2SO4 = FeSO4 + H2O;
г) 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
6. Какие из следующих веществ: Cl2, KMnO4, Na2S, KJ, H2, FeSO4, NaNO2, PbO2, Na2SO3, K2CrO4 – могут проявлять только окислительные свойства, какие – только восстановительные свойства, какие – как окислительные, так и восстановительные свойства?
7. Укажите тип окислительно-восстановительных реакций, укажите окислитель и восстановитель:
а) 3S + 6KOH = 2K2S + K2SO3 + 3H2O;
б) 2ZnS + 3O2 = 2 ZnO + 2SO2;
в) 2Na + Cl2 = 2NaCl;
г) 2NaClO3 = 2NaCl + 3O2;
д) 4NaClO3 = 3NaClO4 + NaCl.
8. Закончите следующие уравнения полуреакций:
а) Fe+3 ® Fe+2; б) MnO4– ® Mn+2; в) SO3-2 ® SO4-2 ;
г) NO2– ®NO3– ; д) S-2 ® S0.
9. Составьте электронные схемы и подберите коэффициенты в следующих уравнениях окислительно-восстановительных реакций:
HClO3 + H2S ® HCl + H2SO4;
KI + KIO3 + H2SO4 ® I2 + K2SO4 + H2O;
KBr + K2Cr2O7 + H2SO4® Br2 + Cr2(SO4)3 + K2SO4 + H2O;
CrCl3 + H2O2 + KOH ® K2CrO4 + KCl + H2O;
FeCl3 + HClO3 + HCl ® FeCl3 + H2O.
10. Окисление или восстановление происходит при переходах
а) NH3 ® NO для азота;
б) Cr2(SO4)3 ® K2CrO4 для хрома;
в) MnSO ® KMnO4 для марганца;
г) KMnO4 ® K2MnO4 для марганца.
Определить окислительно-восстановительный эквивалент для этих систем.
|
|
|

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Адаптации растений и животных к жизни в горах: Большое значение для жизни организмов в горах имеют степень расчленения, крутизна и экспозиционные различия склонов...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!