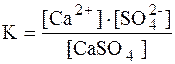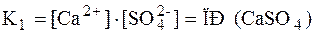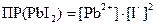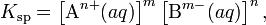Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода
Эсоли = Мсоли / произведение числа катионов на его заряд
Классификация растворов
По агрегатному состоянию
| дисперсная среда
| дисперсная фаза
| |
| газообразная
| Газ
Жидкость
твердая
| -воздух
- туман
- дым
|
| жидкость
| Газ
Жидкость
твердая
| - Минеральн. вода
- спирт
- сладк. чай, глюкоза, хлорист. кальций
|
| твердая
| Газ
Жидкость
твердая
| - любые пористые в-ва (пенопласт)
- почва, свежий хлеб
сплавы
|
2. Истинные р-ры (диаметр р-ра менее 1 нм) – глюкоза, сахар, р-ры солей
3. Грубодисперсные р-ры (диаметр р-ра 100 нм, термодинамически неустойчивы) – гашеная известь Ca(OH)2, -еще их называют суспензиям.
Эмульсии (жидкость в жидкости) – крем
4. Калоидные р-ры (образуют высокополимерные в-ва) – крахмал, белки. Присущ эффект Пендаля –опалесценция
14.Растворимость и произведение растворимости.
Под растворимостью понимают способность вещества растворяться в том или ином растворителе. Растворимость - это предельное содержание вещества в растворе, выше которого раствор теряет гомогенность, т. е. перестает быть раствором по определению, растворимость обозначается s = с (насыщенный раствор), где с - концентрация вещества (молярная концентрация) в насыщенном растворе, единица СИ - моль/м3. До сих пор растворимость часто приводят в граммах растворенного вещества на 100 г или 1 дм3 растворителя.
Отнесение массы растворенного вещества к массе или объему растворителя, а не раствора, как в иных случаях выражения состава (w, ф, с), составляет особенность расчетов, связанных с растворимостью.
Растворимостью также называют молярную концентрацию вещества в его насыщенном растворе, или любой способ выражения состава насыщенного раствора при данной температуре.
Растворимость зависит:
1) от природы вещества;
2) природы растворителя;
3) агрегатного состояния веществ;
4) наличия посторонних примесей;
5) температуры;
6) давления (для газов).
Растворимость твердых веществ при изменении температуры зависит от знака теплового эффекта процесса растворения.
Растворимость газов увеличивается при понижении температуры и зависит от давления газа над жидкостью. Эта зависимость выражается законом Генри: растворимость газа при постоянной температуре прямо пропорциональна давлению газа над раствором
При образовании насыщенного водного раствора малорастворимой соли в воде между твердой солью и перешедшими в раствор ионами устанавливается равновесие, например: CaSO4 ↔ Ca2+ + SO42-
Константа равновесия для этого процесса:
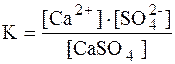
Знаменатель дроби – концентрация твердого вещества – постоянная величина, разделив на нее обе части уравнения, получаем:
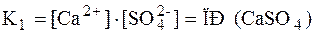
В насыщенном растворе слабого электролита произведение концентраций его ионов при данной температуре величина постоянная, называемая произведением растворимости (ПР) данного электролита.
Если электролит дает при диссоциации несколько одинаковых ионов, то их концентрации возводятся в это число.
Например: PbI2 ↔ Pb2+ + 2I-
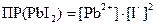
Произведение растворимости для сильного электролита требует учета электростатического взаимодействия между находящимися в растворе ионами. Это взаимодействие учитывается введением в формулу для коэффициентов активности i.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
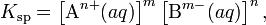
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.(Значения произведений растворимости приведены в справочниках).