Термический КПД произвольного цикла может быть определен через среднеинтегральные температуры по формуле:

 , (4.19)
, (4.19)
где  - среднеинтегральная температура подвода теплоты в процессе.
- среднеинтегральная температура подвода теплоты в процессе.
На рис. 4.4. приведены обратимые циклы А, B, C и D, которые имеют одинаковые максимальную  и минимальную
и минимальную  температуры. Из рисунка видно, что
температуры. Из рисунка видно, что  >
>  >
>  >
>  и
и  <
<  <
<  <
<  . Поэтому
. Поэтому  >
>  >
>  >
>  .
.

Рисунок 4.4 - К определению термического КПД цикла
Методы сравнения термических КПД обратимых циклов
Обычно сравнение циклов производится в sT -диаграмме двумя способами.
При сравнении первым способом основным критерием является коэффициент заполнения, равный отношению площади рассматриваемого произвольного цикла (пл. abcd на рис. 4.5,а) к площади цикла Карно, осуществляемого в том же интервале температур и энтропий, т.е. к пл. 1234. Любой произвольный цикл, вписанный в цикл Карно, имеет площадь, меньшую, чем площадь цикла Карно. Из двух циклов, осуществляемых в одном и том же интервале температур, большее значение  имеет тот цикл, у которого выше коэффициент заполнения.
имеет тот цикл, у которого выше коэффициент заполнения.
Второй способ основан на понятиях среднеинтегральных температур подвода и отвода теплоты в циклах и предполагает замену рассматриваемого произвольного цикла тепловой машины эквивалентным циклом Карно с температурами  и
и  . Чем выше среднеинтегральная температура подвода теплоты
. Чем выше среднеинтегральная температура подвода теплоты  и чем ниже среднеинтегральная температура отвода теплоты
и чем ниже среднеинтегральная температура отвода теплоты  , тем выше
, тем выше  произвольного цикла (рис. 4.5,б).
произвольного цикла (рис. 4.5,б).

Рисунок 4.5 - К методу сравнения термической КПД
Обобщенный цикл Карно
Теоретически любой обратимый цикл, например, abfe (рис. 4.6), в котором подвод и отвод теплоты производится по изотермам, может быть равнозначен по термодинамической эффективности обратимому циклу Карно abcd. В этом случае адиабаты расширения и сжатия цикла Карно должны быть заменены произвольными обратимыми процессами bf и ea, при условии эквидистантности в горизонтальном направлении. Вследствие эквидистантности линий bf и еа, количество теплоты, отданное рабочим телом в процессе bf (площадь f bb'f' ), равно количеству теплоты, полученному рабочим телом в процессе еа (площадь еаа'е'). Таким образом, в цикле осуществляется полная регенерация теплоты.
.

Рисунок 4.6 - Обобщенный (регенеративный) цикл Карно
После получения теплоты q 1 от внешнего источника рабочее тело направляется в регенератор, где по линии bf ему передается часть теплоты. На участке fе рабочее тело при Т 2 = const отдает теплоту q 2 внешнему приемнику, а затем движется через регенератор в обратном направлении и по линии еа получает от него теплоту. Линия подвода теплоты аb у цикла abfe и цикла Карно общая, поэтому q 1 для них одинаково. Одинаковы по величине и линии процессов отвода теплоты fe и сd, поэтому q 2 для них тоже одинаково. Следовательно, в соответствии с выражениями для термического КПД, термический КПД для обоих циклов:  , т.е. термический КПД рассмотренного обратимого цикла равен термическому КПД цикла Карно.
, т.е. термический КПД рассмотренного обратимого цикла равен термическому КПД цикла Карно.
Цикл, в котором принимают участие регенераторы теплоты, называется регенеративным циклом.
Обратимый регенеративный цикл, состоящий из двух изотерм и двух любых произвольных эквидистантных кривых, называется обобщенным регенеративным циклом Карно.
Литература: [2], с. 37-42; [5], с. 7- 9; [6], с. 35-48; [8], с. 54-104.
Вопросы для самоконтроля
1. Объясните, в чем отличие цикла от процесса.
2. Какие термодинамические процессы вам известны?
3. Из каких термодинамических процессов состоит прямой цикл Карно?
4. Из каких термодинамических процессов состоит обратный цикл Карно?
5. Чем оценивается эффективность прямого и обратного циклов Карно?
6. Для чего служат тепловые машины, работающие по прямому и обратному циклам?
7. Что такое термический КПД?
8. Что такое холодильный коэффициент?
9. Чему равно приращение энтропии в прямом и обратном циклах Карно?
10.Покажите на sT -диаграмме, что термический КПД прямого цикла Карно не может быть больше 1.
11.Покажите на sT -диаграмме, для прямого цикла Карно, что не все подведенное тепло превращается в полезную работу.
12.В чем состоит общность разных формулировок второго закона термодинамики?
13.Как изменяется энтропия изолированной системы при протекании в ней обратимых процессов?
14.Что такое энергия?
15.Чем определяется уменьшение работоспособности изолированной системы?
5 реальные газы и пары
5.1 Реальные газы
В реальных газах в отличие от идеальных существенны силы межмолекулярных взаимодействий (силы притяжения, когда молекулы находятся на значительном расстоянии друг от друга и силы отталкивания при достаточном сближении их друг с другом) и нельзя пренебречь собственным объемом молекул.
Для характеристики отличия термических свойств реального газа от свойств идеального газа обычно применяют коэффициент сжимаемости
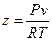 . (5.1)
. (5.1)
Если коэффициент сжимаемости z для идеального газа равен 1, то для реальных газов в зависимости от давления и температуры z может быть больше или меньше 1. На рис. 5.1 приведена зависимость коэффициента сжимаемости некоторых реальных газов от давления при температуре 0°С. Зависимость z(P) при T=const для идеального газа – горизонтальная прямая. Для реального газа с увеличением давления z сначала уменьшается, а затем увеличивается. Это связано с наличием сил взаимного притяжения между молекулами, которые делают газ более сжимаемым, а наличие объема самих молекул, которые уменьшают свободный объем, делает реальный газ менее сжимаемым.
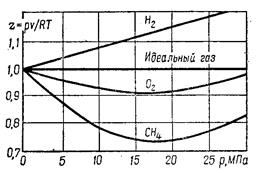
Рисунок 5.1 - Зависимость z(P) для некоторых газов при температуре 0 °С
Теория идеальных газов не учитывает свойство газов при определенных условиях изменять свое агрегатное состояние (превращение газа в жидкость).
Простейшее уравнение состояния реальных газов – уравнение Ван-дер-Ваальса:
 , (5.2)
, (5.2)
где  - характеристика внутреннего давления, обусловленного силами притяжения молекул;
- характеристика внутреннего давления, обусловленного силами притяжения молекул;
 свободный объем, т.е. объем пространства, в котором могут перемещаться молекулы, где
свободный объем, т.е. объем пространства, в котором могут перемещаться молекулы, где  - тот наименьший объем, до которого можно сжать газ.
- тот наименьший объем, до которого можно сжать газ.
Уравнение Ван-дер-Ваальса отражает непрерывность газообразного и жидкого состояний и отражает параметры обеих фаз. Изотермы, построенные по уравнению Ван-дер-Ваальса для разных температур изображены на рис. 5.2.

Рисунок 5.2 - Изотермы Ван-дер-Ваальса
Уравнение Ван-дер-Ваальса – уравнение 3-й степени относительно объема и имеет три корня (3 действительных при Т < Т кр, т.е. v 1> v 2> v 3; 1 действительный и 2 мнимых при Т > Т кр, т.е. каждому давлению соответствует определенный объем; все 3 корня действительны и равны между собой при Т = Т кр, т.е. v 1 = v 2 = v 3). Участок изотермы справа от т. 2 (область больших объемов) близок к изотерме идеального газа.
Фазовые переходы веществ
Известно, что вода (как и любое вещество) в зависимости от давления и температуры может находиться в твердом, жидком и газообразном состояниях: лед, вода, водяной пар.
Переход вещества из твердого состояния в жидкое называется плавлением, из твердого в газообразное - сублимацией или возгонкой, из жидкого в газообразное - испарением. Обратные процессы называют соответственно затвердеванием или кристаллизацией, десублимацией и конденсацией.
Говоря о фазовых переходах прежде всего необходимо дать определение гомогенных и гетерогенных термодинамических систем.
Гомогенная система - термодинамическая система, между частями которой нет поверхностей раздела. Примером гомогенных систем являются смеси газов,
жидкие и твердые растворы, а также любое химически однородное тело, которое находится в каком-либо одном агрегатном состоянии.
Гетерогенная система - термодинамическая система, состоящая из отдельных областей, разграниченных поверхностями раздела. Гомогенные области в гетерогенной системе называютсяфазами.
Каждая фаза отделена друг от друга поверхностью раздела, при переходе через которую скачкообразно изменяются физические свойства вещества. Примером может служить: вода-лед, химический состав этих фаз одинаков, но их физические свойства различны.
Вещество может переходить из одной фазы в другую и этот переход называется фазовым переходом или фазовым превращением.
Переход вещества из одной фазы в другую происходит при определенной температуре, при которой могут существовать две или три его фазы. Равновесное состояние фаз вещества, способных превращаться одна в другую, называется фазовым равновесием. Равновесное состояние фаз удобно изображать графически на ТР -диаграмме, где фазовые переходы изображаются точками. Точку, в которой находятся в равновесии три фазы одновременно, называют тройной точкой. На рис. 5.3 приведена Тр -диаграмма состояния воды с нанесенными на ней кривыми фазовых переходов.

Рисунок 5.3 - Изменение состояния вещества в ТР -диаграмме
Из рисунка видно, что ТР -диаграмма разделена кривыми АВ, АК и АD на три области: I - область жидкого состояния (вода), II - область парообразного состояния (пар) и III - область твердого состояния (лед).
Точка пересечения трех кривых фазового равновесия А представляет собой тройную точку, в которой одновременно существуют три фазы: вода, пар и лед. Параметры тройной точки для воды: РА = 611,2 Па; vА = 0,001 м3/кг; ТА = 273,16 К.
Изобара Р1abd характеризует процесс перехода твердого вещества в водяной пар. На участке изобары Р1а происходит нагревание твердого вещества. В точке а на кривой плавления АВ оно превращается в жидкость. Температура, при которой осуществляется это фазовое превращение, называется температурой плавления, а количество подводимой теплоты - скрытой теплотой плавления. Отрезок изобары ab характеризует процесс нагревания жидкости. В точке b, расположенной на кривой кипения АК, жидкость превращается в пар. Дальнейшее продвижение по изобаре от точки b к точке d соответствует нагреванию пара. В точке d содержится перегретый пар. Из ТР -диаграммы видно, что кривая насыщения АК в верхней части заканчивается критической точкой К. Выше критической точки переход жидкого состояния в пар происходит непосредственно, минуя стадию двухфазного состояния.
Газообразное тело в состоянии, близком к кипящей жидкости, называется паром, а процесс превращения вещества из жидкого состояния в пар называется парообразованием. Испарение является фазой процесса парообразования. Вторая фаза этого процесса - кипение. Процесс кипения - это процесс парообразования по всему объему жидкости. Если от пара отводить теплоту, то пар будет превращаться в жидкость - этот процесс называется конденсацией, который также происходит при вполне определенной температуре, зависящей от природы вещества и давления. Жидкость, получаемую при конденсации пара, называют конденсатом.
Если над поверхностью жидкости неограниченное пространство, то испарение будет полным. Если испарение происходит в закрытом сосуде, то в некоторый момент наступает термодинамическое равновесие между испарением и обратным переходом молекул из пара в жидкость. В этот момент в пространстве будет находиться максимально возможное количество молекул. Пар в этом состоянии имеет максимальную плотность и называется насыщенным паром. Предельным состоянием насыщенного пара является сухой насыщенный пар (в момент испарения последней капли жидкости в ограниченном пространстве без изменения Т и Р).
Состояние сухого насыщенного пара неустойчиво и может быть зафиксировано лишь в момент исчезновения жидкой фазы.
Подвод теплоты к сухому насыщенному пару приводит к повышению его температуры. Пар, получаемый в этом процессе, называется перегретым. Перегретый пар имеет при данном давлении более высокую температуру и больший удельный объем, чем сухой насыщенный пар.
Механическая смесь, состоящая из сухого пара и мельчайших капелек жидкости, равномерно распределенных по всей массе пара, называется влажным паром.
Массовая доля сухого пара во влажном называется степенью сухости (х):
 , (5.2)
, (5.2)
где m" - масса сухого насыщенного пара; m' - масса жидкости.
Массовая доля кипящей жидкости во влажном паре называется степенью влажности (у):
 , (5.3)
, (5.3)
Степень сухости и влажности не могут быть больше единицы
у + х = 1 (5.4)
Для кипящей жидкости при температуре насыщения Т н х= 0, а для сухого пара х = 1. Следовательно, степень сухости может меняться в пределах 0£ х £1.
Как отмечалось ранее, парообразование всегда сопровождается конденсацией и наоборот - испарением, поэтому температуры кипения и конденсации при заданном давлении одинаковы. Их объединяют под общим названием - температуры насыщения Тн.
Температура насыщения - это наибольшая температура существования жидкости и наименьшая температура существования пара при данном давлении. С ростом давления температура насыщения повышается. Зависимость Тн = ¦(Р) в диаграмме Тр называется кривой насыщения.




 , (4.19)
, (4.19) - среднеинтегральная температура подвода теплоты в процессе.
- среднеинтегральная температура подвода теплоты в процессе. и минимальную
и минимальную  температуры. Из рисунка видно, что
температуры. Из рисунка видно, что  >
>  >
>  >
>  и
и  <
<  <
<  <
<  . Поэтому
. Поэтому  >
>  >
>  >
>  .
.
 имеет тот цикл, у которого выше коэффициент заполнения.
имеет тот цикл, у которого выше коэффициент заполнения. и
и  . Чем выше среднеинтегральная температура подвода теплоты
. Чем выше среднеинтегральная температура подвода теплоты 

 , т.е. термический КПД рассмотренного обратимого цикла равен термическому КПД цикла Карно.
, т.е. термический КПД рассмотренного обратимого цикла равен термическому КПД цикла Карно.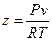 . (5.1)
. (5.1)
 , (5.2)
, (5.2) - характеристика внутреннего давления, обусловленного силами притяжения молекул;
- характеристика внутреннего давления, обусловленного силами притяжения молекул; свободный объем, т.е. объем пространства, в котором могут перемещаться молекулы, где
свободный объем, т.е. объем пространства, в котором могут перемещаться молекулы, где  - тот наименьший объем, до которого можно сжать газ.
- тот наименьший объем, до которого можно сжать газ.

 , (5.2)
, (5.2) , (5.3)
, (5.3)


