Филиал в г. Сургуте
Кафедра естественно-научных
и гуманитарных дисциплин
ХИМИЯ
Методические указания к лабораторным работам
и самостоятельной работе для студентов направления
21.03.01 «нефтегазовое дело» всех форм обучения.
Составитель О.Л. Шепелюк,
Кандидат химических наук, доцент
Тюмень
ТюмГНГУ
Химия: методические указания к лабораторным работам и самостоятельной работе для студентов направления 21.03.01 «нефтегазовое дело» всех форм обучения / сост. Шепелюк О.Л.; Тюменский государственный нефтегазовый университет. - 1-е изд. - Тюмень: Издательский центр БИК, 2016. – 44 с.
Методические указания рассмотрены и рекомендованы к изданию на заседании кафедры естественно-научных и гуманитарных дисциплин.
«29» декабря 2015 года, протокол №4
Аннотация
В методическим указании содержатся описания лабораторных работ и методика их выполнения. Порядок следования работ соответствует очередности изложения тем в лекционном курсе и эффективно его дополняет. В описании каждой лабораторной работы представлен раздел «Вопросы для самоконтроля», позволяющий студентам самостоятельно подготовится к тестированию по данной теме.
ВВЕДЕНИЕ
Методические указания к лабораторным работам предназначены для студентов направления 21.03.01 «нефтегазовое дело», в учебные планы которых входит дисциплина «Химия».
Лабораторные работы соответствуют дидактическим единицам курса химии. Основные цели, преследуемые при выполнении этих работ, состоят в том, чтобы помочь студентам приобрести навыки выполнения химического эксперимента, обработки результатов опытов, выполнения требований техники безопасности при работе в лаборатории.
В данном пособии представлено пять лабораторных работ. Каждая работа включает теоретическую часть, вопросы для самоконтроля, которые позволяют подготовиться к тесту по данной теме, и описание лабораторного эксперимента.
Методика и условия проведения опытов, объекты исследований выбраны таким образом, чтобы обеспечить полную самостоятельность студентов при выполнении лабораторной работы.
Выполнение лабораторного практикума способствует формированию у студента компетенций, прописанных в ФГОС ВО по данной дисциплине:
- способностью к самоорганизации и самообразованию;
- способностью использовать основные законы естественнонаучных дисциплин в профессиональной деятельности, применять методы математического анализа и моделирования, теоретического и экспериментального исследования;
- способностью применять процессный подход в практической деятельности, сочетать теорию и практику.
После проведения представленных лабораторных работ студент должен
- знать: химические свойства элементов и их соединений, термодинамические и кинетические условия протекания химических реакций, равновесие в гомогенных и гетерогенных системах, правила безопасной работы в учебно-научных лабораториях;
- уметь: определять концентрации растворов различных соединений, термодинамические характеристики химических реакций и равновесные концентрации веществ, скорость реакции и влияние различных факторов на неё, анализировать полученные данные, выявлять общую закономерность их изменения;
- владеть: навыками выполнения основных химических лабораторных операций.
После выполнения лабораторной работы студент должен отчет по следующей форме:
- номер, название, цель и ход лабораторной работы
- основные расчетные формулы (если они есть в методичке)
- схема установки, таблицы и графики (если они есть в методичке)
- выводы
Основные правила по технике безопасности
Правила пожарной безопасности
1. При проведении опытов, в которых может произойти самовозгорание, необходимо иметь под руками огнетушители, песок, войлок.
2. В случае воспламенения горючих веществ отключите электроэнергию, примите меры к тушению пожара. В случае возгорания большой площади покиньте аудиторию и вызовите специальные службы.
3. В случае воспламенения щелочных металлов, нефтепродуктов не тушите пламя водой.
Лабораторная работа № 1
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Цель работы: рассмотрение реакций комплексообразования, строение комплексов, определение устойчивости комплексов.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Соединения сложного состава, в которых можно выделить центральный атом и непосредственно связанные с ним молекулы или ионы называются комплексными или координационными соединениями. Существование комплексных соединений было установлено Альфредом Вернером, награжденным в 1913 году Нобелевской премией за разработку химии координационных соединений.
Строение комплексных соединений.
K3+[Fe3+(CN)6−] [Co3+(NH3)60]Cl3−
лиганды лиганды
комплексообразователь комплексообразователь
Fe3+, Co3+ - комплексообразователь, всегда пишется на первом месте после квадратных скобок. Комплексообразователем, как правило, являются металлы и чаще всего d-элементы, но существует целый ряд комплексных соединений, где центральным атомом служит неметалл – Si, P, As.
CN−, NH30 – лиганды, молекулы или ионы, окружающие центральный атом, представлены нейтральными молекулами или анионами. Лигандами могут быть и сложные органические соединения.
[Fe3+(CN)6−]3−, [Co3+(NH3)60]3+ - комплексный ион или внутренняя сфера, в зависимости от степени окисления может быть комплексным катионом, комплексным анионом, электронейтральным комплексом.
K+, Cl− - ионы составляющие внешнею сферу.
Координационное число комплексообразователя – это число лигандов, координированных вокруг центрального атома, обычно бывает четным числом - 2, 4, 6, 8(таблица1). Координационное число центрального атома металлы не связано с его степенью окисления, но, как правило, превышает её.
В зависимости от числа донорных атомов лиганда, различают моно-, би- и полидентантные лиганды. Лиганды, координирующиеся через два или более донорных атомов к одному центральному атому, называются хелатными.
Таблица 1
Координационное число комплексообразователей
| Комплексообразователи
| Характерное координационное число
|
| Cu+, Ag+, Au+
|
|
| Cu2+, Hg2+, Pb2+, Pt2+, Pd2+, Al3+, Zn2+
|
|
| Ni2+, Ni3+, Co3+
| 4 или 6
|
| Fe2+, Fe3+, Pt4+, Pd4+, Si4+,Cr3+
|
|
Комплексные соединения, в которых два или более комплексообразователя, называются би- или полиядерными комплексными соединениями – [Sn2(OH)2]2+, [Sn3(OH)4]2+, чаще всего данные комплексы образуются при гидролизе.
Составление формул комплексных соединений
При составлении формулы внутренней сферы на первом месте после квадратных скобок пишется центральный атом, т.е. комплексообразователь. Затем лиганды с указанием их числа –n, если лиганды разные, то они записываются в следующем порядке – нейтральные лиганды с указанием их числа, потом анионы, также с указанием их числа.
Например: [Co3+(NH3)50 Cl−]2+, [Pt4+(NH3)40Cl2−]2+
При составлении формулы комплексного соединения индексы следует расставить таким образом, чтобы сумма всех зарядов была равна нулю.
Например: K22+[Pt4+(OH)6−]2−
Классификация комплексных соединений
В зависимости от заряда комплексного иона комплексные соединения делятся на катионные, анионные и нейтральные:
| катионные
| анионные
| нейтральные
|
| [Cu(NH3)4]2+(OH)2−
[Ni(H2O)4]2+Cl2−
[Cr(H2O)5Cl]2+Cl2−
| K2+[PtF6]2−
K3+[Co(CN)6]3−
Na2+[PdCl6]2−
| [Ni(CO)4]
[Pt(NH3)2Cl2]
[Fe(NH3)4Cl2]
|
Также комплексные соединения делятся на кислоты, основания и соли.
Номенклатура комплексных соединений
Образование названий анионных и катионных комплексов отличается. Название катионного комплекса начинают записывать с названия внешней сферы, затем одним словом пишется название комплексного катиона, начало которого составляет название лигандов (таблица 2) с указанием их числа, обозначаемого префиксами – ди-, три-, тетра-, пента-, гекса-. Последним записывают комплексообразователь с указанием степени окисления римской цифрой.
Например:
[Cu(NH3)4](OH)2 − гидроксид тетраамминмеди(II)
[Cr(H2O)5Cl]Cl2 − хлорид хлоропентааквахрома(III)
[Co(NH3)4(NO2)Cl]NO3 − нитрат хлоронитротетраамминкобальта(III)
Образование названий анионных комплексов начинают с названия комплексного аниона в соответствии с теми же правилами, что и названия комплексного катиона, но с добавлением суффикса «ат» к названию комплексообразователя. Затем называют ионы внешней сферы.
Например:
K3[Co(CN)6] − гексацианокобальтат(III) калия
K[Pt(NH3)Cl3] − трихлороамминплатинат(II) калия
K[Au(CN)2] − дицианоаурат(I) калия
Образование названий нейтральных комплексов начинается с названия и числа лигандов, затем называется комплексообразователь и его степень окисления.
Например:
[Ni(CO)4] − тетракарбонилникеля
[Pt(NH3)2Cl2] − дихлородиамминплатины(II)
Таблица 2
Номенклатура лигандов
| лиганды
| название
| лиганды
| название
|
| H2O
NH3
CO
NO
CS
OH−
| аква-
аммин-
карбонил-
нитрозил-
тиокарбонил-
гидроксо-
| F−
Cl−
Br−
I−
CN−
NCS−
NO2−
| фторо-
хлоро-
бромо-
йодо-
циано-
тиоциано- (родано-)
нитро-
|
Пространственное строение комплексных соединений
В пространстве комплексные ионы имеют форму многогранников (в соответствии с моделью Кеперта, атом металла лежит в центре многогранника, а лиганды располагаются в вершинах многогранника). Возможны следующие конфигурации:
- линейное расположение:
комплексы с координационным числом 2 − [CuCl2]−, [Ag(CN)2]−.
- плоский равносторонний треугольник:
комплексы с координационным числом 3 − [HgI3]−.
- тетраэдрическая конфигурация:
комплексы с координационным числом 4 − [BF4]−.
- плоский квадрат:
комплексы с координационным числом 4 − [Pt(NH3)2Cl2].
- тригонально-бипирамидальная конфигурация:
комплексы с координационным числом 5 − [Fe(CO)5].
- октаэдрическая конфигурация:
комплексы с координационным числом 6 − [PtCl6]2−.
Изомерия комплексных соединений
Рассматривают два типа изомерии комплексных соединений. Первый тип изомеров – при котором состав внутренней сферы не изменяется, это может быть пространственная или оптическая изомерия.
Например:
Пространственные изомеры комплексного соединения [Pt(NH3)2Cl2] (по положению лигандов относительно комплексообразователя)


а б
Рис. 1 Пространственный комплекс: а – цис-изомер, б – транс-изомер
Второй тип комплексных изомеров – при котором меняется состав внутренней сферы – ионизационная, гидратная изомерия.
Например:
Гидратная изомерия комплексного соединения [Cr(H2O)6]Cl3:
[Cr(H2O)5Cl]Cl2 ∙ H2O; [Cr(H2O)4Cl2]Cl∙2H2O
Устойчивость комплексных соединений
В водном растворе диссоциация комплексных соединений протекает полностью на внешнию сферу и комплексный ион. Диссоциация комплексного иона протекает незначительно и характеризуется так называемой константой нестойкости.
[Fe(CN)6]4− ↔ Fe2+ + 6CN−

В таблице 3 представлены константы нестойкости ряда комплексных ионов.
Таблица 3
Константы нестойкости комплексных ионов
| Комплексный ион
| Константа
нестойкости
| Комплексный ион
| Константа
нестойкости
|
| [Al(OH)4]−
| 1·10-33
| [Ag(NH3)2]2+
| 1·10-27
|
| [Cr(OH)6]3−
| 7,94·10-29
| [Fe(SCN)6]3−
| 1,7·10-3
|
| [Zn(OH)4]2−
| 5,02·10-17
| [Cu(SCN)4]2−
| 3,02·10-7
|
| [Cu(NH3)4]2+
| 1,07·10-12
| [AgI2]−
| 5,5·10-11
|
В таблице 4 представлена классификация комплексообразователей по способности их гидроксидов растворяться в избытке щелочи или аммиака, образуя соответствующие комплексные соединения.
Таблица 4
Растворимость гидроксидов
| комплексообразователи
| растворимость
|
| Zn2+, Al3+, Sn2+, Cr3+
| гидроксиды амфотерны, растворяются в избытке щелочи
|
| Сo2+, Ni2+, Cu2+, Cd2+, Hg2+
| гидроксиды растворяются в избытке аммиака
|
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
- приступая к выполнению лабораторной работы получите у преподавателя номера заданий;
- для составления формул комплексных соединений воспользуйтесь таблицей 1.
Опыт 1. Получение гидроксокомплексных соединений.
- составьте уравнения реакций в молекулярном и ионном виде.
- напишите название полученного комплексного соединения.
- напишите выражение для константы нестойкости комплексного иона и выпишите из справочника его значение.
- запишите наблюдения
а) В пробирку внесите 5-6 капель хлорида алюминия и по каплям прибавляйте раствор гидроксида калия, сначала до образования осадка и затем до его полного растворения.
б) В пробирку внесите 5-6 капель нитрата хрома и по каплям прибавляйте раствор гидроксида калия, сначала до образования осадка и затем до его полного растворения.
в) В пробирку внесите 5-6 капель хлорида цинка и по каплям прибавляйте раствор гидроксида калия, сначала до образования осадка и затем до его полного растворения.
Опыт 2. Получение аминокомплексных соединений.
- составьте уравнения реакций в молекулярном виде.
- напишите название полученного комплексного соединения.
- напишите выражение для константы нестойкости комплексного иона и выпишите из справочника его значение.
- запишите наблюдения.
а) В пробирку внесите 5-6 капель сульфата меди и по каплям прибавляйте раствор гидроксида аммония, сначала до образования осадка и затем до его полного растворения.
б) Во пробирку внесите 5-6 капель сульфата никеля и по каплям прибавляйте раствор гидроксида аммония, сначала до образования осадка и затем до его полного растворения.
в) В пробирку внесите 5-6 капель нитрата серебра и по каплям прибавляйте раствор гидроксида аммония, сначала до образования осадка и затем до его полного растворения.
Опыт 3. Получение комплексных соединений других групп.
- составьте уравнение реакции в молекулярном виде.
- напишите название полученного комплексного соединения.
- напишите выражение для константы нестойкости комплексного иона и выпишите из справочника его значение.
- запишите наблюдения.
а) В пробирку внесите 5-6 капель хлорида железа(III) и по каплям прибавляйте раствор роданида калия до изменения окраски раствора.
! Повторите опыт с сульфатом железа (II). Внесите в пробирку сульфат железа на кончике шпателя и долейте 5 мл дистиллированной воды. Внесите в пробирку 1-2 капли роданида калия.
б) В пробирку внесите 5-6 капель нитрата хрома и по каплям прибавляйте раствор роданида калия до изменения окраски раствора.
в) В пробирку внесите 5-6 капель нитрата серебра и по каплям прибавляйте раствор иодида калия до образования осадка и его полного растворения.
Опыт 4. Реакции ионного обмена с участием комплексных соединений.
- составьте уравнение реакции в молекулярном и ионном виде.
- напишите название полученного комплексного соединения.
- запишите наблюдения.
а) В пробирку внесите 5-6 капель хлорида железа (III) и по каплям прибавляйте раствор гексацианоферрата (II) калия.
б) В пробирку внесите на кончике шпателя сульфат железа (II), растворите в воде и по каплям прибавляйте раствор гексацианоферрата (III) калия.
в) В пробирку внесите 5-6 сульфата меди и по каплям прибавляйте раствор гексацианоферрата (II) калия.
г) В пробирку внесите 5-6 капель сульфата никеля и по каплям прибавляйте раствор гексацианоферрата (II) калия.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Какое выражение соответствует константе нестойкости комплексного иона в соединении Na3[Co(NO2)6]?
2. В каком соединении степень окисления комплексообразователя наименьшая?
| 1) [Cu(NH3)4]SO4
| 2) [Ni(NH3)6]Cl2
| 3) [Hg(NH3)4](NO3)2
|
| 4) [Ag(NH3)2]Cl
| 5) [Co(NH3)4]Cl2
|
|
3. Чему равно координационное число комплексообразователя в соединении [Co(NH3)2(H2O)4]Cl3?
4. Указать формулу гексацианоферрат (II) калия.
| 1) K3[Fe(CN)6]
| 2) K4[Ni(CN)6]
| 3) K3[Co(CN)6]
|
| 4) K2[Pt(CN)4]
| 5) K4[Fe(CN)6]
|
|
5. Сравнив константы нестойкости, указать самый нестойкий ион.
Лабораторная работа № 2
ЗАМЕРЗАНИЕ РАСТВОРОВ
Цель работы: определить температуру замерзания растворителя (воды), молярных растворов хлорида калия; вычислить степень диссоциации растворов хлорида калия и сравнить их между собой.
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Термодинамика процесса растворения.
Растворение веществ происходит с различными тепловыми эффектами.
Тепловой эффект сольватации - количество теплоты, которая выделяется при взаимодействии растворенного вещества с молекулами растворителя и образование связей между ними. Тепловой эффект, сопровождающий процесс растворения, относящийся к 1 молю растворенного вещества, называется молярной теплотой растворения ΔНраств.
ΔНраств. = ∆Н1 + ∆Н2
где ∆Н1 - количество теплоты, затраченной на распределение частиц растворяемого вещества среди молекул растворителя; или для твердого вещества, энергия необходимая для разрушения кристаллической решетки и энергия необходимая для разрыва связей между молекулами растворителя (процесс эндотермический).
∆Н2 - тепловой эффект сольватации (процесс экзотермический).
Сольватация - электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества и растворителя. Сольватация в водных растворах называется гидратацией.
В зависимости от того преобладает первая или вторая составляющие, процесс растворения может быть экзотермический или эндотермический:
если ∆Н2>∆Н1, процесс экзотермический и ∆Н < 0;
если ∆Н2 < ∆Н1, процесс эндотермический и ∆Н > 0.
Так, например, тепловой эффект растворения:
 раств.(NH4NO3) = 26,5 кДж/моль,
раств.(NH4NO3) = 26,5 кДж/моль,  раств.(Н2SO4) = −74,2 кДж/моль.
раств.(Н2SO4) = −74,2 кДж/моль.
Коллигативные свойства растворов.
Свойства растворов, которые зависят только от концентрации частиц в растворе и не зависят от природы растворенного вещества, называются коллигативными.
Коллигативные свойства разбавленных растворов могут быть описаны количественно и выражены в виде законов. К ним относятся:
- давление насыщенного пара растворителя над раствором (закон Рауля)
- понижение температуры замерзания раствора
- повышение температуры кипения раствора
- осмотическое давление
1 закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.

p0 - давление насыщенного пара над растворителем, Па
p - давление насыщенного пара над раствором, Па
n0 - число моль растворителя
n - число моль растворенного вещества.
2 закон Рауля: понижение температуры замерзания и повышение температуры кипения раствора прямо пропорционально моляльной концентрации раствора (число моль растворенного вещества в 1 кг растворителя):
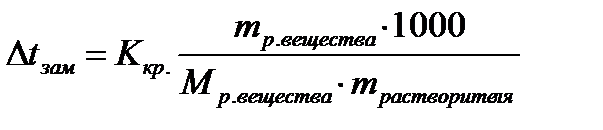

Ккр. – криоскопическая константа, Кэб. – эбулиоскопическая константа, выбираются для растворителя, кг·К/моль
mр. вещества – масса растворенного вещества, г
Мр. вещества – молярная масса растворенного вещества, г/моль.
mрастворителя – масса растворителя, г.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Задание выполняется на установке, которая представлена на рисунке 1.
В кристаллизаторе 1 приготовьте охлаждающую смесь, состоящую из снега и поваренной соли: 3-5 чайных ложек соли на 5-8 ложек снега.
В стакан 3 налейте 5 -6 мл дистиллированной воды и поместите его в охлаждающую смесь.
Помешивая воду термометром (осторожно, чтобы не разбить термометр), определите температуру замерзания воды. Температурой замерзания считать ту, которую покажет термометр после появления первого кристаллика льда в замораживаемой жидкости.
Аналогично определите температуру замерзания 1 и 2 раствора выданной преподавателем соли. Результаты запишите в таблицу 1.

Рис. 1. Схема установки для определения температуры замерзания:
1 - термометр; 2 - стакан с водой или раствором; 3 - охлаждающая смесь.
Таблица 1
| Система
| tзам
| Δtзам
| Изотонический коэффициент i
| Степень диссоциации α
|
| H2O
|
| -
| -
| -
|
| С1, моляльный раствор
|
|
|
|
|
| С2, моляльный раствор
|
|
|
|
|
Рассчитайте изотонический коэффициент i. используя формулу
Δtзам = i ∙K∙Cm,
Δtзам = tзам(р-ля) - tзам(р-ра)
K- криоскопическая константа растворителя, К(H2O)=1,86
Cm- моляльность раствора
По полученным данным рассчитайте степень диссоциации раствора KCl в воде по формуле: α = 
n – число ионов, на которые распадается данная молекула.
Постройте график зависимости температуры замерзания раствора от концентрации растворенной соли.
Сделайте выводы:
1. Сравните температуру замерзания растворителя и растворов, сравните температуру замерзания двух растворов разной концентрации;
2. Сравните степени диссоциации двух растворов разной концентрации.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Вычислить понижение температуры замерзания раствора, если в 550 г бензола растворили 60 г гексана (C6H14), криоскопическая постоянная бензола - Ккр =5,07 К·кг/моль.
2. Вычислить повышение температуры кипения раствора, если в 320 г воды растворить 15 г этанола (C2H5OН), эбулиоскопическая постоянная воды –Кэб= 0,52 К·кг/моль.
3. Вычислить молярную массу этанола, если при растворении в 550 г воды 65 г этанола понижение температуры замерзания раствора составило 4,78ºC, криоскопическая постоянная воды - Ккр=1,86 К·кг/моль.
4. Вычислить осмотическое давление раствора при температуре 26ºC, если в 1 литре раствора содержится 140 г глюкозы.
5. При растворении в 850 г воды 25 г сульфата марганца экспериментальное значение повышения температуры кипения раствора составило 0,18ºC, эбулиоскопическая постоянная воды – Кэб =0,52 К·кг/моль. Вычислить степень диссоциации сульфата марганца.
Лабораторная работа № 3
Теоретическая часть
Титриметрический анализ - это метод количественного химического анализа, основанный на измерении объема раствора реактива с точно известной концентрацией, расходуемого для реакции с определяемым веществом.
Титриметрическое определение вещества проводится титрованием - добавлением одного из растворов к другому небольшими порциями и отдельными каплями при постоянном фиксировании (контроле) результата.
Один их двух растворов содержит вещество в неизвестной концентрации и представляет собой анализируемый раствор.
Второй раствор содержит реагент с точно известной концентрацией и называется рабочим раствором, стандартным раствором или титрантом.
Требования к реакциям, применяемым при титриметрическом анализе:
1. Возможность фиксировать точку эквивалентности, наиболее широко используют наблюдение за его окраской, которая может меняться при следующих условиях:
- одно из реагирующих веществ окрашено, и окрашенный реагент в процессе реакции изменяет свой цвет;
- применяемые вещества – индикаторы - изменяют окраску в зависимости от свойств раствора (например, в зависимости от реакции среды).
2. Количественное течение реакции, вплоть до равновесия, характеризуемого соответствующей величиной константы равновесия
3. Достаточная скорость химической реакции, т.к. фиксировать точку эквивалентности при медленно текущих реакциях крайне трудно.
4. Отсутствие побочных реакций, при которых точные вычисления невозможны.
Методы титриметрического анализа можно классифицировать по характеру химической реакции, лежащей в основе определения веществ: кислотно-основного титрования (нейтрализации), осаждения, комплексообразования, окисления-восстановления.
Работа с растворами.
Мерные колбы предназначены для измерения точного объема жидкости. Они представляют собой круглые плоскодонные сосуды с узким длинным горлом, на котором имеется метка, до которой следует наполнять колбу (рис. 1).

Рис.1 Мерные колбы
Порядок работы с бюреткой
1. Бюретку промывают дистиллированной водой.
2. Подготовленную к работе бюретку закрепляют вертикально в штативе, с помощью воронки наливают в бюретку раствор так, чтобы его уровень был выше нулевой отметки.
3. Из нижнего оттянутого конца бюретки удаляют пузырьки воздуха. Для этого отгибают его кверху и выпускают жидкость до тех пор, пока весь воздух не будет удален. Затем опускают капилляр вниз.
4. Уровень жидкости в бюретке устанавливают на нулевое деление.
5. При проведении титрования нажимают на резиновую трубку сбоку от шарика и сливают жидкость из бюретки в колбу, вращая последнюю. Сначала титрант, находящийся в бюретке, сливают тонкой струйкой. Когда же окраска индикатора в месте падения капель титранта начнет изменяться, раствор приливают осторожно, по каплям. Титрование прекращают, когда наступает резкое изменение окраски индикатора от приливания одной капли титранта, и записывают объем израсходованного раствора.
6. По окончании работы титрант из бюретки сливают, бюретку промывают дистиллированной водой.
Метод кислотно-основного титрования (нейтрализации)
Метод кислотно-основного титрования основан на реакции взаимодействия кислот и оснований, т.е. на реакции нейтрализации:
H+ + OH¯ = H2O
При выполнении данного задания используется метод кислотно-основного титрования, основанный на применении реакции нейтрализации:
2NaOH + H2SO4 = Na2SO4 + 2H2O
Метод заключается в том, что к раствору определяемого вещества - гидроксида натрия – постепенно прибавляют раствор серной кислоты известной концентрации. Добавление раствора кислоты продолжают до тех пор, пока его количество не станет эквивалентным количеству реагируемого с ним гидроксида натрия, т.е. до нейтрализации щёлочи. Момент нейтрализации устанавливают по изменению окраски индикатора, прибавляемого в титруемый раствор. По закону эквивалентов в соответствии с уравнением:
Сн(к-ты)· V(к-ты)= Cн (щелочи)· V(щелочи)
Сн(к-ты)и Cн (щелочи) – молярные концентрации эквивалентов реагирующих растворов, моль/л;
V(к-ты)и V(щелочи)– объёмы реагирующих растворов, л (мл).

С(NaOH) и  - молярные концентрации эквивалента NaOH и H2SO4 в реагирующих растворах, моль/л;
- молярные концентрации эквивалента NaOH и H2SO4 в реагирующих растворах, моль/л;
V(NaOH) и  ) - объёмы реагирующих растворов щёлочи и кислоты, мл.
) - объёмы реагирующих растворов щёлочи и кислоты, мл.
Примеры решения задач.
1. На нейтрализацию 0,05 л раствора кислоты израсходовано 20 см3 0,5н раствора щелочи. Чему равна нормальность кислоты?
| Дано:
Vк-ты = 0,05 л = 50 мл
Vщелочи = 20 см3 =20 мл
Сн щелочи = 0,5н
Ск-ты -?
| Решение:
Сн(к-ты)· V(к-ты)= Cн (щелочи)· V(щелочи)
Сн(к-ты) = 
|
2. Сколько и какого вещества останется в избытке, если к 60см3 0,4н раствора серной кислоты прибавить 120см3 0,3н раствора гидроксида калия?
| Дано:
Vк-ты = 60мл = 0,06л
Ск-ты =0,4н
Vщелочи = 120мл = 0,120л
Сн щелочи = 0,3н
mр.в-ва -?
| Решение:

 ; ;

|
В растворе в избытке останется 0,012 эквивалента гидроксида калия, масса гидроксида калия равна:  
|
Решение задач по определению рН раствора, концентраций различного типа представлено в методическом пособии [2].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получите у лаборанта колбу с раствором щёлочи неизвестной концентрации. Пробы анализируемого раствора отмерьте мерным цилиндром по 10 мл в три конические колбы для титрований. В каждую из них добавьте 2-3 капли индикатора метилового оранжевого. Раствор приобретёт жёлтую окраску (метилоранж жёлтый в щелочной среде и оранжево-красный в кислой).

|
Рис.3 Установка для титрований:1 – штатив; 2 – бюретка; 3 – каучуковая трубка; 4 – стеклянный шарик (олива); 5 – стеклянный наконечник;
6 –коническая колба для титрования.
|
Приготовьте к работе установку для титрований (рис.3) Бюретку ополосните дистиллированной водой, а затем заполните раствором серной кислоты точно известной концентрации (молярная концентрация эквивалента H2SO4 указана на склянке) выше нулевого деления. Каучуковую трубку со стеклянным наконечником отогните вверх и, оттягивая резину от стеклянной оливы, закрывающей выход из бюретки, медленно выпускайте жидкость так, чтобы после заполнения наконечника в нём не осталось пузырьков воздуха. Избыток раствора кислоты выпустите из бюретки в подставленный стакан, при этом нижний мениск жидкости в бюретке должен установиться на нулевом делении.
Одну из колб раствора щёлочи подставьте под наконечник бюретки на лист белой бумаги и приступайте непосредственно к титрованию: одной рукой медленно подавайте кислоту из бюретки, а другой непрерывно перемешивайте раствор круговым движением колбы в горизонтальной плоскости. В конце титрования раствор кислоты из бюретки следует подавать по каплям до тех пор, пока от одной капли раствор примет неисчезающую оранжевую окраску.
Определите объём кислоты, израсходованный на титрование, с точностью до 0,01мл. Отсчёт делений бюретки производите по нижнему мениску, при этом глаз должен находиться на уровне мениска.
Повторите титрование ещё 2 раза, начиная каждый раз с нулевого деления бюретки. Результаты титрований запишите в таблицу 1.
Концентрацию раствора щёлочи вычислите по формуле:

Таблица 1
Результаты титрования раствора гидроксида натрия
| №
Определе-ния
| Объём пробы раствора щёлочи
V(NaOH), мл
| Объём раствора кислоты V(H2SO4), мл
| Молярная концентрация эквивалента щёлочи
Сн(NaOH), моль/л
| Среднее значение молярной концентрации эквивалента NaOH в анализируемом растворе, моль/л
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Проведите статистическую обработку результатов титрований по методике, описанной в приложении. Результаты статистической обработки экспериментальных данных сведите в таблицу 2.
Таблица 2
Результаты статистической обработки экспериментальных данных титрования раствора гидроксида натрия. Доверительная вероятность α = 0,95.
Запишите результат определения молярной концентрации эквивалента NaOH в анализируемом растворе в виде доверительного интервала.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Раствор гидроксида калия имеет рН =12. Концентрация основания в растворе при 100% диссоциации равна … моль/л.
1) 0,005; 2) 0,01; 3) 0,001; 4) 1·10-12 ; 5) 0,05.
2. На нейтрализацию 0,05 л раствора кислоты израсходовано 20 см3 0,5 н раствора щелочи. Чему равна нормальность кислоты?
1) 0,2 н; 2) 0,5 н; 3) 1,0 н; 4) 0,02 н; 5) 1,25 н.
3. Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н раствора серной кислоты прибавить 125 см3 0,2 н раствора гидроксида калия?
1) 0,0025 г щел
















 раств.(NH4NO3) = 26,5 кДж/моль,
раств.(NH4NO3) = 26,5 кДж/моль, 
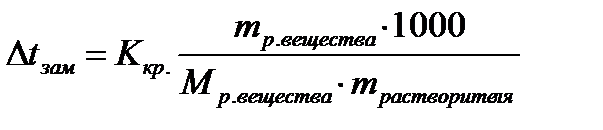





 - молярные концентрации эквивалента NaOH и H2SO4 в реагирующих растворах, моль/л;
- молярные концентрации эквивалента NaOH и H2SO4 в реагирующих растворах, моль/л; ) - объёмы реагирующих растворов щёлочи и кислоты, мл.
) - объёмы реагирующих растворов щёлочи и кислоты, мл.

 ;
;










