Некоторые металлы (Al, Zn, Sn, Ni) при коррозии образуют прочные и непроницаемые для окислителей пленки, имеющие хорошее сцепление с поверхностью металла. Такие пленки защищают металл от дальнейшей коррозии и называются защитными пленками.
Сплошность образующейся оксидной пленки можно определить по величине фактора Пиллинга-Бедворса (α), представляющего отношение мольных объемов оксида и металла в нем:
α = VМехОy /VMe
где:
VМехОy – мольный объем оксида, VМехОy = ММехОy /ρМехОy;
VMe – мольный объем металла, определяемый по формуле: VMe = х∙АМе /ρMe;
ρМехОy, ρMe – плотности оксида и металла соответственно.
ММехОy и АМе – молярная масса оксида и атомная масса металла, х – число атомов металла в молекуле оксида.
Очевидно, что при a > 1 образуется сплошная пленка, при a < 1 пленка не получается сплошной. Значения a приведены в таблице 1.
Сплошность пленки является необходимым, но не достаточным условием для проявления защитных свойств. При a >>1 может происходить вспучивание и отслаивание пленки в результате возрастания внутренних напряжений.
Приблизительно можно считать, что достаточно хорошими защитными свойствами будут обладать пленки при значении 1 < a < 2,5. Однако, помимо фактора Пиллинга-Бедворса, существенными являются физико-химические свойства пленки, она должна быть прочной, эластичной и иметь близкий с основным металлом коэффициент термического расширения.
Таблица 4. Значения фактора Пиллинга-Бедворса (a) для некоторых металлов
| Металл
| Оксид
| a
| Металл
| Оксид
| α
|
| Mn
| MgO
| 0,79
| Zn
| ZnO
| 1,58
|
| Pb
| PbO
| 1,15
| Zr
| ZrO2
| 1,60
|
| Cd
| CdO
| 1,27
| Be
| BeO
| 1,67
|
| Al
| Al2O3
| 1,31
| Cu
| Cu2O
| 1,67
|
| Sn
| SnO
| 1,33
| Cu
| CuO
| 1,74
|
| Ni
| NiO
| 1,52
| Ti
| Ti2O3
| 1,76
|
| Nb
| NbO
| 1,57
| Cr
| Cr2O3
| 2,02
|
| Nb
| Nb2O3
| 2,81
|
|
|
|
Скорость коррозии (Кинетика коррозии)
Важной характеристикой химической коррозии является ее скорость. Скорость коррозии определяют как скорость роста толщины оксидной пленки. На величину скорости влияют такие факторы, как сплошность оксидной пленки, зависящей от природы металла и окислителя, ее толщина и температура. Чем меньше толщина оксидной пленки, тем короче путь окислителя через пленку к металлу.
Для металлов с фактором Пиллинга-Бедворса (α) < 1 рост толщины оксидных пленок прямо пропорционально времени. В этом случае пленка не сплошная, и окислитель свободно подходит к поверхности металла. Например, так осуществляется коррозия щелочных металлов.
Металлы, дающие при коррозии сплошные пленки (α > 1) имеют параболическую зависимость роста толщины оксидных пленок от времени. В этом случае скорость процесса определяется диффузией кислорода через пленку оксида. По параболическому закону окисляются Fe (при температурах от 500 до 1000° С), Co, Ni, Сu (от 300 до 1000°С).
Логарифмическая зависимость наблюдается при уплотнении защитных пленок или наличии в пленке дефектов, которые тормозят диффузию. По такому закону окисляются алюминий, никель, цинк при температурах ниже 300 °С, железо – ниже 400 °С.

Рис. 4. Рост оксидных пленок: 1 – линейный; 2 – параболический; 3 – логарифмический.
Температурный фактор влияет на скорость образования оксидной пленки, так как с ростом температуры увеличивается скорость диффузии окислителя через пленку, и изменяются защитные свойства последней. Окисление некоторых металлов с изменением внешних условий проходит по разным законам.
Электрохимическая коррозия
При наличии в коррозионной среде конденсационной влаги коррозия идет по электрохимическому механизму. Этот вид коррозии самый распространенный.
Причиной протекания электрохимической коррозии является неоднородность металла из-за наличия в нем различных примесей. В результате на поверхности возникают участки, имеющие разный потенциал и образующие микрогальванические элементы. Роль анода в таком элементе выполняет металл, который окисляется, а роль катода – присутствующие в металле примеси других металлов или их соединений, а также загрязнения. На аноде осуществляется окисление металла по реакции Me – ne- → Men+, образующиеся электроны по металлу переходят на катодный участок, где связываются окислителем из окружающей среды. В качестве окислителя выступает кислород воздуха в присутствии влаги либо ионы водорода (Н+).
На катоде могут протекать следующие процессы:
Если окислителем является кислород:
О2 + 2Н2О + 4е- → 4ОН- в нейтральной и щелочной среде
О2 + 4Н+ + 4е- → 2Н2О в кислой среде
Такая коррозия называется коррозией с кислородной деполяризацией
Если в среде отсутствует кислород, то в качестве окислителя выступают ионы водорода (Н+) в кислой, нейтральной или щелочной средах:
2Н+ + 2е- → Н2 в кислой среде
2Н2О + 2е- → Н2 + 2ОН- в нейтральной и щелочной средах
Атмосферная коррозия углеродистой стали
Рассмотрим коррозию углеродистой стали с кислородной и водородной деполяризацией.
В углеродистой стали присутствует в качестве примеси карбид железа (Fe3C). Возникают микроконтакты Fe (анод) - Fe3C (катод).
На аноде: Fe – 2e- → Fe2+
На катоде: О2 + 2Н2О + 4е- →4ОН- (в присутствии кислорода воздуха в нейтральной среде)
Суммарное уравнение коррозии имеет вид:
Fe + О2 + 2Н2О →2Fe(ОН)2
Это уравнение первичного процесса. Образующийся гидроксид железа (II) на воздухе окисляется до Fe(OH)3 – вторичный процесс, в результате которого образуется бурая ржавчина.
2Fe(ОН)2 + 1/2О2 + Н2О →2Fe(ОН)3
Fe(OH)3 → FeOOH +H2O
ржавчина
Коррозионный процесс углеродистой стали в кислой среде в отсутствие кислорода выглядит так:
На аноде: Fe – 2e- → Fe2+
На катоде: 2Н+ + 2е- → Н2
Суммарное уравнение коррозии:
Fe + 2HCl → Н2 + FeCl2
Атмосферная коррозия на границе контакта двух разных металлов.
Рассмотрим коррозию луженого железа, т.е. железа, покрытого оловом (см. рис. 5).

Рис. 5. Схема коррозии луженого железа
При нарушении целостности покрытия создается макрогальванический элемент, в котором роль анода будет играть металл более активный, с меньшим значением потенциала, т.е. железо (φFe2+/Fe = -0,44 В), а катодом будет олово, имеющее больший потенциал (φSn2+/Sn = -0,136 В). Электродные процессы в этом случае описываются уравнениями:
На аноде: Fe – 2e- → Fe2+
На катоде: (Sn) О2 + 2Н2О + 4е- → 4ОН-
Fe2+ + 2ОН- → Fe(ОН)2
Термодинамика коррозии
Возможность коррозии конкретного металла данным окислителем определяется знаком энергии Гиббса для этого процесса (если ∆G < 0, то процесс идет). Для электрохимических процессов взаимосвязь изменения энергии Гиббса (∆G) с ЭДС (Е), описывается формулой:
∆G = -n∙F∙E
Из формулы следует, что коррозия металла конкретным окислителем возможна при положительном значении ЭДС:
Е = φокис-ля – φвосст-ля > 0
Для определения возможности протекания коррозии необходимо знать потенциалы катодных процессов в различных средах. Данные приведены в таблице 5.
Таблица 5. Значения потенциалов окислителей при кислородной и водородной деполяризации в различных средах
| | Катодная реакция
| рН
| j, В
|
| Водородная деполяризация
| 2Н+ + 2е– → Н2
|
|
|
| 2H2O + 2e– → H2 + 2OH–
|
| –0,413
|
| 2H2O + 2e– → H2 + 2OH–
|
| –0,826
|
| Кислородная деполяризация
| O2 + 4e– + 4H+ → 2H2O
|
| 1,23
|
| O2 + 4e– + 2H2O → 4OH–
|
| 0,82
|
| O2 + 4e– + 2H2O → 4OH–
|
| 0,40
|
Зависимость потенциала от рН можно изобразить графически в виде диаграммы Пурбе. (Бельгийский химик Марсель Пурбе предложил метод исследования равновесий в различных системах в виде диаграмм). На представленной диаграмме нанесены границы существования воды в средах с различным значением рН. Верхняя линия соответствует кислородной деполяризации, потенциал рассчитывается по формуле:
j = j° - 0,059рН = 1,23 - 0,059рН
Нижняя линия - водородная деполяризация, j = j° - 0,059рН. Сравнивая значения потенциалов с потенциалами металлов можно сделать вывод об устойчивости различных металлов по отношению к коррозионным процессам в разных условиях.
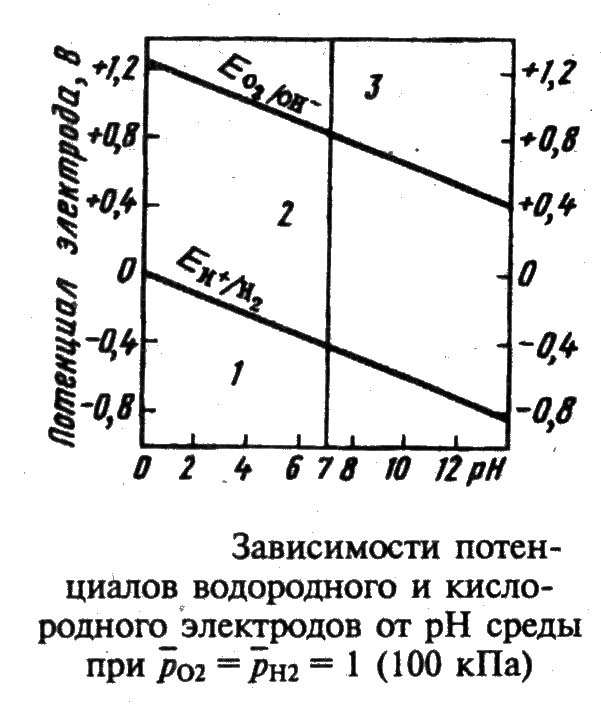
Например, свинец (j° Pb2+/Pb = - 0,126 В) будет подвергаться коррозии под действием кислорода (в кислой, нейтральной и щелочной средах), под действием кислот в отсутствие кислорода и будет устойчив к коррозии во воде и растворе щелочи.









