

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Интересное:
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Взгляните на секунду на небо, и в ваш глаз попадет поток света длиной около 300 тысяч километров. В ту же секунду на земле растения и фотосинтезирующие микроорганизмы используют поток солнечного света для получения около 16 тысяч тонн нового органического вещества в виде деревьев, травы, водорослей, ландышей, гигантских секвой и яблок. В этом разделе мы должны разобраться, как действительно происходит этот первый шаг в трансформации неживого вещества в практически всю биомассу нашей планеты; и в качестве примера трансформации мы возьмем превращение воздуха Новой Англии в яблоко на дереве Ньютона.
Чтобы увидеть этот процесс в действии, мы снова позаимствуем наноподлодку, которую использовали для исследования действия ферментов в предыдущей главе. Когда вы взойдете на борт, держите курс наверх, в листву дерева, на один из его растущих листьев. Лист продолжает расти, пока его дальние края не скроются за горизонтом, а его на первый взгляд гладкая поверхность превращается в неровную платформу, вымощенную зелеными кирпичиками с вкраплениями небольших круглых светлых блоков, в каждом из которых расположена дырка-пора. Зеленые кирпичи называются клетками эпидермиса, а круглые блоки — устьицами: их функция — пропускать воздух и воду (субстраты фотосинтеза) с поверхности листа в его внутреннюю среду. Вы ведете аппарат над ближайшим устьицем и, когда длина судна уменьшается до микрометра (миллионной части метра), снижаетесь, чтобы пройти сквозь пору и оказаться внутри зеленой и яркой среды листа.
Оказавшись внутри, вы решаете отдохнуть в уютном и тихом интерьере листа, выстланном рядами зеленых клеток, похожих на камни, и накрытом толстыми цилиндрическими канатами. Канаты — это вены листа, которые либо несут воду от корней к листу (сосуды ксилемы), либо переносят только что синтезированные сахара от листа ко всему растению (сосуды флоэмы). Если вы продолжите уменьшаться в размере, то увидите, что клетка, похожая на камень, расширяется во всех направлениях, пока не увеличится до размеров футбольного поля. В таком масштабе — ваш рост равен примерно десять нанометров, или одна стотысячная миллиметра, — вы можете увидеть, что ее поверхность покрыта дерном из сети волокнистых ячеек, совсем как толстый джутовый ковер. Этот волокнистый материал представляет собой клеточную стенку, своего рода экзоскелет. Ваша наноподлодка оснащена инструментами, которые вы используете, чтобы проложить путь через этот волокнистый ковер и увидеть восковой нижний слой, клеточную мембрану, последний водонепроницаемый барьер между клеткой и внешней средой. При более близком рассмотрении выясняется, что она не полностью гладкая, а пронизана отверстиями, заполненными водой. Эти мембранные каналы называются поринами и представляют собой водопроводную систему клетки, пропускающую внутрь питательные вещества и выводящую продукты распада. Чтобы проникнуть в клетку, вам придется только подождать возле одного из поринов, пока он не расширится настолько, чтобы вы могли проникнуть в водную среду клетки.
|
|
Уже через канал порина вы сможете сразу увидеть, что внутренняя среда клетки очень отличается от внешней. Вы не найдете великолепных колонн и широких залов. Интерьер заполнен и в некотором роде беспорядочен. Он выглядит как очень шумный деловой центр! Водянистая жидкость, заполняющая клетку, цитоплазма, плотная и вязкая; местами она больше похожа на гель, чем на жидкость. В геле подвешены тысячи неправильных шаровидных объектов, которые находятся в состоянии непрерывного внутреннего движения. Это белковые ферменты, похожие на те, что мы видели в предыдущей главе, ответственные за проведение метаболических процессов в клетке, разрушают питательные вещества и синтезируют биомолекулы, такие как углеводы, ДНК, белки и жиры. Многие их этих ферментов привязаны к сети кабелей (цитоскелету клетки), которая, совсем как горнолыжный подъемник, переносит многочисленные грузы в различные места клетки. Транспортная сеть исходит из нескольких узлов, где кабели прикрепляются к большим зеленым капсулам. Эти капсулы представляют собой хлоропласты клетки, в которых происходит центральный процесс фотосинтеза.
|
|
Вы ведете подлодку через вязкую цитоплазму. Вы продвигаетесь медленно, но в конце концов подходите к ближайшему хлоропласту. Он лежит под вами, как огромный зеленый воздушный шар. Он, как внутренняя клетка, окружен прозрачной мембраной, через которую видны большие стопки зеленых монетоподобных предметов. Это тилакоиды, заполненные молекулами хлорофилла, пигмента, придающего растениям зеленый цвет. Тилакоиды — это механизмы фотосинтеза, которые при заправке фотонами света могут скреплять атомы углерода (полученные из углекислого газа воздуха) вместе с образованием сахаров, которые пойдут в наше яблоко. Чтобы лучше рассмотреть первый этап фотосинтеза, вы направляете свой аппарат в одну из пор мембраны хлоропласта, к верхней зеленой монете стопки тилакоидов. Достигнув своей цели, вы выключаете двигатель подлодки, позволяя ей дрейфовать над этой электростанцией фотосинтетических процессов.
Перед вами лежит только один из триллионов фотосинтетических механизмов, которые производят мировую биомассу. С вашей выгодной точки вы можете увидеть, что, как мы узнали при изучении ферментных механизмов в предыдущей главе, несмотря на множество происходящих вокруг вас турбулентных столкновений молекул, подобно бильярдным шарам, существует определенная упорядоченность. Поверхность мембраны тилакоида усыпана скалистыми зелеными островками, покрытыми древоподобными структурами с похожими на антенны пятиугольными пластинками на концах. Эти пластинки-антенны представляют собой светопоглощающие молекулы, хромофоры, самым известным примером которых является хлорофилл. Именно здесь происходит первый ключевой этап фотосинтеза: захват света. Вероятно, вторая по значимости молекула на нашей планете (после ДНК) хлорофилл заслуживает более подробного рассмотрения (рис. 4.5).
|
|

Рис. 4.5. Молекула хлорофилла
Это двухмерная структура, состоящая из пятиугольных элементов, включающих в основном атомы углерода (серые сферы) и азота (N), с атомом магния (M) в центре, с длинным хвостом из атомов углерода, кислорода (O) и водорода (белые атомы). Внешний электрон магния слабо связан с атомом и может выбиваться в окружающий углеродный каркас при поглощении фотона солнечного света. В результате вместо него остается пустое место и атом получает положительный заряд. Это пустое место, или электронную дырку, можно рассматривать с абстрактной точки зрения как «вещь в себе»: положительно заряженную дырку. Суть в том, что мы расцениваем оставшийся атом магния как нейтральный, пока посредством поглощения фотона создаем систему, состоящую из выбитого отрицательного электрона и оставшейся положительной дырки. Эта бинарная система называется экситоном (рис. 4.6).

Рис. 4.6. Экситон состоит из электрона, выбитого со своей орбиты, и атома с оставшейся дыркой
Ее можно считать крошечной батареей с положительным и отрицательным полюсами, способной хранить энергию для последующего использования.
Экситоны нестабильны. Электрон и его дыра ощущают воздействие электростатической силы, притягивающей их друг к другу. При их воссоединении солнечная энергия изначального фотона теряется в виде остаточного тепла. Таким образом, если растению необходимо использовать поглощенную солнечную энергию, оно должно очень быстро перенести экситон в производственную часть молекулы, известную как реакционный центр, где происходит процесс под названием «разделение зарядов». Фактически он включает полный отрыв энергетического электрона от атома и перенос его к соседней молекуле, подобно действию ферментов, которое мы наблюдали в прошлой главе. В результате этого процесса образуется более стабильная, чем экситон, химическая батарея (под названием НАДФН), которая используется во всех важных химических реакциях фотосинтеза.
Но реакционные центры обычно располагаются достаточно далеко с молекулярной точки зрения (на расстоянии нанометров) от возбужденных молекул хлорофилла, так что энергия должна переходить от одной молекулы-антенны к другой по хлорофилльному лесу, пока не достигнет реакционного центра. Это возможно благодаря плотно упакованной структуре хлорофилла. Молекулы по соседству с той, которая захватила фотон, также приходят в возбуждение, эффективно принимая энергию от первичного возбужденного электрона и затем перенося ее к собственному электрону атома магния.
|
|
Проблема заключается в том, каким путем должна происходить передача энергии. Если она выберет неправильное направление, в случайном порядке перескакивая от одной молекулы к другой в хлорофилльном лесу, энергия будет утрачена и не достигнет реакционного центра. Какой путь она должна выбрать? Путь к цели не должен занимать много времени, чтобы не утратить энергию экситона.
До недавних пор считалось, что перенос энергии от одной молекулы хлорофилла к другой носит случайный характер, в сущности принимая характер стратегии последней надежды, известной как метод случайного блуждания. Иногда это называют «пьяным блужданием», потому что оно напоминает маршрут пьяницы, вышедшего из бара, который блуждает в поисках пути, пока случайно не находит свой дом. Но случайное блуждание — не очень эффективный способ добраться куда-нибудь: если дом пьяного далеко, он может проснуться следующим утром в кустах в другой части города. Объект, участвующий в случайных блужданиях, имеет тенденцию удаляться от точки старта на расстояние, пропорциональное квадратному корню из времени. Если за одну минуту пьяный человек продвинется на один метр, то через четыре минуты он уйдет на два метра, а через девять минут — только на три метра. С таким вялым прогрессом неудивительно, что животные и микробы редко используют случайное блуждание, чтобы найти пищу или добычу, прибегая к этой стратегии только при отсутствии другого выхода. Поместите муравья в незнакомую местность, и, как только он уловит запах, он бросит случайное блуждание и будет следовать за своим носом.
Считалось, что, не имея ни носа, ни навыков навигации, энергия экситона продвигается по хлорофилльному лесу методом пьяницы. Но такая картина не имела особого смысла, так как известно, что первый этап фотосинтеза чрезвычайно эффективен. Фактически перенос энергии захваченного фотона от молекулы-антенны хлорофилла к реакционному центру знаменит свой эффективностью, большей, чем у любой естественной или искусственной реакции: почти 100 %. При оптимальных условиях почти каждая частица энергии, поглощенная молекулой хлорофилла, достигает реакционного центра. Если бы выбранный путь был блуждающим, то почти все они, по крайней мере большинство из них, должны были быть утеряны. Почему эта энергия фотосинтеза находит свой путь к конечной цели намного успешнее, чем пьяница, муравей или наша наиболее энергоэффективная технология? Это остается одной из величайших загадок биологии.
|
|
Квантовое биение
Старшим автором научной работы[52], блеснувшим в газетной статье, заставившей журнальный клуб МТИ смеяться от всей квантовой души, был американец Грэм Флеминг. Он родился в Барроу на севере Англии в 1949 году. В настоящее время он возглавляет группу Калифорнийского университета в Беркли, признанную одной из лидирующих исследовательских групп в своей области в мире. Группа использует мощную технологию под впечатляющим названием «электронная спектроскопия с двухмерным преобразованием Фурье» (2D-FTES). 2D-FTES может исследовать внутреннюю структуру и динамику мельчайших молекулярных систем, направляя на них высокофокусные кратковременные лазерные импульсы. Большую часть своей работы группа посвятила изучению не растений, а фотосинтетического комплекса под названием «белок Фенна-Мэтьюз-Ольсон» (FMO), который производится фотосинтезирующими микроорганизмами — зелеными серобактериями, живущими в глубинах богатых серой водоемов, таких как Черное море. Чтобы исследовать образец хлорофилла, ученые направили три импульса лазерного света на фотосинтетические комплексы. Эти импульсы хранят свою энергию в виде очень быстрых и точно рассчитанных вспышек и генерируют световой сигнал от образца, который регистрируется датчиками.
Грег Энджел, главный автор статьи, провел целую ночь, сопоставляя данные, полученные от сигналов длительностью от 50 до 600 фемтосекунд[53], чтобы получить итоговый результат. Он получил возрастающий и уменьшающийся сигнал, который колебался в течение как минимум 600 фемтосекунд (рис. 4.7).

Рис. 4.7. Квантовые биения, наблюдавшиеся Грэмом Флемингом и его коллегами в опыте 2007 года. С научной точки зрения важна не неправильная форма колебаний, а сам факт наличия колебаний
Колебания были похожи на картину интерференции светлых и темных полос в опыте с двумя щелями, или квантовый эквивалент пульсирующих звуковых биений, слышных во время настройки музыкального инструмента. Подобное квантовое биение показало, что экситон не следовал одному пути через лабиринт хлорофилла, а использовал несколько путей одновременно (рис. 4.8). Эти альтернативные пути несколько напоминают ноты почти настроенной гитары: они генерируют биения, когда их длина почти одинакова.
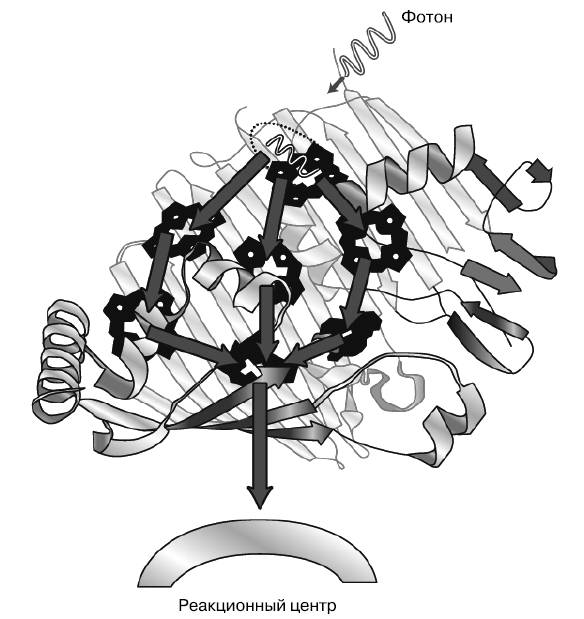
Рис. 4.8. Экситон, продвигающийся по комплексу FMO, выбирая несколько альтернативных путей одновременно
Но не стоит забывать, что такая квантовая когерентность очень хрупка и чрезвычайно трудно сохраняется. Возможно ли, что микроорганизм или растение способны прилагать героические усилия ярчайших и лучших исследователей квантовых компьютеров МТИ, чтобы отсрочить декогерентность? В своей статье Флеминг сделал действительно смелое заявление, и это было «квантовое жульничество», как это назвал Сет Ллойд, которое возмутило журнальный клуб МТИ. Группа Беркли предполагала, что комплекс FMO действует как квантовый компьютер, чтобы найти кратчайший путь к реакционному центру, бросая вызов проблеме оптимизации, подобно знаменитой задаче путешествующих моряков в математике, которую с маршрутами, имеющими несколько назначений, может решить только очень мощный компьютер[54].
Несмотря на скептицизм, журнальный клуб поставил Сету Ллойду задачу исследования заявления. Ко всеобщему удивлению МТИ, в ходе своего научного расследования Ллойд пришел к заключению, что заявление группы из Калифорнийского университета имеет основание. Биения, которые обнаружила группа Флеминга в комплексе FMO, были действительно записью квантовой когерентности, и Ллойд пришел к заключению, что молекулы хлорофилла руководствуются новейшей стратегией поиска, известной как квантовое блуждание.
Преимущества квантового блуждания над классическим случайным блужданием можно оценить, вернувшись к нашему медлительному пьянице и представив, что в баре, который он покинул, произошла утечка и из его дверей вытекает вода. В отличие от нашего нетрезвого героя, который должен выбрать один путь, волны воды, вытекающие из бара, могут двигаться во всех возможных направлениях. Наш пьяница вскоре обнаружит, что его обгоняют, так как водные потоки движутся по улице просто пропорционально времени, а не его квадратному корню. Итак, если за одну секунду они продвинутся на один метр, то через две секунды они протекут два метра, а через три секунды — три метра и т. д. Кроме того, как атом в суперпозиции из опыта с двумя щелями, вода путешествует во всех возможных направлениях одновременно, и какая-то часть волны определенно достигнет дома пьяного задолго до нетрезвого путешественника.
Статья Флеминга вызвала свою волну удивления и изумления, которая распространилась далеко за пределы журнального клуба МТИ. Но некоторые комментаторы вскоре обратили внимание, что опыты были проведены на изолированных комплексах FMO, охлажденных до 77 К (–196 °C): это намного холоднее, чем любая температура, пригодная для фотосинтеза или даже для жизни растений, но достаточно холодно, чтобы отложить эту досадную декогерентность. Насколько значимы были эти охлажденные бактерии для всего, что происходит в жарком и беспорядочном внутреннем мире растительных клеток?
Вскоре это станет ясно, однако квантовая когерентность не ограничивается охлажденными комплексами FMO. В 2009 году Йен Мерсер в Университетском колледже Дублина обнаружил квантовое биение в другой бактериальной системе фотосинтеза (или, для краткости, фотосистеме) под названием «светособирающий комплекс II» (LHC2), который очень похож на фотосистему растений, но при нормальных температурах, при которых растения и микробы обычно осуществляют фотосинтез[55]. Затем, в 2010 году, Грег Шоулз в Университете Онтарио продемонстрировал квантовое биение фотосистемы группы водорослей (которые, в отличие от высших растений, не имеют корней, стеблей и листьев) под названием «криптофиты». Эти водоросли чрезвычайно изобильны, до такой степени, что они связывают столько атмосферного углерода (из атмосферного углекислого газа), как и высшие растения[56]. Примерно в то же время Грег Энджел продемонстрировал квантовое биение в том же комплексе FMO, который изучали в лаборатории Грэма Флеминга, но теперь при намного более высоких, совместимых с жизнью, температурах[57]. В таком случае вы можете решить, что этот замечательный феномен ограничен только бактериями и водорослями, однако Тесса Калхоун и ее коллеги из лаборатории Флеминга в Беркли недавно обнаружили квантовое биение в другой системе LHC2, на этот раз в шпинате[58]. LHC2 присутствует во всех высших растениях и содержит 50 % всего хлорофилла на планете.
Прежде чем двигаться дальше, мы кратко опишем, как используется полученная из солнечного света энергия экситона, как описывал Фейнман, чтобы оторвать «этот кислород от углерода… оставляя углерод и воду, чтобы создать субстанцию дерева» — или яблоко.
После того как достаточное количество энергии достигает реакционного центра, пара молекул хлорофилла (под названием Р680) испускает электроны. Мы узнаем немного больше о том, что происходит в реакционном центре, в главе 10, и это потрясающее место, в котором может происходить другой новейший квантовый процесс. Источником этих электронов является вода (которая, как мы помним, выступает одним из ингредиентов в фейнмановском описании фотосинтеза). Как мы выяснили в предыдущей главе, захват электронов из любого вещества называется окислением и именно этот процесс имеет место во время горения. Когда дерево горит на воздухе, например, атомы кислорода отрывают электроны от атомов углерода. Электроны на внешней орбите углерода очень слабо удерживаются, поэтому углерод горит очень легко. Однако в воде они удерживаются очень крепко: системы фотосинтеза уникальны тем, что это единственное место в мире, где вода «сгорает» с выходом электронов[59].
Пока все идет хорошо: сейчас мы имеем источник свободных электронов благодаря энергии, доставленной экситонами в хлорофилл. Далее растение должно послать эти электроны туда, где они будут использованы в работе. Сначала они захватываются описанным переносчиком электронов, НАДФН. Мы уже встречали похожую молекулу, НАДН, в предыдущей главе, где она участвовала в переносе электронов, захваченных от питательных веществ, таких как сахара, к дыхательной цепи ферментов в энергетических клеточных органеллах, митохондриях. Если помните, захваченные электроны, доставленные к митохондриям переносчиком НАДН, затем идут по дыхательной цепи ферментов как своего рода электрический ток, который используется для переноса протонов через мембрану, а обратный поток этих протонов используется для получения клеточного энергоносителя, АТФ. Очень похожий процесс используется для получения АТФ в хлоропластах растений. НАДФН захватывает электрон и переносит его к цепи ферментов, которые подобным образом выносят протоны через мембрану хлоропласта. Обратный поток этих протонов используется для получения молекул АТФ, которые впоследствии могут обеспечивать энергией многие энергозатратные процессы в растительной клетке.
Но действительный процесс фиксации углерода, захват атомов углерода из углекислого газа воздуха и их использование для получения энергоемких органических молекул, таких как сахара, происходит вне тилакоида, но все еще внутри хлоропласта. Этот процесс проходит с участием большой молекулы фермента под названием RuBisCO, вероятно наиболее распространенного белка в мире, так как он предназначен для выполнения величайшей работы: создание практически всей мировой биомассы. Этот фермент связывает атом углерода, оторванный от углекислого газа, в молекулу простого пятиуглеродного сахара под названием рибулозо-1,5-бифосфат для получения шестиуглеродного сахара. Чтобы достичь такого мастерства, необходимо присутствие двух ингредиентов: электронов (доставляемых НАДФН) и источника энергии (АТФ). Оба ингредиента являются продуктами светозависимых процессов фотосинтеза.
Шестиуглеродный сахар, полученный с помощью RuBisCO, немедленно распадается на два трехуглеродных сахара, которые затем связываются между собой множеством различных способов для построения всех биомолекул, лежащих в основе яблони, включая яблоки. Неживые воздух и вода Новой Англии с помощью света и доли квантовой механики становятся живой тканью дерева Новой Англии.
Сравнивая фотосинтез у растений и дыхание (сжигание пищи), которое происходит в наших клетках, описанное в предыдущей главе, вы можете увидеть, что под кожей растения и животные не так различны. Ключевое отличие лежит там, где мы и они храним фундаментальные строительные блоки жизни. И тем и другим необходим углерод, но растения получают его из воздуха, в то время как мы берем его из органических источников, таких как растения. И тем и другим для построения молекул необходимы электроны: мы сжигаем органические молекулы для захвата их электронов, в то время как растения используют свет, чтобы сжигать воду и захватывать ее электроны. И тем и другим необходима энергия: мы получаем ее из высокоэнергетических электронов, которые получаем из нашей пищи, пропуская их по дыхательной цепи; растения захватывают энергию фотонов солнечного света. Каждый из этих процессов включает движение фундаментальных частиц, которые руководствуются квантовыми правилами. Кажется, что жизнь укрощает квантовые процессы, чтобы обеспечить и свое продолжение, и продолжение самих квантовых процессов.
Открытие квантовой когерентности в теплых, влажных, турбулентных системах, таких как растения и микробы, повергло квантовых физиков в глубокий шок. Значительная часть исследований теперь сфокусирована на выяснении, как живые системы защищают и используют свои хрупкие состояния квантовой когерентности. Мы вернемся к этой загадке в главе 10, где исследуем некоторые удивительные возможные ответы, которые могут даже помочь физикам, таким как квантовые теоретики МТИ, построить практические квантовые компьютеры, которые смогут работать на вашем рабочем столе, не нуждаясь в глубокой заморозке. Вероятно, исследование также вдохновит новое поколение искусственных фотосинтетических технологий. Современные солнечные батареи мало основаны на принципах фотосинтеза и уже конкурируют с солнечными панелями на рынке чистой энергии, но их эффективность ограничена потерями при переносе энергии (в лучшем случае 70 %-ная эффективность по сравнению с почти 100 %-ной эффективностью этапа захвата энергии фотона в процессе фотосинтеза). Перенос биологической квантовой когерентности на солнечные батареи может потенциально увеличить эффективность солнечной энергии и, таким образом, сделать мир более чистым.
Давайте кратко рассмотрим значимость того, что мы добавили к нашему пониманию особенностей жизни. Рассмотрим еще раз те квантовые биения, которые Грег Энджел впервые увидел в первых данных о комплексе FMO и которые показали, что частицы движутся в живых клетках как волны. Существует соблазн думать об этом как о лабораторных феноменах, не имеющих значимости вне биохимического эксперимента. Но последующие исследования показали, что они на самом деле существуют в природе, в листьях, водорослях и микробах и что они играют, вероятно, ключевую роль в построении нашей биосферы.
Тем не менее квантовый мир остается незнакомым нам и часто заявляет, что эта неизвестность является признаком фундаментального раскола между миром, который мы видим вокруг нас, и его квантовым основанием. Но в реальности существует только один свод законов, указывающий путь, по которому работает мир: квантовые законы[60]. Знакомые законы статистики и законы Ньютона являются в итоге квантовыми законами, пропущенными через линзу декогерентности, которая отсеивает таинственность (все, что нам кажется странным в квантовых феноменах). Копните немного глубже, и вы всегда увидите квантовую механику, скрывающуюся в основе знакомой нам реальности.
Более того, определенные макроскопические объекты чувствительны к квантовым феноменам и большинство из них — живые. В прошлой главе мы открыли, как квантовое тунеллирование внутрь ферментов обусловливает отличие целой клетки. В этой главе мы выяснили, как первичный захват фотона, лежащий в основе образования большей части биомассы на планете, зависит от хрупкой квантовой когерентности, которая может поддерживаться в течение биологически значимого времени в теплой, но высокоорганизованной внутренней среде листа или микроорганизма. И опять мы видим принцип Шредингера «порядок из порядка», ответственный за явления квантового захвата, и то, что Джордан назвал амплификацией квантовых феноменов в макроскопическом мире. Кажется, что жизнь связывает квантовый и классический миры, расположенные на квантовом краю.
Далее мы обратим внимание на другой важнейший для нашей биосферы процесс. Яблоня Ньютона никогда не смогла бы произвести яблоки, если бы ее цветы сначала не опылили птицы и насекомые, в частности пчелы. Но пчелы должны найти цветок яблони; и они находят, используя другую возможность, которая, по мнению многих, основана на квантовой механике, — чувство обоняния.
В поисках дома Немо
Этот нос, например, о котором еще ни один философ не говорил с уважением и благодарностью, является между тем даже самым деликатным инструментом из находящихся в нашем распоряжении: он может еще констатировать минимальные разности движения, которых не констатирует даже спектроскоп.
Фридрих Ницше. Сумерки идолов. 1889
Кажется, они передают нам некое сообщение от материальной действительности.
Гастон Башляр. Становление научного духа: заметки по психоанализу объективного познания. 1938
Среди щупалец опасной морской актинии, обитающей на коралловом рифе недалеко от филиппинского острова Верде, спрятались две маленькие рыбки. Это полосатые оранжево-белые рыбы-клоуны, или, точнее, амфиприоны, а еще точнее — Amphiprion ocellaris. Жизнь одной из них — самки — прошла гораздо интереснее, чем жизнь большинства позвоночных, поскольку эта рыбка не всегда была самкой. Как и все амфиприоны, рыбка сначала была самцом, который подчинялся единственной самке в стае рыбок, населявших эту актинию. В стае амфиприонов устанавливается жесткая социальная структура, и этот самец соперничал с другими самцами, пока наконец не стал доминирующим и не завоевал право спариваться с единственной самкой в стае. Однажды самку съела проплывающая мимо мурена, и после этого у доминирующего самца стали развиваться яичники, которые несколько лет не функционировали, а семенники, наоборот, перестали функционировать. Так самец-амфиприон превратился в королеву-самку, готовую к спариванию со следующим самцом в иерархии стаи.
Амфиприоны — типичные обитатели коралловых рифов Индийского и западной части Тихого океанов. Они питаются растениями, водорослями, планктоном, а также моллюсками и мелкими ракообразными. Из-за небольшого размера, яркого окраса и отсутствия шипов, острых плавников, усиков и зубцов сами амфиприоны становятся легкой добычей мурен, акул и других хищников, снующих по рифам в поисках пищи. Почуяв угрозу, они спасаются тем, что стремительно скрываются в щупальцах своей актинии. От ядовитого жала актинии рыбки защищены плотным слоем слизи, покрывающей их чешуйки. В свою очередь, актиния также пользуется защитой своих разноцветных жильцов, которые отпугивают нежеланных гостей, например рыб-бабочек, питающихся коралловыми полипами.
Эти особенности образа жизни рыб-клоунов стали широко известны после выхода на экраны анимационного фильма «В поисках Немо»[61]. По сюжету рыба-клоун по имени Марлин отправляется на поиски своего сына Немо, который поневоле оказался далеко от дома — Большого Барьерного рифа — и добрался до самого Сиднея. Но еще более сложным испытанием для амфиприонов оказываются поиски дороги домой.
Каждая актиния может быть домом для целой колонии амфиприонов, в которой обязательно есть доминирующая пара — самец и самка. Кроме того, в колонии несколько молодых самцов конкурируют между собой за право стать партнером самки в будущем. Протандрический гермафродитизм амфиприона (необычная способность доминирующего самца менять пол после гибели самки) является, скорее всего, формой адаптации к жизни на опасном рифе. Благодаря этой способности колония предохраняет себя от вымирания после гибели единственной самки с репродуктивной функцией. Более того, рыбам даже не нужно покидать родную актинию в поисках нового дома. Одна и та же колония амфиприонов обычно живет на актинии на протяжении многих лет, однако потомство все же иногда покидает безопасный дом и рано или поздно сталкивается с испытанием — поиском обратного пути.
Полнолуние является своеобразным сигналом для начала нереста большинства коралловых рыб[62]. Когда луна над океаном начинает идти на убыль, самка рыбы-клоуна мечет икру, которую впоследствии оплодотворяет доминирующий самец. На этом работа самки окончена, а вот самец занимается тем, что охраняет икринки, отгоняя от них хищных рыб, обитающих на рифе. Отцовская забота об икринках длится примерно неделю. После на свет появляются сотни головастиков. Течения уносят их во взрослую рыбью жизнь.
Головастики амфиприонов достигают в длину лишь нескольких миллиметров. Кроме того, они почти полностью прозрачны. В течение недели или около того они плавают в океане, питаясь зоопланктоном. Как знают опытные дайверы, не раз погружавшиеся на глубину в районе коралловых рифов, течение очень быстро относит вас от того места, где вы погрузились под воду; так головастиков амфиприонов относит от родного рифа на многие километры. Большинство из них становится жертвами хищных рыб, но некоторые выживают. Еще через неделю счастливчики, оставшиеся в живых, опускаются на дно, где в течение дня превращаются (как головастик лягушки, которого мы описали в главе 3) в мальков — маленькие копии взрослых рыб. Без защиты ядовитой актинии ярко окрашенные мальки становятся легкой добычей хищных рыб, охотящихся в придонных водах. Чтобы выжить, мальку амфиприона необходимо очень быстро найти коралловый риф, а следовательно, и защиту.
Всегда считалось, что головастиков коралловых рыбок уносит океанским течением и что им остается лишь полагаться на счастливый случай быть вынесенными этим течением к подходящему для жизни кораллу. Однако здесь было что-то нелогичное: всегда было известно, что головастики достаточно сильные и умеют отлично плавать, но ведь нет смысла плыть неизвестно куда. В 2006 году Габриэле Герлах, исследовательница из знаменитой Лаборатории биологии моря в Вудс-Холе, Массачусетс, осуществила геномную идентификацию рыб, населяющих рифы, находящиеся на расстоянии от 3 до 23 километров. Исследование проводилось на одном из участков Большого Барьерного рифа недалеко от берегов Австралии. Выяснилось, что рыбы, населяющие отдельный риф, находятся друг с другом в более близком родстве, чем с рыбами, населяющими отдаленные рифы. Поскольку всех головастиков от родного рифа течение относит на многие километры, результат исследования можно объяснить лишь тем, что большинство взрослых рыб впоследствии возвращаются на тот риф, где они появились на свет. У мальков коралловых рыб, должно быть, есть какая-то метка, указывающая на тот участок рифа, где они родились.
Так как же головастики или мальки амфиприонов, которых течение отнесло так далеко от дома, определяют, в каком направлении им плыть? Дно океана не дает никаких видимых подсказок. На дне мало ориентиров, оно выглядит одинаково во всех направлениях: песчаная пустыня, усеянная большими и маленькими камнями, среди которых то тут, то там снуют разные членистоногие. Вряд ли далекий коралловый риф посылает некий звуковой сигнал, который распространяется в воде на несколько километров. Течения сами по себе являются проблемой, ведь их направления постоянно меняются в зависимости от глубины и иногда сложно определить, движется массив воды или находится в покое. Нет никаких доказательств наличия у амфиприонов механизма наподобие магнитного компаса, который помогает малиновкам ориентироваться в пространстве во время миграций. Так как же мальки коралловых рыбок находят дорогу домой?
У рыб хорошо развито обоняние. Известно, что акулы, у которых за обоняние отвечают две трети мозга, могут почувствовать запах одной капли крови на расстоянии более чем километр. Возможно, коралловые рыбки «вынюхивают» путь к дому? Чтобы проверить это предположение, в 2007 году Габриэле Герлах провела «двухканальный эксперимент на выбор водотока по запаху». Мальки коралловых рыб были поставлены перед выбором — поплыть по течению по одному из двух водотоков. Вода первого была собрана на том рифе, где рыбки появились на свет, а вода второго была перемещена с отдаленного рифа, чужого для мальков. Исследовательница наблюдала, какой водоток выберут мальки — с родной или чужой водой.
Мальки неизменно плыли по водотоку, сформированному из воды родного рифа. Они сумели точно определить, где вода с того рифа, где они появились на свет, а где — вода с чужого рифа. Предположительно это связано с тем, что для мальков эти воды пахнут по-разному. Майкл Арведланд, ученый из Университета имени Джеймса Кука (Квинсленд, Австралия), провел похожий эксперимент, в ходе которого подтвердилось, что амфиприоны способны по запаху отличать вид их родной актинии от всех остальных видов, населенных иными колониями. Более того, Даниэлла Диксон из того же Университета имени Джеймса Кука доказала, что амфиприоны могут отличить воду, взятую из среды их обитания — с рифов, раскинувшихся недалеко от зеленых островов, — от воды, взятой с рифов, находящихся далеко от берега. Кажется, что Немо, как и остальные рыбы-клоуны, живущие в коралловых рифах, и правда мог бы найти дорогу домой по запаху.
О способности животных прокладывать себе путь, полагаясь на обоняние, известно давно. Каждый год по всему миру миллионы особей лосося собираются в большие стаи у побережья океана в районе устья большой реки и плывут к местам нереста, преодолевая течение, пороги, водопады и песчаные отмели. Как и в случае с амфиприонами, ученые долгое время полагали, что лососи выбирают подходящую реку для нереста, полагаясь на случай. Однако в 1939 году канадец Уилберт Клеменс пометил около 470 тысяч молодых особей лосося, пойманных в одном из притоков реки Фрейзер. Спустя несколько лет он поймал в том же притоке почти 11 тысяч помеченных рыб, вернувшихся в родные воды. В других притоках реки Фрейзер не было поймано ни одной помеченной рыбы. Ни одна рыба не сбилась с пути, возвращаясь из океана в родную реку. Многие годы способность рыб ориентироваться в океане и речных потоках оставалась необъяснимой. Профессор Артур Х
|
|
|

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!