Лабораторная работа №1. «Правила по технике безопасности при работе в химической лаборатории. Лабораторное оборудование.
Химическая посуда».
Вопросы для самоподготовки:
1. Количество вещества.
2. Количество вещества эквивалента.
3. Закон эквивалентов.
4. Способы выражения концентраций растворов.
На первое занятие принести:
Tетрадь для лабораторных работ – 18 л.
Тетрадь для решения задач – 48 л.
Калькулятор (вычисляющий логарифмы).
Простой карандаш.
Химический трафарет или линейку.
Ластик.
Tетради для контрольных работ и для зачета (18 л) – 2 шт.
На занятия приходить в сменной обуви, белом халате и шапочке.
I. Количество вещества
1) Моль — количество вещества, содержащее столько реальных или условных частиц, сколько атомов содержится в 0,012 кг углерода – 12. При использовании моля как единицы количества вещества следует указывать, какие именно реальные или условные частицы имеются в виду. Обозначают: n(Х). Например, n(NaOH) = 3 моль; n(Ва2+) = 2 моль.
2) Молярная масса М(Х) — масса 1 моль вещества. Например: молярная масса серной кислоты М(Н2SО4) = 98 г/моль; молярная масса иона алюминия М(Al3+) = 27 г/моль.
3) Количество вещества: n(X) = 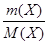
4) Число Авогадро. 1 моль любого вещества содержит одинаковое число частиц (реальных или условных). Na = 6,02 ×1023 моль-1.
II. Количество вещества эквивалента
1) Эквивалент – это реальная или условная частица вещества Х, которая в кислотно-основной реакции эквивалентна одному иону водорода или в окислительно-восстановительной реакции эквивалентна одному электрону.
2) Фактор эквивалентности – это число обозначающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции. Число, стоящее в знаменателе дроби – число эквивалентности – z.
fэкв(X) = 
Величина z – всегда целое положительное число (1, 2, 3 и т. д.).
Фактор эквивалентности зависит от:
1) природы веществ;
2) стехиометрии реакций, в которых они участвуют – значение фактора эквивалентности может изменятся.
а) Определение фактора эквивалентности для различных классов соединений в обменных реакциях
Кислоты
fэкв(кислоты) = 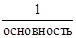
для НСl, z = 1, фактор эквивалентности — 1;
для H2SO4, z = 2, фактор эквивалентности — 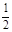 ;
;
для Н3РО4 z = 3, фактор эквивалентности — 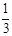 ;
;
а) H2SO4 + 2NaOH = Na2SO4 + 2H2O
В этой реакции в молекуле серной кислоты замещается два атома водорода, следовательно, z = 2, fэкв(H2SO4) =  ;
;
б) H2SO4 + NaOH = NaHSO4 + H2O
В этом случае в молекуле серной кислоты замещается один атом водорода, z = 1, fэкв(H2SO4) = 1;
Для фосфорной кислоты, в зависимости от реакции, значения факторов эквивалентности могут быть: 1,  ,
,  .
.
Основания
fэкв(основания) = 
для КОН z = 1, фактор эквивалентности— 1;
для Сa(ОН)2 z = 2, фактор эквивалентности—  ;
;
Фактор эквивалентности многокислотных оснований может изменяться в зависимости от количества замещенных групп (также как и у кислот). Например, для гидроксида кальция возможны значения фактора эквивалентности— 1, 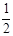 , для гидроксида алюминия — 1,
, для гидроксида алюминия — 1, 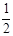 ,
, 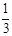 .
.
Соли
fэкв(соли) = 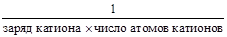
для KCl фактор эквивалентности — 1;
для Cr(NO3)3 фактор эквивалентности — 
для Al2(SO4)3 фактор эквивалентности — 
Значение факторов эквивалентности для солей зависит также и от реакции, аналогично зависимости его для кислот и оснований.
б) Определение фактора эквивалентности веществ в ОВР.
fэкв(окислителя или восстновителя) = 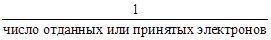
а) 2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + К2SO4 + 3H2O
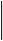 2 Mn+7 + 5e = Mn+2
2 Mn+7 + 5e = Mn+2
5 N+3 - 2e = N+5
fэкв(КMnO4) = 1/5; fэкв(NaNO2) = 1/2.
б) 2KMnO4 + NaNO2 + 2KOH= K2MnO4 + NaNO3 + 3H2O
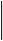 2 Mn+7 + 1e = Mn+6
2 Mn+7 + 1e = Mn+6
1 N+3 - 2e = N+5
fэкв(КMnO4) = 1; fэкв(NaNO2) = 1/2.
3) Молярная масса эквивалента вещества Х – масса одного моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества Х:
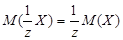
а) H2SO4 + 2NaOH = Na2SO4 + 2H2O
fэкв(NaOH) = 1; M(NaOH) = 40 г/моль; M(1 NaOH) = 40 г/моль;
fэкв(H2SO4) = 1/2; М(H2SO4) = 98 г/моль; М(1/2 H2SO4) = 49 г/моль.
б) H2SO4 + NaOH = NaHSO4 + H2O
fэкв(NaOH) = 1; M(NaOH) = 40 г/моль; M(1NaOH) = 40 г/моль;
fэкв(H2SO4) = 1; М(H2SO4) = 98 г/моль; М(1H2SO4) = 98 г/моль.
4) Количество вещества эквивалента:
n(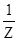 X) =
X) =  .
.
III. ЗАКОН ЭКВИВАЛЕНТОВ.
Вещества реагируют пропорционально их эквивалентам:
С (1/ z X) × V(Х) = С (1/ z Y) × V(Y)



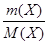

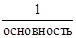
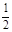 ;
;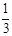 ;
; ;
; .
.
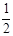 , для гидроксида алюминия — 1,
, для гидроксида алюминия — 1, 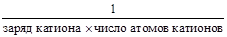

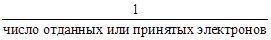
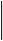 2 Mn+7 + 5e = Mn+2
2 Mn+7 + 5e = Mn+2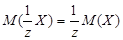
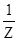 X) =
X) =  .
.


