РОЛЬ БЕЛКОВ В ПИТАНИИ, НОРМЫ, АЗОТИСТЫЙ БАЛАНС, КОЭФФИЦИЕНТ ИЗНАШИВАНИЯ,ФИЗИОЛОГИЧЕСКИЙ БЕЛКОВЫЙ МИНИМУМ. БЕЛКОВАЯ НЕДОСТАТОЧНОСТЬ.
АК содержат почти 95% всего азота, поэтому именно они поддерживают азотистый баланс организма. Азотистый баланс - разница между количеством азота, поступающего с пищей, и количеством выделяемого азота. Если количество поступающего азота равно количеству выделяемого, то наступает азотистое равновесие. Такое состояние бывает у здорового человека при нормальном питании. Азотистый баланс может быть положительным (азота поступает больше, чем выводится) у детей, у пациентов. Отрицательный азотистый баланс (выделение азота преобладает над его поступлением) наблюдают при старении, голодании и во время тяжёлых заболеваний. При без белковой диете азотистый баланс становится отрицательным. Минимальное количество белков в пище, необходимое для поддержания азотистого равновесия, соответствует 30-50 г/cyt, оптимальное же количество при средней физической нагрузке составляет ∼100-120 г/сут.
аминокислоты, синтез которых сложен и неэкономичен для организма, очевидно, выгоднее получать с пищей. Такие аминокислоты называют незаменимыми. К ним относят фенилаланин, метионин, треонин, триптофан, валин, лизин, лейцин, изолейцин.
Две аминокислоты - аргинин и гистидин называют частично заменимыми. - тирозин и цистеин - условно заменимые, так как для их синтеза необходимы незаменимые аминокислоты. Тирозин синтезируется из фенилаланина, а для образования цистеина необходим атом серы метионина.
Остальные аминокислоты легко синтезируются в клетках и называются заменимыми. К ним относят глицин, аспарагиновую кислоту, аспарагин, глутаминовую кислоту, глутамин, серии, пролин, аланин.
Однако безбелковое питание заканчивается гибелью организма. Исключение даже одной незаменимой аминокислоты из рациона ведёт к неполному усвоению других аминокислот и сопровождается развитием отрицательного азотистого баланса, истощением, остановкой роста и нарушениями функций нервной системы.
При безбелковой диете в сутки выделяется 4гр азота,что составляет 25гр белка (КОЭФ-Т ИЗНАШИВАНИЯ).
Физиологический белковый минимум- минимальное количество белков в пище необходимое для поддержания азотистого равновесия- 30-50 г/сут.
ПЕРЕВАРИВАНИЕ БЕЛКОВ В ЖКТ. ХАРАКТЕРИСТИКА ПЕПТИДАЗ ЖЕЛУДКА, ОБРАЗОВАНИЕ И РОЛЬ СОЛЯНОЙ КИСЛОТЫ.
В пищевых продуктах содержание свободных аминокислот очень мало. Подавляющее их количество входит в состав белков, которые гидролизуются в ЖКТ под действием ферментов протеаз). Субстратная специфичность этих ферментов заключается в том, что каждый из них с наибольшей скоростью расщепляет пептидные связи, образованные определёнными аминокислотами. Протеазы, гидролизующие пептидные связи внутри белковой молекулы, относят к группе эндопептидаз. Ферменты, относящиеся к группе экзопептидаз, гидролизуют пептидную связь, образованную концевыми аминокислотами. Под действием всех протеаз ЖКТ белки пищи распадаются на отдельные аминокислоты, которые затем поступают в клетки тканей.
Образование и роль соляной кислоты
Основная пищеварительная функция желудка заключается в том, что в нём начинается переваривание белка. Существенную роль в этом процессе играет соляная кислота. Белки, поступающие в желудок, стимулируют выделение гистамина и группы белковых гормонов - гастринов, которые, в свою очередь, вызывают секрецию НСI и профермента - пепсиногена. НСI образуется в обкладочных клетках желудочных желёз
Источником Н+ является Н2СО3, которая образуется в обкладочных клетках желудка из СО2, диффундирующего из крови, и Н2О под действием фермента карбоангидразы
Диссоциация Н2СО3 приводит к образованию бикарбоната, который с участием специальных белков выделяется в плазму. Ионы С1- поступают в просвет желудка через хлоридный канал.
рН снижается до 1,0-2,0.
Под действием НСl происходит денатурация белков пищи, не подвергшихся термической обработке, что увеличивает доступность пептидных связей для протеаз. НСl обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник. Кроме того, соляная кислота активирует пепсиноген и создаёт оптимум рН для действия пепсина.
Пепсиноген - белок, состоящий из одной полипептидной цепи. Под действием НСl он превращается в активный пепсин В процессе активации в результате частичного протеолиза от N-конца молекулы пепсиногена отщепляются аминокислотных остатка, которые содержат почти все положительно заряженные аминокислоты, имеющиеся в пепсиногене. Таким образом, в активном пепсине преобладающими оказываются отрицательно заряженные аминокислоты, которые участвуют в конформационных перестройках молекулы и формировании активного центра. Образовавшиеся под действием НСl активные молекулы пепсина быстро активируют остальные молекулы пепсиногена (аутокатализ). Пепсин в первую очередь гидролизует пептидные связи в белках, образованные ароматическими аминокислотами (фенилаланин, триптофан, тирозин) Пепсин - эндопептидаза, поэтому в результате его действия в желудке образуются более короткие пептиды, но не свободные аминокислоты.
У детей грудного возраста в желудке находится фермент реннин (химозин), вызывающий свёртывание молока. В желудке взрослых людей реннина нет, молоко у них створаживается под действием НСl и пепсина.
ещё одна протеаза - гастриксин. Все 3 фермента (пепсин, реннин и гастриксин) сходны по первичной структуре
КЕТОГЕННЫЕ И ГЛИКОГЕННЫЕ АМИНОКИСЛОТЫ. АНАПЛЕРОТИЧЕСКИЕ РЕАКЦИИ, СИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ (ПРИМЕР).
Катаболизм аминок-т сводится к образованию пируват, ацетил-КоА, α -кетоглутарат, сукцинил-КоА, фумарат, оксалоацетат гликогенных аминокислоты - превращаются в пируват и промежуточные продукты ЦТК и образуют в конечном итоге оксалоацетат, могут использоваться впроцессе глюконеогенеза.
кетогенные аминок-ты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел.
гликокетогенными аминокислоты используется и для синтеза глюкозы, и для синтеза кетоновых тел, так как в процессе их катаболизма образуются 2 продукта - определённый метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле).
Анаплеротические реакции - безазотистые остатки аминокислот используются для восполнения того количества метаболитов общего пути катаболизма, которое затрачивается на синтез биологически активных веществ.
1. 
Фермент пируваткарбоксилаза (кофермент - биотин), катализирующий эту реакцию, обнаружен в печени и мышцах.
2. Аминокислоты → Глутамат → α-Кетоглутарат
под действием глутаматдегидрогеназы или аминотрансфераз.
3. 
Пропионил-КоА, а затем и сукцинил-КоА могут образоваться также при распаде высших жирных кислот с нечётным числом атомов углерода
4. Аминокислоты → Фумарат
5. Аминокислоты → Оксалоацетат
Реакции 2, 3 происходят во всех тканях (кроме печени и мышц), где отсутствует пируваткарбоксилаза.
VII. БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ
В организме человека возможен синтез восьми заменимых аминокислот: Ала, Асп, Асн, Сер, Гли, Глу, Глн, Про. Углеродный скелет этих аминокислот образуется из глюкозы. α-Аминогруппа вводится в соответствующие α-кетокислоты в результате реакций трансаминирования. Универсальным донором α -аминогруппы служит глутамат.
Путём трансаминирования α-кетокислот, образующихся из глюкозы, синтезируются аминокислоты
Глутамат также образуется при восстановительном аминировании α-кетоглутарата глутаматдегидрогеназой.

ТРАНСАМИНИРОВАНИЕ: СХЕМА ПРОЦЕССА, ФЕРМЕНТЫ, БИОРОЛЬ. БИОРОЛЬ АЛАТ И АСАТ И КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ИХ ОПРЕДЕЛЕНИЯ В СЫВОРОТКЕ КРОВИ.
Трансаминирование - реакция переноса α-аминогруппы с ак-ы на α-кетокислоту, в результате чего образуются новая кетокислота и новая ак. процесс трансаминирования легко обратим
Реакции катализируют ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ)
Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток эукариот. В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной специфичности. Вступать в реакции трансаминирования могут почти все аминокислоты, за исключением лизина, треонина и пролина.

- На первой стадии к пиридоксальфосфату в активном центре фермента с помощью альдиминной связи присоединяется аминогруппа от первого субстрата – ак-ы. Образуются комплекс фермент-пиридокса-минфосфат и кетокислота - первый продукт реакции. Этот процесс включает промежуточное образование 2 шиффовых оснований.
- На второй стадии комплекс фермент-пиридоксаминфосфат соединяется с кетокислотой и через промежуточное образование 2 шиффовых оснований передаёт аминогруппу на кетокислоту. В результате фермент возвращается в свою нативную форму, и образуется новая аминокислота - второй продукт реакции. Если альдегидная группа пиридоксальфосфата не занята аминогруппой субстрата, то она образует шиффово основание с ε-аминогруппой радикала лизина в активном центре фермента
Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных - глутамат, аланин, аспартат и соответствующие им кетокислоты - α -кетоглутарат, пируват и оксалоацетат. Основным донором аминогруппы служит глутамат.

Наиболее распространёнными ферментами в большинстве тканей млекопитающих являются: АЛТ (АлАТ) катализирует реакцию транса-минирования между аланином и α-кетоглутаратом. Локализован этот фермент в цитозоле клеток многих органов, но наибольшее его количество обнаружено в клетках печени и сердечной мышцы. ACT (АсАТ) катализирует реакцию трансами-нирования между аепартатом и α-кетоглутаратом. образуются оксалоацетат и глутамат. Наибольшее его количество обнаружено в клетках сердечной мышцы и печени. органоспецифичность этих ферментов.
В норме в крови активность этих ферментов составляет 5-40 Е/л. При повреждении клеток соответствующего органа ферменты выходят в кровь, где активность их резко повышается. Поскольку ACT и АЛТ наиболее активны в клетках печени, сердца и скелетных мышц, их используют для диагностики болезней этих органов. В клетках сердечной мышцы количество ACT значительно превышает количество АЛТ, а в печени - наоборот. Поэтому особенно информативно одновременное измерение активности обоих ферментов в сыворотке крови. Соотношение активностей ACT/АЛТ называют "коэффициент де Ритиса". В норме этот коэффициент равен 1,33±0,42. При инфаркте миокарда активность ACT в крови увеличивается в 8-10 раз, а АЛТ - в 2,0 раза.
При гепатитах активность АЛТ в сыворотке крови увеличивается в ∼8-10 раз, a ACT - в 2-4 раза.
Синтез меланинов.

Виды меланинов
Реакция активация метионина
Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина. Аденозин образуется при гидролизе АТФ.
Эту реакцию катализирует фермент метионин аденозилтрансфераза, присутствующий во всех типах клеток. Структура (-S+-CH3) в SAM - нестабильная группировка, определяющая высокую активность метильной группы (отсюда термин "активный метионин"). Эта реакция уникальна для биологических систем, так как, по-видимому, является единственной известной реакцией, в результате которой освобождаются все три фосфатных остатка АТФ. Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT).

Синтез креатина
Креатин необходим для образования в мышцах высокоэнергетического соединения - кре-атинфосфата. Синтез креатина идёт в 2 стадии с участием 3 аминокислот: аргинина, глицина и метионина. В почках образуется гуанидинацетат при действии глицинамидинотрансферазы. Затем гуанидинацетат транспортируется в печень, где происходит реакция его метилирования.

Реакции трансметилирования используются также для:
- синтеза адреналина из норадреналина;
- синтеза анзерина из карнозина;
- метилирования азотистых оснований в нуклеотидах и др.;
- инактивации метаболитов (гормонов, медиаторов и др.) и обезвреживания чужеродных соединений, включая и лекарственные препараты.
Инактивация биогенных аминов также происходит:
метилированием с участием SAM под действием метилтрансфераз. Таким образом могут инактивироваться различные биогенные амины, но чаще всего происходит инактивация гастамина и адреналина. Так, инактивация адреналина происходит путём метилирования гидроксильной группы в ортоположении

ТОКСИЧНОСТЬ АММИАКА. ЕГО ОБРАЗОВАНИЕ И ОБЕЗВРЕЖИВАНИЕ.
Катаболизм аминокислот в тканях происходит постоянно со скоростью ∼100 г/сут. При этом в результате дезаминирования аминокислот освобождается большое количество аммиака. Значительно меньшие количества его образуются при дезаминировании биогенных аминов и нуклеотидов. Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение белков в кишечнике) и поступает в кровь воротной вены. Концентрация аммиака в крови воротной вены существенно больше, чем в общем кровотоке. В печени задерживается большое количество аммиака, что поддерживает низкое содержание его в крови. Концентрация аммиака в крови в норме редко превышает 0,4-0,7 мг/л (или 25-40 мкмоль/л
Аммиак - токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и прежде всего на ЦНС. Так, повышение концентрации аммиака в мозге до 0,6 ммоль вызывает судороги. К симптомам гипераммониемии относят тремор, нечленораздельную речь, тошноту, рвоту, головокружение, судорожные припадки, потерю сознания. В тяжёлых случаях развивается кома с летальным исходом. Механизм токсического действия аммиака на мозг и организм в целом, очевидно, связан с действием его на несколько функциональных систем.
- Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глугамата:
α-Кетоглутарат + NADH + Н+ + NH3 → Глутамат + NAD+.
Уменьшение концентрации α-кетоглутарата вызывает:
· угнетение обмена аминокислот (реакции транса-минирования) и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.);
· гипоэнергетическое состояние в результате снижения скорости ЦТК.
Недостаточность α-кетоглутарата приводит к снижению концентрации метаболитов ЦТК, что вызывает ускорение реакции синтеза оксалоа-цетата из пирувата, сопровождающейся интенсивным потреблением СО2. Усиленное образование и потребление диоксида углерода при гипераммониемии особенно характерны для клеток головного мозга. Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону (вызывает алкалоз). Это, в свою очередь, увеличивает сродство гемоглобина к кислороду, что приводит к гипоксии тканей, накоплению СО2 и гипоэнергетическому состоянию, от которого главным образом страдает головноймозг. Высокие концентрации аммиака стимулируют синтез глутамина из глутамата в нервной ткани (при участии глутаминсинтетазы):
Глутамат + NH3 + АТФ → Глутамин + АДФ + Н3Р04.
· Накопление глутамина в клетках нейроглии приводит к повышению осмотического давления в них, набуханию астроцитов и в больших концентрациях может вызвать отёк мозга.Снижение концентрации глутамата нарушает обмен аминокислот и нейромедиаторов, в частности синтез у-аминомасляной кислоты (ГАМК), основного тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги. Ион NH4+ практически не проникает через цитоплазматические и митохондриальные мембраны. Избыток иона аммония в крови способен нарушать трансмембранный перенос одновалентных катионов Na+ и К+, конкурируя с ними за ионные каналы, что также влияет на проведение нервных импульсов.
Высокая интенсивность процессов дезаминирования аминокислот в тканях и очень низкий уровень аммиака в крови свидетельствуют о том, что в клетках активно происходит связывание аммиака с образованием нетоксичных соединений, которые выводятся из организма с мочой. Эти реакции можно считать реакциями обезвреживания аммиака. В разных тканях и органах обнаружено несколько типов таких реакций. Основной реакцией связывания аммиака, протекающей во всех тканях организма, является 1.) синтез глутамина под действием глутамин-синтетазы:

Глутаминсинтетаза локализована в митохондриях клеток, для работы фермента необходим кофактор - ионы Mg2+. Глутаминсинтетаза - один из основных регуляторных ферментов обмена аминокислот и аллостерически ингибируется АМФ, глюкозо-6-фосфатом, а также Гли, Ала и Гис.
В клетках кишечника под действием фермента глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:

Образовавшийся в реакции глутамат подвергается трансаминированию с пируватом. ос-Аминогруппа глутаминовой кислоты переносится в состав аланина:


Глутамин - основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров и других соединений.
МЕТОД КОЛ-В ОПРЕДЕЛЕНИЯ МОЧЕВИНЫ В СЫВОРОТКЕ КРОВИ
В биологических жидкостях М. определяют с помощью газометрических методов, прямых фотометрических методов, основанных на реакции М. с различными веществами с образованием эквимолекулярных количеств окрашенных продуктов, а также ферментативных методов с использованием главным образом фермента уреазы. Газометрические методы основаны на окислении М. гипобромитом натрия в щелочной среде NH2—СО—NH2 + 3NaBrO → N2 + CO2 + 3NaBr + 2H2O. Объем газообразного азота измеряют с помощью специального аппарата, чаще всего аппарата Бородина. Однако этот метод обладает низкой специфичностью и точностью. Из фотометрических наиболее распространены методы, основанные на реакции М. с диацетилмонооксимом (реакция Ферона).
Для определения мочевины в сыворотке крови и моче используют унифицированный метод, основанный на реакции М. с диацетилмонооксимом в присутствии тиосемикарбазида и солей железа в кислой среде. Другим унифицированным методом определения М. является уреазный метод: NH2—СО—NH2 → уреазаNH3 +CO2. Выделившийся аммиак образует с гипохлоритом натрия и фенолом индофенол, имеющий синий цвет. Интенсивность окраски пропорциональна содержанию М. в исследуемой пробе. Уреазная реакция высокоспецифична, для исследования берут лишь 20 мкл сыворотки крови, разведенной в соотношении 1: 9 раствором NaCI (0,154 М). Иногда вместо фенола используют салицилат натрия; сыворотку крови разводят следующим образом: к 10 мкл сыворотки крови добавляют 0,1 мл воды или NaCI (0,154 М). Ферментативная реакция в обоих случаях протекает при 37° в течение 15 и 3—31/2 мин соответственно.
Производные М., в молекуле которой атомы водорода замещены кислотными радикалами, носят название уреидов. Многие уреиды и некоторые их галогензамещенные производные в медицине используют в качестве лекарственных средств. К уреидам относятся, например, соли барбитуровой кислоты (малонилмочевины), аллоксан (мезоксалилмочевина); гетероциклическим уреидом является Мочевая кислота.
ОБЩАЯ СХЕМА РАСПАДА ГЕМА. «ПРЯМОЙ» И «НЕПРЯМОЙ» БИЛИРУБИН, КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ЕГО ОПРЕДЕЛЕНИЯ.
Гем(гемоксигеназа)-биливердин(биливердинредуктаза)-билирубин(УДФ-глюкуранилтрансфераза)-билирубинмоноглюкуронид(УД-глюкуронилтрансфераза)-билирубиндиглюкуронид
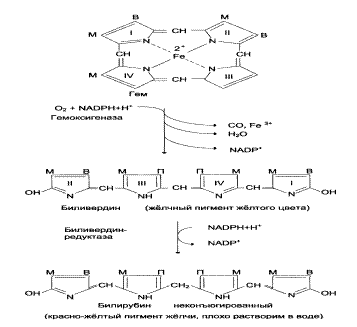
В нормальном состоянии концентрация общего билирубина в плазме составляет 0,3-1 мг/дл (1,7-17 мкмоль/л), 75% от общего количества билирубина находится в неконъюгированной форме (непрямой билирубин). В клинике конъ-югированный билирубин называют прямым, потому что он водорастворим и может быстро взаимодействовать с диазореагентом, образуя соединение розового цвета, - это прямая реакция Ван дер Берга. Неконъюгированный билирубин гидрофобен, поэтому в плазме крови содержится в комплексе с альбумином и не реагирует с диазореактивом до тех пор, пока не добавлен органический растворитель, например этанол, который осаждает альбумин. Неконъюгированный илирубин, взаимодействующий с азокрасителем только после осаждения белка, называют непрямым билирубином.
Когда содержание билирубина превышает норму, говорят о гипербилирубинемии. В зависимости от того, концентрация какого типа билирубина повышена в плазме - неконъюгированного или конъюгированного, - гипербилирубинемию классифицируют как неконъюгированную и конъюгированную.
У больных с печёночно-клеточной патологией, сопровождающейся длительным повышением концентрации конъюгированного билирубина, в крови обнаруживают третью форму плазменного билирубина, при котором билирубин ковалентно связан с альбумином, и поэтому его невозможно отделить обычным способом. В некоторых случаях до 90% общего содержания билирубина крови может находиться в этой форме.
МЕТОДЫ ОБНАРУЖЕНИЯ ГЕМА ГЕМОГЛОБИНА: ФИЗИЧЕСКИЙ (СПЕКТРАЛЬНЫЙ АНАЛИЗ ГЕМОГЛОБИНА И ЕГО ПРОИЗВОДНЫХ); ФИЗИКО-ХИМИЧЕСКИЙ (ПОЛУЧЕНИЕ КРИСТАЛЛОВ СОЛЯНОКИСЛОГО ГЕМИНА).
Спектральный анализ гемоглобина и его производных. Использование спектрографических методов при рассмотрении раствора оксигемоглобина выявляет в желто—зеленой части спектра между фраунгоферовскими линиями D и Е две системные полосы поглощения, у восстановленного гемоглобина в той же части спектра имеется лишь одна широкая полоса. Различия в поглощении излучения гемоглобином и оксигемоглобином послужили основой для метода изучения степени насыщения крови кислородом — оксигемометрии.
Карбгемоглобин по своему спектру близок к оксигемоглобину, однако при добавлении восстанавливающего вещества у карбгемоглобина появляются две полосы поглощения. Спектр метгемоглобина характеризуется одной узкой полосой поглощения слева на границе красной и желтой части спектра, второй узкой полосой на границе желтой и зеленой зон, наконец, третьей широкой полосой в зеленой части спектра
Кристаллы гемина или солянокислого гема-тина. С поверхности пятна соскабливается на предметное стекло и измельчается несколько крупинок. К ним добавляются 1—2 крупинки поваренной соли и 2—3 капли ледяной уксус- ной к-ты. Все накрывают покровным стеклом и осторожно, не доводя до кипения, нагревают. Присутствие крови доказывается появлением микрокристаллов буро-желтого цвета в виде ромбических табличек. Если кристаллы плохо сформированы, то имеют вид конопляного семени. Получение кристаллов гемина безусловно доказывает присутствие в исследуемом объекте крови. Отрицательный результат пробы не имеет значения. Примесь жира,ржавчина затрудняют получение кристаллов гемина
АКТИВНЫЕ ФОРМЫ КИСЛОРОДА: СУПЕРОКСИД АНИОН, ПЕРОКСИД ВОДОРОДА, ГИДРОКСИЛЬНЫЙ РАДИКАЛ, ПЕРОКСИНИТРИТ. ИХ ОБРАЗОВАНИЕ, ПРИЧИНЫ ТОКСИЧНОСТИ. ФИЗИОЛОГИЧЕСКАЯ РОЛЬ АФК.
В ЦПЭ поглощается около 90% поступающего в клетки О2. Остальная часть О2 используется в других ОВР. Ферменты, участвующие ОВР с использованием О2, делятся на 2 группы: оксидазы и оксигеназы.
Оксидазы используют молекулярный кислород только в качестве акцептора электронов, восстанавливая его до Н2О или Н2О2.
Оксигеназы включают один (монооксигеназы) или два (диоксигеназы) атома кислорода в образующийся продукт реакции.
Хотя эти реакции не сопровождаются синтезом АТФ, они необходимы для многих специфических реакций в обмене аминокислот), синтезе жёлчных кислот и стероидов), в реакциях обезвреживания чужеродных веществ в печени
В большинстве реакций с участием молекулярного кислорода его восстановление происходит поэтапно с переносом одного электрона на каждом этапе. При одноэлектронном переносе происходит образование промежуточных высокореактивных форм кислорода.
В невозбуждённом состоянии кислород нетоксичен. Образование токсических форм кислорода связано с особенностями его молекулярной структуры. О2 содержит 2 неспаренных электрона, которые располагаются на разных орбиталях. Каждая из этих орбиталей может принять ещё один электрон.
Полное восстановление О2 происходит в результате 4 одноэлектронных переходов:

Супероксид, пероксид и гидроксильный радикал - активные окислители, что представляет серьёзную опасность для многих структурных компонентов клетки
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, инициируя цепные окислительные реакции
Повреждающее действие свободных радикалов на компоненты клетки. 1 - разрушение белков; 2 - повреждение ЭР; 3 - разрушение ядерной мембраны и повреждение ДНК; 4 - разрушение мембран митохондрий; проникновение в клетку воды и ионов.
Образование супероксида в ЦПЭ. "Утечка" электронов в ЦПЭ может происходить при переносе электронов с участием коэнзима Q. При восстановлении убихинон превращается в анион-радикал семихинона. Этот радикал нефермента-тивно взаимодействует с О2 с образованием супероксидного радикала. 
Большая часть активных форм кислорода образуется при переносе электронов в ЦПЭ, прежде всего, при функционировании QH2-дегидрогеназного комплекса. Это происходит в результате неферментативного переноса ("утечки") электронов с QH2 на кислород (
на этапе переноса электронов при участии цитохромоксидазы (комплекс IV) "утечка" электронов не происходит благодаря наличию в ферменте специальных активных центров, содержащих Fe и Сu и восстанавливающих О2 без освобождения промежуточных свободных радикалов.
В фагоцитирующих лейкоцитах в процессе фагоцитоза усиливаются поглощение кислорода и образование активных радикалов. Активные формы кислорода образуются в результате активации NADPH-оксидазы, преимущественно локализованной на наружной стороне плазматической мембраны, инициируя так называемый "респираторный взрыв" с образованием активных форм кислорода
Защита организма от токсического действия активных форм кислорода связана с наличием во всех клетках высокоспецифичных ферментов: супероксиддисмутазы, каталазы, глутатион-пероксидазы, а также с действием антиоксидантов.
ОБЕЗВРЕЖИВАНИЕ АКТИВНЫХ ФОРМ КИСЛОРОДА. ФЕРМЕНТНАЯ АНТИОКСИДАНТНАЯ СИСТЕМА (КАТАЛАЗА, СУПЕРОКСИДДИСМУТАЗА, ГЛУТАТИОНПЕРОКСИДАЗА, ГЛУТАТИОНРЕДУКТАЗА). СХЕМЫ ПРОЦЕССОВ, БИОРОЛЬ, МЕСТО ПРОТЕКАНИЯ.
Супероксиддисмутаза катализирует реакцию дисмутации супероксидных анион – радикалов:
О2.- + О2.- = О2 + Н 2О2
В ходе реакции образовался пероксид водорода, он способен инактивировать СОД, поэтому супероксиддисмутаза всегда «работает» в паре скаталазой, которая быстро и эффективно расщепляет пероксид водорода на абсолютно нейтральные соединения.
Каталаза (КФ 1.11.1.6) – гемопротеин, который катализирует реакцию обезвреживания пероксида водорода, образующегося в результате реакции дисмутации супероксидного радикала:
2H2O2 = 2H2O + O2
Глутатионпероксидазакатализирует реакции, в которых фермент восстанавливает пероксид водорода до воды, а также восстановление органических гидропероксидов (ROOH) до гидроксипроизводных, и в результате переходит в окисленную дисульфидную форму GS-SG:
2GSH + H2O2 = GS-SG + H2O
2GSH + ROOH = GS-SG + ROH +H2O
Глутатионпероксидаза обезвреживает не только H2O2, но и разные органические липидные пероксилы, которые образуются в организме при активации ПОЛ.
Глутатионредуктаза (КФ 1.8.1.7) – флавопротеин с простетической группой флавинадениндинуклеотидом, состоит из двух идентичных субъединиц. Глутатионредуктаза катализирует реакцию восстановления глутатиона из окисленной его формы GS-SG, а все другие ферменты глутатионсинтетаз используют его:
2NADPH + GS-SG = 2NADP + 2 GSH
Это классический цитозольный фермент всех эукариот.Глутатионтрансфераза катализирует реакцию:
RX + GSH = HX + GS-SG
ФАЗА КОНЪЮГАЦИИ В СИСТЕМЕ ОБЕЗВРЕЖИВАНИЯ ТОКСИЧЕСКИХ ВЕЩЕСТВ. ВИДЫ КОНЪЮГАЦИИ (ПРИМЕРЫ РЕАКЦИЙ С ФАФС, УДФГК)
Конъюгация - вторая фаза обезвреживание веществ, в ходе которой происходит присоединение к функциональным группам, образующимся на первом этапе, других молекул или групп эндогенного происхождения, увеличивающих гидрофильность и уменьшающих токсичность ксенобиотиков
1. Участие трансфераз в реакциях конъюгации
УДФ-глюкуронилтрансферазы. Локализированные в основном в ЭР уридин-дифосфат (УДФ)-глюкуронилтрансферазы присоединяют остаток глюкуроновой кислоты к молекуле вещества, образованного в ходе мик-росомального окисления
В общем виде: ROH + УДФ-С6Н9О6 = RO-C6H9O6 + УДФ.
Сульфотрансферазы. Цитоплазматические cульфотрансферазы катализируют реакцию конъюгации, в ходе которой остаток серной кислоты (-SO3H) от 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) присоединяется к фенолам, спиртам или аминокислотам
Реакция в общем виде: ROH + ФАФ-SO3H = RO-SO3H + ФАФ.
Ферменты сульфотрансферазы и УДФ-глюкуронилтрансферазы участвуют в обезвреживании ксенобиотиков, инактивации лекарств и эндогенных биологически активных соединений.
Глутатионтрансферазы. Особое место среди ферментов, участвующих в обезвреживании ксенобиотиков, инактивации нормальных метаболитов, лекарств, занимают глутатионтрансферазы (ГТ). Глутатионтрансферазы функционируют во всех тканях и играют важную роль в инактивации собственных метаболитов: некоторых стероидных гормонов, билирубина, жёлчных кислот, В клетке ГТ в основном локализованы в цитозоле, но имеются варианты ферментов в ядре и митохондриях.
Глутатион - трипептид Глу-Цис-Гли (остаток глутаминовой кислоты присоединён к цис-теину карбоксильной группой радикала). ГТ обладают широкой специфичностью к субстратам, общее количество которых превышает 3000. ГТ связывают очень многие гидрофобные вещества и инактивируют их, но химической модификации с участием глугатиона подвергаются только те, которые имеют полярную группу. То есть субстратами служат вещества, которые, с одной стороны, имеют электрофильный центр (например, ОН-группу), а с другой стороны - гидрофобные зоны. Обезвреживание, т.е. химическая модификация ксенобиотиков с участием ГТ, может осуществляться тремя различными способами:
путём конъюгации субстрата R с глутатионом (GSH): R + GSH → GSRH,
в результате нуклеофильного замещения: RX + GSH → GSR + НХ,
восстановления органических пероксидов до спиртов: R-HC-O-OH + 2 GSH → R-HC-OH + GSSG + H2O
В реакции: ООН - гидропероксидная группа, GSSG - окисленный глутатион.
Сисгема обезвреживания с участием ГТ и глутатиона играет уникальную роль в формировании резистентности организма к самым различным воздействиям и является наиболее важным защитным механизмом клетки. В ходе биотрансформации некоторых ксенобиотиков под действием ГТ образуются тиоэфиры (конъюгаты RSG), которые затем превращаются в меркаптаны, среди которых обнаружены токсические продукты. Но конъюгаты GSH с большинством ксенобиотиков менее реакционно-способны и более гидрофильны, чем исходные вещества, а поэтому менее токсичны и легче выводятся из организма
ГТ своими гидрофобными центрами могут не-ковалентно связывать огромное количество ли-пофильных соединений (физическое обезвреживание), предотвращая их внедрение в липидный слой мембран и нарушение функций клетки. Поэтому ГТ иногда называют внутриклеточным альбумином.
ГТ могут ковалентно связывать ксенобиотики, являющиеся сильными электролитами. Присоединение таких веществ - "самоубийство" для ГТ, но дополнительный защитный механизм для клетки.
Ацетилтрансферазы, метилтрансферазы
Ацетилтрансферазы катализируют реакции конъюгации - переноса ацетильного остатка от ацетил-КоА на азот группы -SO2NH2, например в составе сульфаниламидов. Мембранные и цитоплазматические метилтрансферазы с участием SAM метилируют группы -Р=О, -NH2 и SH-группы ксенобиотиков.
Роль эпоксидгидролаз в образовании диолов
Во второй фазе обезвреживания (реакции конъюгации) принимают участие и некоторые другие ферменты. Эпоксидгидролаза (эпоксидгидратаза) присоединяет воду к эпоксидам бензола, бензпирена и другим полициклическим углеводородам, образованным в ходе первой фазы обезвреживания, и превращает их в диолы (рис. 12-8). Эпоксиды, образовавшиеся при микросомальном окислении, являются канцерогенами. Они обладают высокой химической активностью и могут участвовать в реакциях неферментативного алкилирования ДНК, РНК, белков Химические модификации этих молекул могут привести к перерождению нормальной клетки в опухолевую.
РОЛЬ БЕЛКОВ В ПИТАНИИ, НОРМЫ, АЗОТИСТЫЙ БАЛАНС, КОЭФФИЦИЕНТ ИЗНАШИВАНИЯ,ФИЗИОЛОГИЧЕСКИЙ БЕЛКОВЫЙ МИНИМУМ. БЕЛКОВАЯ НЕДОСТАТОЧНОСТЬ.
АК содержат почти 95% всего азота, поэтому именно они поддерживают азотистый баланс организма. Азотистый баланс - разница между количеством азота, поступающего с пищей, и количеством выделяемого азота. Если количество поступающего азота равно количеству выделяемого, то наступает азотистое равновесие. Такое состояние бывает у здорового человека при нормальном питании. Азотистый баланс может быть положительным (азота поступает больше, чем выводится) у детей, у пациентов. Отрицательный азотистый баланс (выделение азота преобладает над его поступлением) наблюдают при старении, голодании и во время тяжёлых заболеваний. При без белковой диете азотистый баланс становится отрицательным. Минимальное количество белков в пище, необходимое для поддержания азотистого равновесия, соответствует 30-50 г/cyt, оптимальное же количество при средней физической нагрузке составляет ∼100-120 г/сут.
аминокислоты, синтез которых сложен и неэкономичен для организма, очевидно, выгоднее получать с пищей. Такие аминокислоты называют незаменимыми. К ним относят фенилаланин, метионин, треонин, триптофан, валин, лизин, лейцин, изолейцин.
Две аминокислоты - аргинин и гистидин называют частично заменимыми. - тирозин и цистеин - условно заменимые, так как для их синтеза необходимы незаменимые аминокислоты. Тирозин синтезируется из фенилаланина, а для образования цистеина необходим атом серы метионина.
Остальные аминокислоты легко синтезируются в клетках и называются заменимыми. К ним относят глицин, аспарагиновую кислоту, аспарагин, глутаминовую кислоту, глутамин, серии, про






















