Цель такой валидации – подтверждение на основании экспериментальных данных, что данная лаборатория в состоянии корректно воспроизвести фармакопейную методику или испытание:
• На конкретном аналитическом оборудовании;
• При использовании данных реактивов;
• В данных условиях окружающей среды;
• При выполнении анализа аналитиками данной лаборатории.
Методики испытаний микробиологических показателей:
1. Количественное определение (активность)
2. Микробиологическая чистота
3. Стерильность
Каждое отдельное исследование оформляется в виде протокола.
Основные требования к протоколам:
• должны содержать информацию об условиях, в которых проводились испытания;
• должны в полном объеме содержать первичные данные
испытаний; • должны последовательно отображать ход эксперимента.
Валидация методики определения количественного содержания (активности) антибиотиков микробиологическим методом диффузии в агар: прецизионность (повторяемость, внутрилабораторная воспроизводимость), правильность.
Валидация методики определения количественного содержания (активности) антибиотиков микробиологическим методом (диффузии в агар)
Количественное определение – предназначено для определения количества анализируемого вещества в образце.
Методика количественного определения антибиотиков микробиологическим методом – методика количественного определения действующего вещества.
Для валидации фармакопейной методики определения количественного содержания (активности) действующих веществ в антибиотиках, в т.ч. микробиологическим методом, обязательными параметрами являются показатели точности:
- прецизионность (точность); - правильность,
Прецизионность (точность).
• Прецизионность МИ - выражение степени близости результатов для серии измерений, выполненных по данной методике на различных пробах одного итого же образца (одной серии).
• Прецизионность подтверждается повторяемостью, внутри- и межлабораторной воспроизводимостью.
Повторяемость – характеризует точность методики при ее выполнении в течение небольшого промежутка времени в одних и тех же условиях: одним аналитиком, при неизменных условиях окружающей среды (t, W, P).
• Используют трехдозный метод диффузии в агар. Тест- микроорганизмы, питательные среды, буферные растворы – в соответствии с???
• Готовят чашки Петри, как для определения активности антибиотиков методом диффузии в агар трехдозным методом с использованием требуемого тест-микроорганизма
• Повторяемость оценивают по результатам 6-ти испытаний по 2 параллельных испытания для каждого из 3-х контейнеров (флаконов) одной серии препарата. 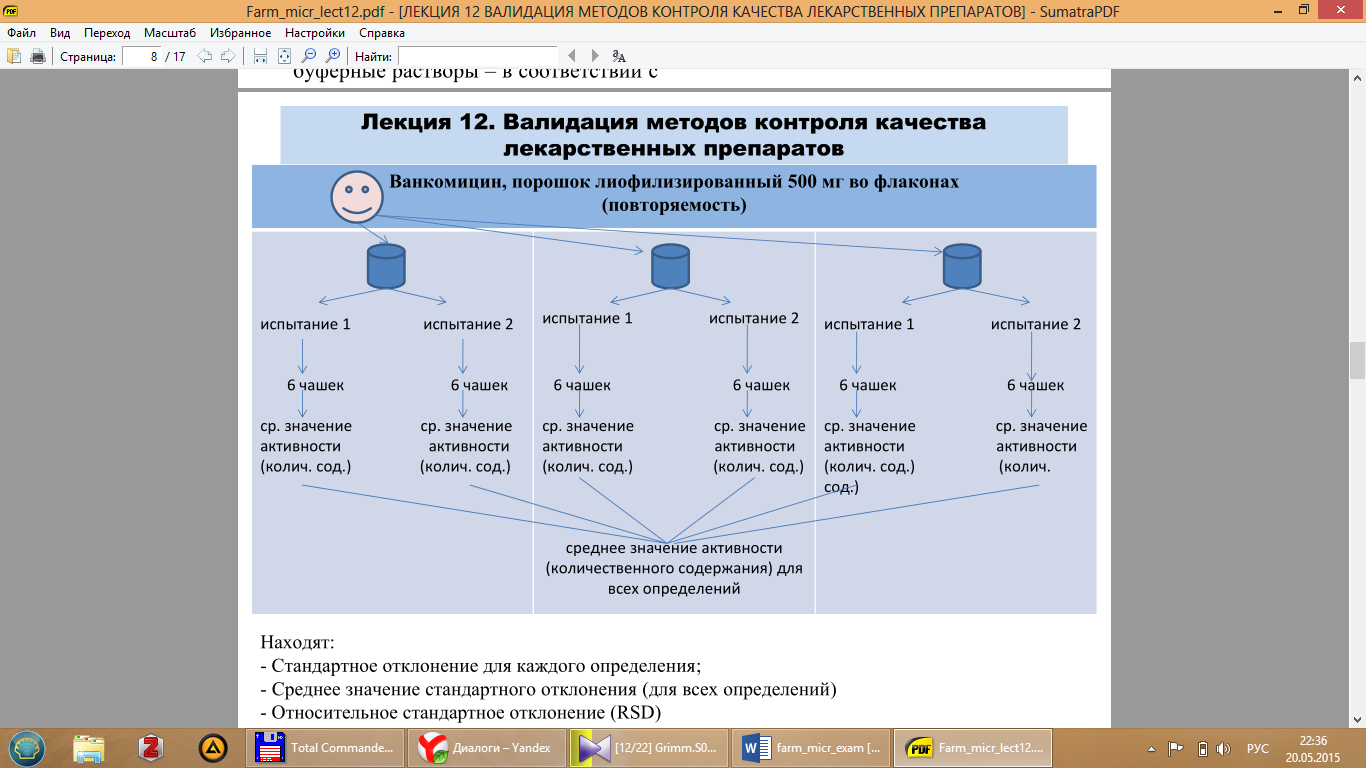
Находят:
- Стандартное отклонение для каждого определения;
- Среднее значение стандартного отклонения (для всех определений)
- Относительное стандартное отклонение (RSD)
• Критерий приемлемости для подтверждения повторяемости – величина относительного стандартного отклонения (RSD): отношение среднего значения стандартного отклонения к среднему значению активности (количественного содержания) исследуемого вещества для всех определений (%). • RSD – не более 2%.
Внутрилабораторная воспроизводимость - устанавливает влияние случайных факторов на точность валидируемой методики.
• Типичные исследуемые факторы: различные аналитики, различное оборудование, различные дни.
• Например: испытание проводится двумя аналитиками в разные дни. Каждый специалист проводит 6 испытаний для каждого из 3-х контейнеров (флаконов) одной серии препарата.
• Ход испытания – аналогично исследованию повторяемости. 
Находят:
- Стандартное отклонение для определения каждым специалистом;
- Среднее значение стандартного отклонения для определений двумя специалистами
- Относительное стандартное отклонение (RSD)
Критерий приемлемости для подтверждения внутрилабораторной воспроизводимости - величина относительного стандартного отклонения (RSD): отношение среднего значения стандартного отклонения к среднему значению активности (количественного содержания) по результатам определения двумя специалистами (%).
• RSD – не более 3%. Межлабораторная воспроизводимость – оценивается путем проведения межлабораторных исследований. (Необязательна для генерических препаратов). Правильность Правильность МИ - выражение степени соответствия между принятым эталонным значением и значением, полученным на основании большой серии результатов испытаний по данной методике.? Принятое эталонное значение – например, теоретически рассчитанное значение содержания вещества в модельном растворе? Испытание проводят трехдозным методом как описано выше? Правильность оценивают не менее чем для 9 определений для трех различных концентраций вещества (80%, 100%, 130% от номинального содержания в ЛС или АФИ): по три определения (по три чашки) для каждой концентрации. Например: • ЛС ванкомицин, порошок лиофилизированный 500 мг во флаконах содержит 500 мг активного вещества (ванкомицина гидрохлорида - АФИ). 80% - 400 мг – образец №1 100% - 500 мг – образец №2 130% - 650 мг – образец №3? Готовят соответствующие модельные растворы АФИ трех концентраций и проводят определение трехдозным
методом диффузии в агар
Анализ результатов

Критерий приемлемости - величина процента восстановления для каждой концентрации: отношение экспериментально полученной концентрации к теоретически рассчитанной (в %)
Процент восстановления должен быть в пределах 98 – 102% • Для образца №1 – 99% • Для образца №2 – 99,2% • Для образца №3 – 98,3% Подтверждена правильность МИ. Подтверждение прецизионности и правильности методики свидетельствуют о ее пригодности для контроля качества данного ЛС или АФИ. Вывод – данная методика гарантирует получение стабильных, достоверных результатов. Валидация методик определения микробиологической чистоты и стерильности Испытание на стерильность – подтверждение отсутствия в испытуемом образце жизнеспособных микроорганизмов Испытание на микробиологическую чистоту: • число бактерий и грибов – не более установленного критерия приемлемости • отдельные виды микроорганизмов не должны обнаруживаться в установленной массе (объеме) ЛС.
Валидация микробиологических методов контроля (микробиологической чистоты и стерильности) -минимально cтатистически подтвержденная пригодность методики, которая проводится на трех различных сериях препарата с учетом всех возможных факторов влияния на достоверность результатов экспериментальных исследований (питательные среды, растворы, персонал).
Поэтому валидационные исследования в отношении определения микробиологической чистоты и стерильности проводят: • на трех различных сериях препарата • трех разных партиях питательных сред • с привлечением трех специалистов, для исследования каждым из них по одной серии препарата • в разные дни (желательно). Методика определения качества лекарственных средств по микробиологическим показателям считывается валидной, если для трех различных серий препарата, на трех разных партиях питательных сред, у трех разных специалистов пригодность методики была подтверждена. Пригодность методики испытания:
1. Использование фармакопейных тест- микроорганизмов и подготовка их в соответствии с фармакопейными требованиями.
2. Подготовка образца - проводится аналогичным образом, как для испытаний микробиологической чистоты нестерильных лекарственных средств или стерильности.
3. Соблюдение условий приготовления питательных сред, проверка их ростовых, индикаторных и ингибирующих свойств (для каждой серии).
4. Проверка наличия/отсутствия антимикробного действия (среднее количество КОЕ на чашках с ЛС должно отличаться не более чем в 2 раза от количества КОЕ в контроле).
5. Нейтрализация антимикробного действия подходящим образом.
6. Предварительная оценка эффективности и безвредности инактиваторов и ПАВ.
7. Проведение контроля (рост культуры на питательной среде без ЛС) и отрицательного контроля (использование для инокуляции стерильного растворителя).
8. Демонстрация возможности обнаружения микроорганизмов- контаминантов в выбранных условиях проведения эксперимента








