Обессоливание воды – это процесс снижения общего содержания солей до значений, рекомендованных для дистиллированной воды (ГОСТ 6709-96) и ниже, т.е. до 5 мг/л и ниже. И если опреснение используется для получения воды питьевого качества из морской или солоноватой вод, то обессоливание применяется для получения чистой и ультрачистой воды для фармацевтики, медицины, микроэлектроники, теплоэнергетической, химической и других отраслей промышленности.
Существующие методы опреснения и обессоливания воды подразделяют на две основные группы: с изменением и без изменения агрегатного состояния воды.
К первой группе относят: дистилляцию, нагрев воды до критического состояния (до 350оС), замораживание, газогидратный метод, а ко второй группе – ионный обмен, электродиализ, обратный осмос (гиперфильтрацию), электродеионизацию.
Выбор метода обессоливания, прежде всего, обусловлен качеством исходной воды, требованиями к качеству обработанной воды, производительностью установки и технико-экономическими соображениями (см. диаграмму).
Как видно из диаграммы стоимость обессоливания воды ионным обменом сильно возрастает с увеличением общего солесодержания. При этом степень обессоливания воды уменьшается. Потому обессоливание воды методом ионного обмена целесообразно проводить для вод, имеющих исходную степень минерализации 800 – 1000 мг/л. При более высокой минерализации более выгодными экономически становятся методы дистилляции и обратного осмоса. Надо отметить, что указанное выше заявление априорно. При выборе метода обессоливания необходимо рассматривать все аспекты и экономические, и экологические, и технические.
7.2 основы ионного обмена
Принцип работы фильтров умягчения основан на методе напорного Na-катионирования воды. В качестве фильтрующего материала используется катионнообменная смола. Натрий-катионитовый метод применяют для умягчения воды с содержанием взвешенных веществ в воде не более 8 мг/л и цветностью воды не более 30 град. Жесткость воды снижается при одноступенчатом натрий-катионировании до значений 0,05 - 0,1 мг-экв/л, при двухступенчатом - до 0,01 – 0,02 мг-экв/л. При подборе катионита ориентируетесь на их механические свойства.
Процесс Nа-катионирования описывается следующими реакциями обмена:
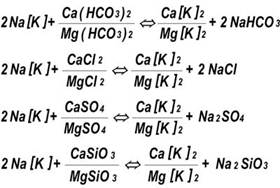
где К -нерастворимая матрица ионообменной смолы.
Умягчитель задерживает ионы кальция и магния, заменяя их ионами натрия. После истощения рабочей обменной емкости катионита он теряет способность умягчать воду и его необходимо регенерировать.
Вопрос 8. Ионнообменные материалы и их характеристики. Технология ионного обмена.
Все известные ионообменные материалы по химическому составу можно разделить на две группы: минеральные и органические. Минеральные иониты практически не применяются на ТЭС из-за малой емкости поглощения и способности к разложению в кислой среде с выделением кремниевой кислоты.
В настоящее время на ТЭС в основном находят применение лишь специально синтезированные иониты органического происхождения. При синтезе ионитов необходимо создать матрицу и ввести в нее функциональные группы. Имеется несколько путей для этого, но в основном это осуществляется введением функциональных групп в молекулы какого-либо имеющегося нерастворимого в воде органического вещества или получением практически нерастворимого вещества с последующим введением в его молекулу функциональных групп. По первому пути синтеза получают различные марки сульфоуглей. Для этого фракционированный уголь (бурый, антрацит) обрабатывают серной кислотой. При этом происходят процессы гумификации с образованием карбоксильных групп и сульфирования с образованием сульфогрупп.
Но основное направление синтеза состоит в получении ионитов на основе искусственных смол. Матрица такого ионита представляет собой пространственную сетчатую структуру из углеводородных цепей, которая может быть получена поликонденсацией или полимеризацией. В последние годы все чаще используют полимеризационные смолы, полученные на основе стирола. При полимеризации стирола образуется линейный полимер, который «сшивается» молекулами дивинилбензола с образованием трехмерной структуры:

где номером 1 обозначены молекулы стирола, а номером 2 — молекулы дивинил бензол а. Такая структура обладает известной степенью эластичности и способностью изменять свой объем (набухать) в воде. В строгом понимании пор в теле такого полимера нет, но их аналогом могут служить расстояния между сшивкой и цепями набухшего полимера (3 нм). Однако для специальных целей в настоящее время изготовляются макропористые иониты с радиусом пор от 8 до 2 • 104нм.
Функциональные группы, которые придают материалу смолы ионообменные свойства, присоединяются к бензольным ядрам, замещая в них атомы водорода. Группы, придающие ионитам свойства катионитов: — SO3H (сульфогруппа), — СООН (карбоксильная) и —ОН (фенольная). При контакте с водой функциональные группы катионитов диссоциируют; с отщеплением ионов водорода, которые образуют диффузный слой. Монофункциональные катиониты, содержащие сульфо-группы, являются сильнокислотными, а содержащие карбоксильные группы — слабокислотными. Имеются также; полифункциональные катиониты, содержащие обе группы (например, сульфоуголь). Характер группы существенно влияет на обменную емкость катионита в зависимости от рН. Сильнокислотные катиониты осуществляют обмен ионов в широкой области значений рН, тогда как слабокислотные в кислой области резко уменьшают способность ионов к обмену (уменьшается степень диссоциации функциональных групп).
Функциональными группами, придающими материалу смолы анионообменные свойства, являются различные аминогруппы (= N, =NH, — NH2) и группы четырехзамещенного аммония (—NR3OH). При присоединении первых трех групп образуются слабоосновные аниониты, а группа — NR3OH придает аниониту сильноосновный характер. Аминогруппы сорбируют ионы водорода с образованием комплексов — NH3+, =NH2+ (потенциалообразующих ионов) и последующим образованием диффузного слоя. Группа — NR3OH диссоциирует с переходом иона ОН- в диффузный слой. Слабоосновные аниониты успешно осуществляют ионный обмен лишь в кислых средах, тогда как у высокоосновных обмен анионов происходит в широкой области значений рН.
Качество ионитов определяется рядом физико-химических и технологических свойств, важнейшими из которых являются фракционный состав, насыпная плотность, химическая стойкость, механическая прочность, обменная емкость, кислотность или основность.
В технологии ионного обмена применяются иониты с диаметром зерен 0,3—2 мм. Коэффициент неоднородности засыпаемой в фильтр фракции ионита не должен превышать 2 аналогично условиям засыпки механических фильтров. Во влажном состоянии иониты набухают и увеличивают свой объем, что следует учитывать при заполнении фильтров. Степень набухания определяется коэффициентом Кн, значение которого зависит от материала ионита, ионной формы, рН и других факторов и составляет 1,05—2.
При эксплуатации иониты подвергаются механическим нагрузкам (сдавливанию, трению), поэтому они частично истираются, повышается концентрация мелких частиц и как следствие этого возрастает гидравлическое сопротивление фильтрующего слоя. Поэтому к ионитам предъявляется требование достаточной механической прочности, которое задается через коэффициент истираемости, определяемый как потеря массы, %/год. Механически прочные иониты должны иметь коэффициент истираемости не более 0,5%/год.
Химическая стойкость ионитов выражается в их способности противостоять растворяющему действию воды и ее примесей. Под действием среды может также происходить пептизация ионитов, т. е. переход их в коллоидный раствор. Химическая стойкость ионитов зависит от рН среды, природы и концентрации растворенных в ней ионов и, что особенно важно, от температуры, с повышением которой стойкость снижается. Это обстоятельство является основным препятствием, не позволяющим повышать температуру на ионообменных фильтрах свыше 313 К.
Обменная емкость является важнейшей технологической характеристикой ионитов. Она выражается количеством ионов, поглощенных единицей массы (г-экв/кг) или единицей объема (г-экв/м3) ионита. Различают полную обменную емкость, емкость «до проскока» и рабочую. Обменная емкость, определенная в момент выравнивания концентрации поглощаемого иона в воде и фильтрате, называется полной. Если фильтрование заканчивается в момент проскока поглощаемого иона (концентрация его в фильтрате близка к нулевой), тр обменная емкость ионита определяется как емкость «до проскока». Однако в эксплуатации фильтрование часто прекращается в момент, когда концентрация определенного/поглощаемого иона в фильтрате составляет некоторое (весьма малое) значение. В этом случае обменная емкость ионита определяется как рабочая, которая чаще всего настолько мало отличается от емкости «до проскока», что их можно принимать равными друг другу. Обменная емкость зависит от многих факторов, в том числе от условий регенерации, ионной формы, природы поглощаемых ионов, значения рН воды, скорости потока воды, геометрических характеристик слоя.
Технология ионного обмена.