Гидрокслирование пролина и лизина. Роль витамина С
Гидроксилирование пролина и лизина начинается в период трансляции коллагеновой мРНК на рибосомах и продолжается на растущей полипептидной цепи вплоть до её отделения от рибосом. После образования тройной спирали дальнейшее гидроксилирование пролиловых и лизиловых остатков прекращается.
Реакции гидроксилирования катализируют ок-сигеназы, связанные с мембранами микросом. Пролиловые и лизиловые остатки в Y-положении пептида (Гли-х-у)n подвергаются действию, соответственно, пролил-4-гидроксилазы и лизил-5-гидроксилазы. Пролил-3-гидроксилаза действует на некоторые остатки пролина в Х-положениях. Необходимыми компонентами этой реакции являются оскетоглутарат, О2 и витамин С (аскорбиновая кислота). Донором атома кислорода, который присоединяется к С-4 пролина, является молекула О2, второй атом О2 включается в сукцинат, который образуется при декарбоксилировании α-кетоглутарата, а из карбоксильной группы а-кетоглутарата образуется СО2 (см. схему А на с. 691).
Гидроксилазы пролина и лизина содержат в активном центре атом железа Fe2+. Для сохранения атома железа в ферроформе необходим восстанавливающий агент. Роль этого агента выполняет кофермент гидроксилаз - аскорбиновая кислота, которая легко окисляется в дегидроаскорбиновую кислоту. Обратное превращение происходит в ферментативном процессе за счёт восстановленного глутатиона (см. схему Б на с. 691).

Рис. 15-1. Синтез и созревание коллагена.

Схема А

Схема Б
Гидроксилирование пролина необходимо для стабилизации тройной спирали коллагена, ОН-группы гидроксипролина (Hyp) участвуют в образовании водородных связей. А гидроксилирование лизина очень важно для последующего образования ковалентных связей между молекулами коллагена при сборке коллагеновых фибрилл. При цинге - заболевании, вызванном недостатком витамина С, нарушается гидроксилирование остатков пролина и лизина. В результате этого образуются менее прочные и стабильные коллагеновые волокна, что приводит к большой хрупкости и ломкости кровеносных сосудов с развитием цинги. Клиническая картина цинги характеризуется возникновением множественных точечных кровоизлияний под кожу и слизистые оболочки, кровоточивостью дёсен, выпадением зубов, анемией.
Гликозилирование гидроксилизина
После завершения гидроксилирования при участии специфических гликозилтрансфераз в состав молекулы проколлагена вводятся углеводные группы. Чаще всего этими углеводами служат галактоза или дисахарид галактозилглюкоза (рис. 15-2).
Они образуют ковалентную О-гликозидную связь с 5-ОН-группой гидроксилизина. Гликозилирование гидроксилизина происходит в коллагене, ещё не претерпевшем спирализации, и завершается после образования тройной спирали. Число углеводных единиц в молекуле коллагена зависит от вида ткани. Так, например, в коллагене сухожилий (тип I) это число равно 6, а в коллагене капсулы хрусталика (тип IV) - НО. Роль этих углеводных групп неясна; известно только, что при наследственном заболевании, причиной которого является дефицит лизилгидроксилазы (синдром Элерса - Данло-Русакова, тип VI), содержание гидроксилизина и углеводов в образующемся коллагене снижено; возможно, это является причиной ухудшения механических свойств кожи и связок у людей с этим заболеванием.
Образование проколлагена и его секреция в
межклеточное пространство
После гидроксилирования и гликозилирования каждая про-α-цепь соединяется водородными связями с двумя другими про-α-цепями, образуя тройную спираль проколлагена. Эти процессы происходят ещё в просвете ЭР и начинаются

Рис. 15-2. Углеводные компоненты коллагена.
после образования межцепочечных дисульфидных мостиков в области С-концевых пропептидов. Из ЭР молекулы проколлагена перемещаются в аппарат Гольджи, включаются в секреторные пузырьки и секретируются в межклеточное пространство.
Образование тропоколлагена. Болезни, связанные с нарушениями этого процесса
В межклеточном матриксе концевые пропептиды коллагенов I, II и III типов отщепляются специфическими проколлагенпептидазами, в результате чего образуются молекулы тропоколлагена, которые и являются структурной единицей коллагеновых фибрилл. При снижении активности этих ферментов (синдром Элерса - Данло - Русакова, тип VII) концевые пропептиды проколлагена не отщепляются, вследствие чего нарушается образование тропоколлагена и далее нарушается образование нормальных коллагеновых фибрилл. Нити коллагена видны под микроскопом в виде дезорганизованных пучков. Клинически это проявляется малым ростом, искривлением позвоночника, привычными вывихами суставов, высокой растяжимостью кожи.
У коллагенов некоторых типов (IV, VIII, X) концевые пропептиды не отщепляются. Это связано с тем, что такие коллагены образуют не фибриллы, а сетеподобные структуры, в формировании которых важную роль играют концевые N- и С-пептиды.
100. Структурная организация межклеточного матрикса. Адгезивные белки межклеточного матрикса: фибронектин и ламинин, их строение и функции. Строение и функции гликозаминогликанов (гиалуроновой кислоты, хондроитинсульфатов, гепарина). Структура протеогликанов.
Как уже говорилось, межклеточный матрикс представляет собой супрамолекулярный комплекс, образованный сложной сетью связанных между собой макромолекул. В организме человека межклеточный матрикс формирует такие высокоспециализированные структуры, как хрящ, сухожилия, базальные мембраны, а также (при вторичном отложении фосфата кальция) кости и зубы.
Эти структуры различаются между собой как по молекулярному составу, так и по способам организации основных компонентов (белков и полисахаридов) в различных формах межклеточного матрикса.
Aдгезивные белки
К первой группе белков с выраженными адгезивными свойствами относят фибронектин, ламинин, нидоген, фибриллярные коллагены и коллаген IV типа; их относят к белкам "зрелой" соединительной ткани.
Фибронектин
Фибронектин - один из ключевых белков межклеточного матрикса, неколлагеновый структурный гликопротеин, синтезируемый и выделяемый в межклеточное пространство многими клетками. Он построен из двух идентичных полипептидных цепей, соединённых дисульфидными мостиками у своих С-концов (рис. 15-19).
Полипептидная цепь фибронектина содержит 7-8 доменов, на каждом из которых расположены специфические центры для связывания разных веществ. Фибронектин может связывать

Рис. 15-19. Строение фибронектина.
коллаген, протеогликаны, гиалуроновую кислоту, углеводы плазматических мембран, гепарин, фермент трансглутаминазу. Благодаря своей структуре фибронектин может выполнять интегрирующую роль в организации межклеточного вещества, а также способствовать адгезии клеток.
Существует несколько форм фибронектина, которые синтезируются разными клетками. Растворимый, или плазменный, фибронектин синтезируется гепатоцитами. Нерастворимый, или тканевый фибронектин синтезируется в основном фибробластами или эндотелиоцитами, глиоцитами и эпителиальными клетками.
Обе формы фибронектина вовлекаются в разнообразные процессы: способствуют адгезии и распространению эпителиальных и мезенхимальных клеток, стимулируют пролиферацию и миграцию эмбриональных и опухолевых клеток, контролируют дифференцировку и поддержание цитоскелета клеток, активно участвуют в воспалительных и репаративных процессах. Это связано с тем, что каждая субъединица фибронектина содержит последовательность Арг-Гли-Асп (RGD), с помощью которой он может присоединяться к клеточным рецепторам (интегринам). Эти рецепторы опосредованно взаимодействуют с актиновыми микрофиламентами, которые находятся в цитозоле. В этом процессе участвуют так называемые белки прикрепления (от англ. attach - прикреплять proteins): талин, винкулин, α-актинин (рис. 15-20).
С помощью таких белок-белковых взаимодействий информация может передаваться из межклеточного
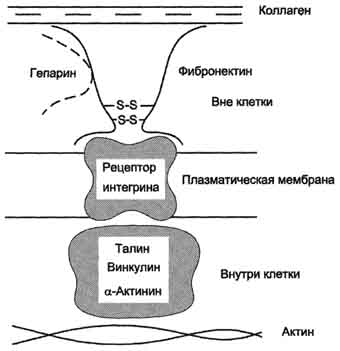
Рис. 15-20. Схема взаимодействия фибронектина с интегрином.
матрикса внутрь клетки, а также в обратном направлении - из клетки наружу, таким образом влияя на протекающие в клетке процессы.
Известно также, что фибронектин участвует в миграции клеток, которые могут присоединяться к его RGD-участкам, и, таким образом, фибронектин как бы помогает им перемещаться в межклеточном матриксе.
В межклеточном матриксе, окружающем трансформированные (или опухолевые) клетки, количество фибронектина заметно снижено, что может быть одной из причин появления метастазов.
Ламинин - наиболее распространённый некол-лагеновый гликопротеин базальных мембран. Он состоит из трёх полипетидных цепей: А, В1 и В2. Молекула ламинина имеет крестообразную форму с тремя одноцепочечными ветвями и одной трёхцепочечной ветвью (рис. 15-21). Каждая цепь ламинина содержит несколько глобулярных и стержневидных доменов, на которых имеются специфические центры связывания для различных веществ. Ламинин взаимодействует со всеми структурными компонентами базальных мембран, включая коллаген IV типа, нидоген, фибронектин, ГСПГ. Кроме того, молекула ламинина имеет несколько центров связывания с клетками. Главные функции ламинина определяются его способностью связывать клетки и модулировать клеточное поведение. Он может влиять на рост, морфологию, дифференцировку и подвижность клеток.
Ламинин выполняет роль адгезивного белка для различных эпителиальных и мезенхимальных клеток.
Гликозаминогликаны - линейные отрицательно заряженные гетерополисахариды. РаНbше их называли мукополисахаридами, так как они обнаруживались в слизистых секретах (мукоза) и придавали этим секретам вязкие, смазочные свойства. Эти свойства обусловлены тем, что гликозаминогликаны могут связывать большие количества воды, в результате чего межклеточное вещество приобретает желеобразный характер.
Протеогликаны - высокомолекулярные соединения, состоящие из белка (5-10%) и гликозаминогликанов (90-95%). Они образуют основное вещество межклеточного матрикса соединительной ткани и могут составлять до 30% сухой массы ткани.
Белки в протеогликанах представлены одной полипептидной цепью разной молекулярной массы. Полисахаридные компоненты у разных протеогликанов разные. Протеогликаны отличаются от большой группы белков, которые называют гликопротеинами. Эти белки тоже содержат олигосахаридные цепи разной длины, ковалентно

Рис. 15-13. Разрушение лёгочных альвеол эластазой нейтрофилов.
присоединённые к полипептидной основе. Углеводный компонент гликопротеинов гораздо меньше по массе, чем у протеогликанов, и составляет не более 40% от общей массы. Гликопротеины выполняют в организме человека разные функции и присутствуют во всех классах белков - ферментах, гормонах, транспортных, структурных белках и др. Представители гликопротеинов - коллаген и эластин, иммуноглобулины, ангиотензиноген, трансферрин, церулоплазмин, внутренний фактор Касла, тиреотропный гормон.
Гликозаминогликаны и протеогликаны, являясь обязательными компонентами межклеточного матрикса, играют важную роль в межклеточных взаимодействиях, формировании и поддержании формы клеток и органов, образовании каркаса при формировании тканей.
Благодаря особенностям своей структуры и физико-химическим свойствам, протеогликаны и гликозаминогликаны могут выполнять в организме человека следующие функции:
- они являются структурными компонентами межклеточного матрикса;
- протеогликаны и гликозаминогликаны специфически взаимодействуют с коллагеном, эластином, фибронектином, ламинином и другими белками межклеточного матрикса;
- все протеогликаны и гликозаминогликаны, являясь полианионами, могут присоединять, кроме воды, большие количества катионов (Na+, K+, Са2+) и таким образом участвовать в формировании тургора различных тканей;
- протеогликаны и гликозаминогликаны играют роль молекулярного сита в межклеточном матриксе, они препятствуют распространению патогенных микроорганизмов;
- гиалуроновая кислота и протеогликаны выполняют рессорную функцию в суставных хрящах;
- гепарансульфатсодержащие протеогликаны способствуют созданию фильтрационного барьера в почках;
- кератансульфаты и дерматансульфаты обеспечивают прозрачность роговицы;
- гепарин - антикоагулянт;
- гепарансульфаты - компоненты плазматических мембран клеток, где они могут функционировать как рецепторы и участвовать в клеточной адгезии и межклеточных взаимодействиях. Они также выступают компонентами синаптических и других пузырьков.













