Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату. Следует отметить, что таких ферментов в живых организмах мало.
Пример фермента с абсолютной субстратной специфичностью - аргиназа, катализирующая реакцию расщепления аргинина до мочевины и орнитина:

Групповая субстратная специфичность
Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов.
Так, фермент панкреатическая липаза катализирует гидролиз жиров в двенадцатиперстной кишке человека, катализируя превращение любой молекулы жира (триацилглицерола) до молекулы моноацилглицерола и двух молекул высших жирных кислот. Панкреатическая липаза гидролизует эфирную связь у α-атомов углерода глицерола, независимо от того, какие жирные кислоты входят в состав молекулы жира.
Большинство протеолитических ферментов, осуществляющих гидролиз белков, имеет групповую субстратную специфичность, гидролизуя пептидные связи, образованные разными аминокислотами.
Стереоспецифичность
При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность

Каталитическая специфичность
Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения, Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата. Так, молекула глюкозо-6-фосфата в клетках печени человека - субстрат 4 различных ферментов; фос-фоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы. Однако из-за особенностей строения каталитических участков этих ферментов происходит различное превращение этого соединения с образованием 4 различных продуктов.
13. Классификация и номенклатура ферментов, примеры
Каждый фермент имеет 2 названия. Первое - короткое, так называемое рабочее, удобное для повседневного использования. Второе (более полное) - систематическое, применяемое для однозначной идентификации фермента.
А. Рабочее название
В названии большинства ферментов содержится суффикс "аза", присоединённый к названию субстрата реакции, например уреаза, сахараза, липаза, нуклеаза или к названию химического превращения определённого субстрата, например лактатдегидрогеназа, аденилатциклаза, фосфо-глюкомутаза, пируваткарбоксилаза. Согласно российской классификации ферментов (КФ), названия ферментов пишутся слитно. Однако в употреблении сохранился ряд тривиальных, исторически закреплённых названий ферментов, которые не дают представления ни о субстрате, ни о типе химического превращения, например трипсин, пепсин, ренин, тромбин.
Б. Классы ферментов
1. Оксидоредукпшзы
Катализируют различные окислительно-восстановительные реакции с участием 2 субстратов (перенос е- или атомов водорода с одного субстрата на другой).
Систематическое наименование ферментов составляют по формуле "донор: акцептороксидоредуктаза", рабочее - субстрат-подкласс оксидоредуктаз.
Дегидрогеназы. В этот подкласс входят ферменты, катализирующие реакции дегидрирования (отщепления водорода). В качестве акцепторов электронов используются коферменты NAD+, NADP+, FAD, FMN (см. ниже). Все ферменты этой группы обладают высокой субстратной специфичностью. Пример реакции:
Оксидазы. Акцептором электрона служит молекулярный кислород. Пример реакции, катализируемой цитохромоксидазой:

Оксигеназы (гидроксилазы) -атом кислорода из молекулы кислорода присоединяется к субстрату. Пример реакции:

Трансферты
Катализируют перенос функциональных групп от одного соединения к другому. Подразделяют в зависимости от переносимой группы.
Название этих ферментов составляют по формуле "донор: ацетрофэкспортируемая группатрансфераза". К классу трансфераз относят аминотрансферазы, ацилтрансферазы, метилтранс-феразы, гликозилтрансферазы, киназы (фосфо-трансферазы). Примеры реакций
Гидролазы
Катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Подразделяют в зависимости от расщепляемой связи.
Наименование ферментов составляют по формуле "субстрат-гидролаза" или прямым присоединением к названию субстрата суффикса "аза", например протеаза, липаза, фосфолипаза, рибо-нуклеаза. Пример реакции (см. схему Б).
Для отдельных классов гидролаз применимы специальные термины, характеризующие гидролиз определённой химической связи: эстеразы, фосфатазы и др.
Лиазы
К лиазам относят ферменты, отщепляющие от субстратов негидролитическим путём определённую группу (при этом могут отщепляться СО2, Н2О, NH2,SН2и др.) или присоединяющие чаще всего молекулу воды по двойной связи.
Наименование ферментов составляют по формуле "субстрат-отщепляемая или присоединяемая группировка". Примеры реакций.
5. Изомеразы
Катализируют различные внутримолекулярные превращения. Подразделяют в зависимости от типа реакции изомеризации.
Как общее название ферментов этого класса применяют термин "изомеразы"
Изомеразы могут катализировать внутримолекулярные окислительно-восстановительные реакции, осуществляя взаимопревращения альдоз и кетоз, кетонных и енольных групп, перемещения двойных связей внутри молекулы.
Когда изомеризация состоит во внутримолекулярном переносе группы, фермент называют "мутазой»
Лигазы (синтетазы)
Катализируют реакции присоединения друг к другу двух молекул с образованием ковалент-ной связи. Этот процесс сопряжён с разрывом фосфоэфирной связи в молекуле АТФ (или других нуклеозидтрифосфатов) или с разрывом макроэргических связей других соединений. В первом случае (при использовании энергии гидролиза АТФ) такие ферменты называют ли-газами, или синтетазами (см. схему Г).
В случае, когда источником энергии служит любое другое макроэргическое соединение (не АТФ), ферменты называют синтазами.
В. Систематическое название
В соответствии с классификацией каждый фермент получил систематическое название, однозначно характеризующее катализируемую им химическую реакцию. Например, D-глицеральдегид-3-фосфат: NAD-оксидоредуктаза (рабочее название - глицеральдегидфосфат дегидрогеназа). Из названия фермента следует, что субстратом этого фермента служит D-глицеральдегид-3-фосфат, тип катализируемой реакции - окислительно-восстановительная в присутствии кофермента NAD+.
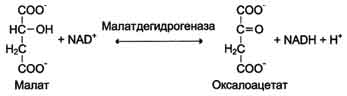
В 1972 г. комиссией по номенклатуре биохимических соединений Международного союза теоретической и прикладной химии были предложены "Правила номенклатуры ферментов", имеющие кодовое четырёхзначное цифровое обозначение, где первая цифра обозначает класс фермента, вторая цифра (подкласс) уточняет преобразуемую группировку, третья (подподкласс) - уточняет дополнительных участников реакции (например, донора и акцептора) и четвёртая - порядковый номер фермента в данной подгруппе. Так, фермент малатдегидрогеназа имеет систематическое название L-малат: NAD-оксидоредуктаза и кодовый шифр 1.1.1.38. Шифр означает, что этот фермент относят к первому классу ферментов - оксидоредуктаз, окисляемая группа - гидроксильная группировка (1) в присутствии кофермента NAD+ (1) и порядковый номер фермента в этой подгруппе - 38. Кодовую номенклатуру ферментов в основном используют в научной литературе.
Строение ферментов. Каталитический и регуляторный центры. Взаимодействие ферментов с лигандами. Механизм действия ферментов. Формирование фермент-субстратного комплекса. Гипотеза «ключ-замок» и гипотеза индуцированного соответствия.
Все ферменты это белки с молекулярной массой от 15 000 до нескольких млн Да. По химическому строению различают простые ферменты (состоят только из АК) и сложные ферменты (имеют небелковую часть или простетическую группу). Белковая часть носит название – апофермент, а небелковая, если она связана ковалентно с апоферментом, то называется кофермент, а если связь нековалентная (ионная, водородная) – кофактор. Функции простетической группы следующие: участие в акте катализа, осуществление контакта между ферментом и субстратом, стабилизация молекулы фермента в пространстве.
 В роли кофактора обычно выступают неорганические вещества - ионы цинка, меди, калия, магния, кальция, железа, молибдена.
В роли кофактора обычно выступают неорганические вещества - ионы цинка, меди, калия, магния, кальция, железа, молибдена.
Коферменты можно рассматривать как составную часть молекулы фермента. Это органические вещества, среди которых различают: нуклеотиды (АТФ, УМФ, и пр), витамины или их производные (ТДФ – из тиамина (В1), ФМН – из рибофлавина (В2), коэнзим А – из пантотеновой кислоты (В3), НАД и пр) и тетрапиррольные коферменты – гемы.
В процессе катализа реакции в контакт с субстратом вступает не вся молекула фермента, а определенный ее участок, который называется активным центром. Эта зона молекулы не состоит из последовательности аминокислот, а формируется при скручивании белковой молекулы в третичную структуру. Отдельные участки аминокислот сближаются между собой, образуя определенную конфигурацию активного центра. Важная особенность строения активного центра - его поверхность комплементарна поверхности субстрата, т.е. остатки АК этой зоны фермента способны вступать в химическое взаимодействие с определенными группами субстрата. Можно представить, что активный центр фермента совпадает со структурой субстрата как ключ и замок.
В активном центре различают две зоны: центр связывания, ответственный за присоединение субстрата, и каталитический центр, отвечающий за химическое превращение субстрата. В состав каталитического центра большинства ферментов входят такие АК, как Сер, Цис, Гис, Тир, Лиз. Сложные ферменты в каталитическом центре имеют кофактор или кофермент.
Помимо активного центра ряд ферментов снабжен регуляторным (аллостерическим) центром. С этой зоной фермента взаимодействуют вещества, влияющие на его каталитическую активность.
Ферменты обладают высокой специфичностью, поэтому выдвинули гипотезу, согласно которой активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт. Активный центр при этом рассматривался как стабильная, жёстко детерминированная структура.
В 1959 г. был предложен другой вариант гипотезы "ключ-замок", объясняющий события в активном центре фермента. По этой гипотезе активный центр является гибкой структурой по отношению к субстрату. Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции. Эта "гипотеза индуцированного соответствия" впоследствии получила экспериментальное подтверждение.
15. Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от температуры, рН среды, концентрации ферментов и субстрата. Уравнение Михаэлиса-Ментен, Кm.
Кинетика ферментативных реакций - раздел энзимологии, изучающий зависимость скорости химических реакций, катализируемых ферментами, от химической природы реагирующих веществ, а также от факторов окружающей среды.
Для измерения каталитической активности ферментов используют такие показатели, как скорость реакции или активность фермента. Скорость ферментативной реакции определяется изменением количества молекул субстрата или продукта за единицу времени. Скорость ферментативной реакции - мера каталитической активности фермента, её обозначают как активность фермента.
Математически скорость ферментативной реакции выражается в изменении концентрации субстрата (уменьшение) или продукта (увеличение) за единицу времени:
V= D[S]/t = D[P]/t.
На начальном этапе [0 - t0] скорость реакции прямо пропорциональна времени и имеет линейную зависимость. Графически изменение скорости ферментативной реакции определяется тангенсом угла наклона касательной к кривой профиля реакции. Чем больше угол наклона, тем больше изменение скорости реакции.
С течением времени изменение скорости ферментативной реакции в экспериментальных условиях уменьшается, об этом свидетельствует уменьшение угла наклона касательной в момент времени t. Снижение скорости ферментативной реакции может происходить за счёт ряда факторов: уменьшения концентрации субстрата, увеличения концентрации продукта, который может оказывать ингибирующее действие, могут происходить изменения рН раствора, инактивация фермента и т.д.
На этапе [t1 - tx] скорость реакции изменяется нелинейно в зависимости от времени. Поэтому для определения скорости ферментативной реакции чаще всего исследуют изменение скорости на начальном этапе [t0 - t1], где наблюдают линейное изменение концентрации продукта (или субстрата).
Скорость ферментативной реакции зависит от ряда факторов, таких как количество и активность ферментов, концентрация субстрата, температура среды, рН раствора, присутствие регуляторных молекул (активаторов и ингибиторов). Рассмотрим влияние этих факторов на скорость ферментативной реакции.








 В роли кофактора обычно выступают неорганические вещества - ионы цинка, меди, калия, магния, кальция, железа, молибдена.
В роли кофактора обычно выступают неорганические вещества - ионы цинка, меди, калия, магния, кальция, железа, молибдена.


