Электронные движения и электронные состояния двухатомной молекулы могут быть корректно рассмотрены в рамках квантово-механического представления.
Рассмотрим основные закономерности. Так как у двухатомной молекулы аксиальная симметрия, то при анализе состояний молекулы большое значение имеют операции симметрии относительно этой оси. Каждое состояние электронной оболочки молекулы характеризуется полным орбитальным моментом L и спиновым моментом движения S. Но состояние двухатомной молекулы обозначается не по значению квантового числа, а по значению проекции орбитального квантового момента L на ось симметрии молекулы. Проекция орбитального момента 𝛬 на ось симметрии.




Каждое электронное состояние характеризуется спиновым квантовым числом, которое определяет статистический вес этого состояния. То есть число возможных подуровней, на которое может расщепиться состояние во внешнем поле. Статистический вес указывается слева вверху по отношению символу состояния:


Электронное состояние 2-ух атомной молекулы различают по свойствам симметрии. В основе этой классификации лежит поведение волновой функции молекулы в данном состоянии при операциях симметрии. Для операции отражения в плоскости симметрии, проходящий через ось молекулы, состояния могут быть либо отрицательные (если знак волновой функции меняется), либо положительными (если знак волновой функции не меняет знака при операциях симметрии). И этот индекс записывается около символа состояния справа вверху  .
.
Если молекула состоит из одинаковых атомов, то она обладает центром симметрии. По отношению к операции отражения в центре симметрии электронные состояния таких молекул разделяются на чётные и нечётные. Чётные обозначаются индексом g, а нечётные – индексом u, и записываются в правом нижнем углу  .
.
Квантово-механическая теория приводит к следующим правилам отбора для радиационным переходов в молекулах:




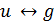


Так как при любых электронных переходах происходит изменение свойств электронной оболочки, то меняется вид кривой потенциальной энергии молекулы. Вид функции потенциальной энергии молекулы зависит от взаимного расположения ядер в молекулы и от сил взаимодействия между ядрами и электронами. Между двумя частицами действует два вида сил: притяжение и отталкивание. Если в результате сложения энергии притяжения и отталкивания получится положительная энергия, то химическая связь не образуется, и система взаимодействующих атомов будет неустойчива.

Если в результате такого сложения получится кривая, имеющая отрицательные значения, то говорят о возникновении химической связи между атомами и об устойчивости системы:

Основные параметры кривой потенциальной энергии: 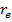 – равновесное межъядерное расстояние, D – энергия диссоциации молекулы.
– равновесное межъядерное расстояние, D – энергия диссоциации молекулы.
При переходе молекулы из основного состояния в возбуждённое меняются параметры кривой потенциальной энергии.
1. Изменяется энергии диссоциации.
2. Меняется равновесное межъядерное расстояние.
3. Возбуждённое состояние молекулы является неустойчивым.

Радиационные переходы между основным и первым возбуждённым состояниями молекулы водорода запрещены по мультиплетности. Такие переходы запрещены между основным и вторым возбуждённым состояниями. Но перевести молекулу в возбуждённое состояние можно за счёт безизлучательных переходов. Так в газоразрядной лампе при подаче разности потенциалов между анодом и катодом электроны ускоряются, сталкиваются с молекулой водорода, и при ударе переходят в возбуждённое состояние.

После этого молекула переходит в первое возбуждённое состояние с испусканием фотона.
 - этот переход разрешён.
- этот переход разрешён.
Так как при диссоциации кинетическая энергия продуктов разложения может быть различна, то частоты радиационных переходов квантуются. Следовательно, возникает излучение со сплошным спектром. После рекомбинации молекула снова оказывается в основном состоянии, и цикл повторяется.
Вывод: каждому электронному состоянию двухатомной молекулы отвечает своя кривая потенциальной энергии, которая характеризуется параметрами D и 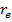 . Каждое устойчивое электронное состояние обладает своей системой количественных и временных подуровней, при переходах между которыми образуется сложный электронно-колебательный временной спектр. Характер спектра (положение полос, их интенсивность и контур) определяется формой и взаимным расположением потенциальных кривых комбинирующих электронных состояний.
. Каждое устойчивое электронное состояние обладает своей системой количественных и временных подуровней, при переходах между которыми образуется сложный электронно-колебательный временной спектр. Характер спектра (положение полос, их интенсивность и контур) определяется формой и взаимным расположением потенциальных кривых комбинирующих электронных состояний.









 .
. .
.



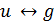




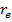 – равновесное межъядерное расстояние, D – энергия диссоциации молекулы.
– равновесное межъядерное расстояние, D – энергия диссоциации молекулы.

 - этот переход разрешён.
- этот переход разрешён.


