Следовательно, момент импульса тела относительно оси вращения равен произведению момента инерции тела относительно той же оси на угловую скорость вращения тела вокруг этой оси.
м 2· кг / с
Дайте определение внутренней энергии системы с точки зрения термодинамики.
Внутренняя энергия U макросистемы – величина, состоящая из:
1) суммарной кинетической энергии хаотического движения молекул в Ц-системе, связанной с самой системой (в этой системе отсчета суммарный импульс всех молекул равен 0, и система как целое покоится);
2) собственной потенциальной энергии взаимодействия всех молекул, т.е. энергии взаимодействия только между молекулами, принадлежащими данной системе;
3) внутренней энергии самих молекул, атомов, ядер,...
это функция состояния.
47. Сформулируйте первое начало термодинамики.
Q = ∆U + A.
Количество теплоты Q, сообщенное макросистеме, идет на изменение ∆U ее внутренней энергии и на совершение системой работы А над внешними телами.
Все эти алгебраические величины могут быть и положительными и отрицательным.
A и Q функции процесса (не состояния).
48. Сформулируйте первое начало термодинамики в дифференциальной форме.
δQ=dU+δA
dU – приращение внутренней энергии.
δQ, δА – элементарные значения теплоты и работы.
49. Почему невозможен вечный двигатель первого рода?
Вечный двигатель первого рода — устройство, способное бесконечно совершать работу без затрат топлива или других энергетических ресурсов. Согласно закону сохранения энергии, все попытки создать такой двигатель обречены на провал. Невозможность осуществления вечного двигателя первого рода постулируется в термодинамике как первое начало термодинамики.
-----------------------------------------------
(Первое начало представляет собой по сути обобщенный закон сохранения энергии на тепловые процессы
Изменение внутренней энергии макросистемы при ее переходе из одного состояния в другое равно сумме совершенной над системой работы A’ всех внешних макроскопических сил и количества переданного системе тепло Q, и не зависит от способа, которым осуществляется этот переход:
∆U = Q + A’
Обычно рассматривают не работу A’ над системой, а работу A, произведенную самой системой над внешними телами. A’ = -A, перепишем в виде:
Q = ∆U + A.)
/*
Вечный двигатель второго рода — машина, которая, будучи пущена в ход, превращала бы в работу всё тепло, извлекаемое из окружающих тел. Невозможность осуществления вечного двигателя второго рода постулируется в термодинамике в качестве одной из эквивалентных формулировок второго начала термодинамики. В частности, второе начало термодинамики может быть сформулировано как один из следующих (эквивалентных) постулатов:
1. Постулат Кельвина-Планка — невозможно создать периодически действующую машину, совершающую механическую работу только за счёт охлаждения теплового резервуара.
2. Постулат Клаузиуса — самопроизвольный переход теплоты от более холодных тел к более горячим невозможен.
*/
------------------------------------------------------------------
50. Что такое адиабатный процесс. Как связаны друг с другом в таком процессе работа термодинамической системы и её внутренняя энергия?
Адиабатический процесс – это процесс, который присходит без теплообмена с окружающей средой.
δQ = 0, следовательно, газ при расширении совершает работу за счет уменьшения его внутренней энергии, следовательно, газ охлаждается, δA = -dU. Кривая, изображающая адиабатный процесс, называется адиабатой.
Уравнение Пуассна  ;
; 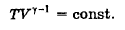
51. Как связаны друг с другом элементарное изменение внутренней энергии и изменение температуры в изохорном процессе?
Изохорный процесс – термодинамический процесс, который происходит при постоянном объеме.
(Cv = δQ/dT, δQ = dU + δA, δA = 0, =>)
 dU = CvdT
dU = CvdT

Раздел №2: Внутренняя энергия идеального газа в равновесии. Равновесные политропические процессы.
М2.2.2.01.Равнораспределение энергии по степеням свободы.
Число степеней свободы молекулы – это число независимых координат, полностью определяющих положение молекулы в системе.
52. Что такое поступательные степени свободы молекулы?
Поступательные степени свободы связаны с движением молекулы как целого в пространстве.
для определения положения центра масс молекулы необходимо задать три координаты. Это означает, что молекула имеет три поступательные степени свободы.
53. Что такое вращательные степени свободы молекулы?
Это степени свободы молекулы, связанные с углами поворота вокруг осей.
54. Что такое колебательные степени свободы молекулы?
Степень свободы, определяющаяся расстоянием между атомами.
55. Как распределена энергия по степеням свободы молекул идеального газа в равновесном состоянии?

56. Сколько степеней свободы имеет одноатомная молекула? Какие это степени свободы?
3 степени свободы поступательного движения.
57. Сколько степеней свободы имеет двухатомная «жесткая» молекула? Какие это степени свободы?
Жесткой связью называется связь, при которой расстояние между атомами не изменяется.
5 степеней свободы, 3 поступательного движения и 2 вращательного.
58. Сколько степеней свободы имеет двухатомная «мягкая» молекула? Какие это степени свободы?
Мягкой (упругой) связью называется связь, при которой расстояние между атомами изменяется.
6 степеней свободы: 3 поступательного движения, 2 вращательного, и 1 колебательного.
59. Сколько степеней свободы имеет трёхатомная (многоатомная) «жесткая» молекула? Какие это степени свободы?
N – атомов в молекуле.

60. Как связаны друг с другом средняя кинетическая энергия поступательного движения молекул идеального газа в равновесном состоянии и температура газа?
 приходится на одну степень свободы
приходится на одну степень свободы
( т.к. 3 поступательные степени свободы)
т.к. 3 поступательные степени свободы)
61. Как связаны друг с другом средняя кинетическая энергия вращательного движения молекул идеального газа в равновесном состоянии и температура газа?
 приходится на одну степень свободы
приходится на одну степень свободы
62. Как связаны друг с другом средняя кинетическая энергия колебательного движения молекул идеального газа в равновесном состоянии и температура газа?
 приходится на одну степень свободы
приходится на одну степень свободы
63. Как связаны друг с другом средняя потенциальная энергия колебательного движения молекул идеального газа в равновесном состоянии и температура газа?
 приходится на одну степень свободы
приходится на одну степень свободы
---------------------------------------------------------------

64. Что такое «замораживание» степеней свободы?
Колебательная и вращательная энергии квантованы (изменяются скачками – квантами), поступательная – нет.
Когда средняя энергия поступательного (поступательного и вращательного) движения молекулы меньше минимальной вращательной (колебательной) энергии. Т.е. ее оказывается недостаточно, чтобы возбудить вращательные (колебательные) степени свободы. В этих условиях говорят, что вращательные (колебательные) степени свободы заморожены.
М2.2.2.02. Внутренняя энергия идеального газа. Теплоёмкость газа.
65. Дайте определение внутренней энергии идеального газа с точки зрения молекулярной физики?
С точки зрения молекулярно-кинетической теории внутренняя энергия макроскопического тела равна сумме кинетических энергий хаотического движения всех молекул (или атомов) относительно центра масс тела и потенциальных энергий взаимодействия всех молекул друг с другом (но не с молекулами других тел).
Так как молекулы идеального газа не взаимодействуют друг с другом, за исключением коротких интервалов времени, когда они сталкиваются, их потенциальная энергия считается равной нулю. Вся внутренняя энергия идеального газа представляет собой кинетическую энергию теплового движения его молекул.
ВЭ - характеристика теплового состояния тела

66. Как зависит энергия идеального газа от объёма?
От объема внутренняя энергия идеального газа не зависит потому, что потенциальная энергия взаимодействия его молекул считается равной нулю.
-----------------------------------------------
(У реальных газов, жидкостей и твердых тел средняя потенциальная энергия взаимодействия молекул не равна нулю. Правда, для газов она много меньше средней кинетической энергии, но для твердых и жидких тел сравнима с кинетической. Средняя потенциальная энергия взаимодействия молекул зависит от объема вещества, так как при изменении объема меняется среднее расстояние между молекулами. Следовательно, внутренняя энергия в общем случае наряду с температурой T зависит еще и от объема V.)
----------------------------------------
67. Как связаны друг с другом внутренняя энергия идеального газа и средняя энергия его молекул?


В теории идеального газа потенциальная энергия взаимодействия молекул считается нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией движения всех его молекул.
68. По какой формуле вычисляется внутренней энергии идеального газа при заданной температуре?


69. Как связаны друг с другом молярная изохорная теплоемкость идеального газа и количество степеней свободы его молекулы?
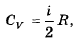 ,
, 
70. Как связаны друг с другом изохорная и изобарная теплоемкости идеального газа? Уравнение Майера.

71. Как связаны друг с другом молярная изобарная теплоемкость идеального газа и количество степеней свободы его молекулы?

М2.2.2.03. Обратимый политропические процессы.
72. Что такое показатель адиабаты идеального газа? Как он выражается через количество степеней свободы молекулы?
Показатель адиабаты (коэффициент Пуассона) – отношение теплоёмкости при постоянном давлении к теплоёмкости при постоянном объёме (γ или к).
 при i – количество степеней свободы.
при i – количество степеней свободы.

73. Напишите уравнение обратимого адиабатного процесса в p-V, V-T и p-T координатах.


 =const.
=const.
74. Изобразите график обратимого адиабатного процесса на p-V, V-T и p-T диаграммах.
 (жмется к V быстрее)
(жмется к V быстрее)
// Не смогла найти остальные графики, пришлось что-то делать самой, но вообще не уверена
V=(const/T)^(1/(k-1)) ~ 1/x гипербола  (жмется к V быстрее)
(жмется к V быстрее)
P=(const/T^k)^(1/1-k) = (T^k/const)^(1/k-1) ~х^(к/(к-1)) 
75. Какой процесс называется политропическим? Напишите уравнение такого процесса.
Политропический процесс – термодинамический процесс, при котором теплоёмкость системы остаётся неизменной. 
 где n – показатель политропы (может быть >, <, = нулю)
где n – показатель политропы (может быть >, <, = нулю)
76. Что такое показатель политропы идеального газа? Как он выражается через теплоёмкость?
 где n – показатель политропы (может быть >, <, = нулю)
где n – показатель политропы (может быть >, <, = нулю)
 Здесь С{\displaystyle c}С — теплоёмкость газа в данном процессе, Ср{\displaystyle c_{p}} и Сv — теплоёмкости того же газа, соответственно, при постоянном давлении и объеме.
Здесь С{\displaystyle c}С — теплоёмкость газа в данном процессе, Ср{\displaystyle c_{p}} и Сv — теплоёмкости того же газа, соответственно, при постоянном давлении и объеме.
77. Чему равна работа газа при политропическом процессе?



Тема №3: Статистические распределения молекул. Второе начало термодинамики. Тепловые машины
Раздел №1: Статистические распределения молекул.
М2.3.1.01. Общие понятия из теории вероятности.
78. Что такое вероятность значения дискретной случайной величины?


79. Что такое функция распределения случайной величины?
Рассмотрим случай, когда случайная величина х имеет непрерывный характер (например, скорость молекул).

80. Как рассчитать с помощью функции распределения вероятность попадания случайной
величины в заданный интервал значений?

81. Что такое условие нормировки функции распределения?


82. Как рассчитать с помощью функции распределения среднее значение случайной величины?

83. Как рассчитать с помощью функции распределения среднее значение какой-либо функции случайной величины?

М2.3.1.02. Функции распределения по скоростям молекул равновесного идеального газа.
84. Какой вид имеет функция распределения молекул по модулю скорости? Функция
распределения Максвелла.


 - закон распределения Максвелла по модулю скорости
- закон распределения Максвелла по модулю скорости

 - распределение по проекции скорости (на другие оси аналогично)
- распределение по проекции скорости (на другие оси аналогично)
 - распределение по вектору скорости
- распределение по вектору скорости
85. Что такое наиболее вероятная скорость молекул? Как она зависит от молярной массы газа и температуры?
Наиболее вероятная скорость – это скорость, вблизи которой на единичный интервал скоростей приходится наибольшее число молекул.

86. Что такое средняя арифметическая скорость молекул? Как она зависит от молярной массы газа и температуры?
Средняя арифметическая скорость – усреднённое значение модулей скорости всех молекул.

87. Что такое средняя квадратичная скорость молекул? Как она зависит от молярной массы газа и температуры?
Средняя квадратичная скорость – среднее квадратичное значение модулей скоростей всех молекул.





 ;
; 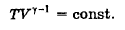
 dU = CvdT
dU = CvdT


 приходится на одну степень свободы
приходится на одну степень свободы т.к. 3 поступательные степени свободы)
т.к. 3 поступательные степени свободы)





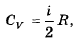 ,
, 


 при i – количество степеней свободы.
при i – количество степеней свободы.


 =const.
=const. (жмется к V быстрее)
(жмется к V быстрее) (жмется к V быстрее)
(жмется к V быстрее)

 где n – показатель политропы (может быть >, <, = нулю)
где n – показатель политропы (может быть >, <, = нулю) Здесь С{\displaystyle c}С — теплоёмкость газа в данном процессе, Ср{\displaystyle c_{p}} и Сv — теплоёмкости того же газа, соответственно, при постоянном давлении и объеме.
Здесь С{\displaystyle c}С — теплоёмкость газа в данном процессе, Ср{\displaystyle c_{p}} и Сv — теплоёмкости того же газа, соответственно, при постоянном давлении и объеме.











 - закон распределения Максвелла по модулю скорости
- закон распределения Максвелла по модулю скорости
 - распределение по проекции скорости (на другие оси аналогично)
- распределение по проекции скорости (на другие оси аналогично) - распределение по вектору скорости
- распределение по вектору скорости





