В жидком состоянии вещество может существовать в определённом интервале температур. При температуре, меньшей нижнего значения этого интервала, жидкость превращается в твёрдое вещество. А если значение температуры превысит верхнюю границу интервала, жидкость переходит в газообразное состояние.
Процесс превращения вещества в пар называют парообразованием. Обратный процесс перехода из пара в жидкость - конденсация.
Парообразование происходит в двух случаях: при испарении и при кипении.
Испарением называют фазовый процесс перехода вещества из жидкого состояния в газообразное или парообразное, происходящий на поверхности жидкости.
Как и при плавлении, при испарении веществом поглощается теплота. Она затрачивается на преодоление сил сцепления частиц (молекул или атомов) жидкости. Кинетическая энергия молекул, обладающих самой высокой скоростью, превышает их потенциальную энергию взаимодействия с другими молекулами жидкости. Благодаря этому они преодолевают притяжение соседних частиц и вылетают с поверхности жидкости. Средняя энергия оставшихся частиц становится меньше, и жидкость постепенно остывает, если её не подогревать извне.
Так как частицы находятся в движении при любой температуре, то и испарение также происходит при любой температуре. Мы знаем, что лужи после дождя высыхают даже в холодную погоду.
Но скорость испарения зависит от многих факторов. Один из важнейших - температура вещества. Чем она выше, тем больше скорость движения частиц и их энергия, и тем большее их количество покидает жидкость в единицу времени.
Испарение происходит и в твёрдых телах. Мы видим, как постепенно высыхает на морозе замёрзшее, покрытое льдом бельё. Лёд превращается в пар. Мы ощущаем резкий запах, образующийся при испарении твёрдого вещества нафталина.
Некоторые вещества вообще не имеют жидкой фазы. К примеру, элементарный иод I2 - простое вещество, представляющее собой кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, при нормальных условиях сразу же превращается в газообразный иод - фиолетовые пары с резким запахом. Тот жидкий йод, который мы покупаем в аптеках, - это не жидкое его состояние, а раствор йода в спирте.
Процесс перехода твёрдых тел в газообразное состояние, минуя жидкую стадию, называют сублимацией, или возгонкой.
Кипение - это тоже процесс перехода жидкости в пар. Но парообразование при кипении происходит не только на поверхности жидкости, но и по всему её объёму. Причём процесс этот проходит гораздо интенсивнее, чем при испарении.
Испарение происходит при любой температуре, а кипение - только при определённой температуре, которая называется температурой кипения.
Каждое вещество имеет свою температуру кипения. Она зависит от величины давления. При нормальном атмосферном давлении вода закипает при температуре 100оС, спирт - при 78 оС, железо - при 2750 оС. А температура кипения кислорода - минус 183 оС.
При уменьшении давления температура кипения снижается. В горах, где атмосферное давление ниже, вода закипает при температуре менее 100 оС. И чем выше над уровнем моря, тем меньшей будет температура кипения. А в кастрюле-скороварке, где создаётся повышенное давление, вода закипает при температуре выше 100 оС.
Если вещество может одновременно существовать в жидкой (или твёрдой) фазе и газообразной, то его газообразное состояние называют паром. Пар образуют молекулы, вылетевшие при испарении из жидкости или твёрдого вещества.
Нальём жидкость в сосуд и плотно закроем его крышкой. Через некоторое время количество жидкости уменьшится из-за её испарения. Молекулы, покидающие жидкость, будут концентрироваться над её поверхностью в виде пара. Но когда плотность пара станет довольно высокой, некоторые из них начнут снова возвращаться в жидкость. И таких молекул будет всё больше и больше. Наконец, настанет такой момент, когда число молекул, вылетающих из жидкости, и число молекул, возвращающихся в неё, сравняется. В этом случае говорят, что жидкость находится в динамическом равновесии со своим паром. А такой пар называется насыщенным.
Если при парообразовании из жидкости вылетает больше молекул, чем возвращается, то такой пар будет ненасыщенным.
Ненасыщенный пар образуется, когда испаряющаяся жидкость находится в открытом сосуде. Покидающие её молекулы рассеиваются в пространстве. Возвращаются в жидкость далеко не все из них.
Обратный переход вещества из газообразного состояния в жидкое называют конденсацией. При конденсации часть молекул пара возвращается в жидкость.
Пар начинает превращаться в жидкость (конденсироваться) при определённом сочетании температуры и давления. Такое сочетание называется критической точкой.
Максимальная температура, ниже которой начинается конденсация, называется критической температурой. При температуре выше критической газ никогда не превратится в жидкость.
В критической точке граница раздела фазовых состояний жидкость-пар размывается. Исчезает поверхностное натяжение жидкости, выравниваются плотности жидкости и её насыщенного пара. При динамическом равновесии, когда число молекул, покидающих жидкость и возвращающихся в неё равно, процессы испарения и конденсации уравновешены.
При испарении воды её молекулы образуют водяной пар, который смешивается с воздухом или другим газом.
Температура, при которой такой пар в воздухе становится насыщенным, начинает конденсироваться при охлаждении и превращается в капельки воды, называется точкой росы.
Иногда вещество может перейти из газообразного состояния сразу в твёрдое, минуя жидкую стадию. Такой процесс называется десублимацией. Ледяные узоры, которые появляются на стёклах в мороз, и есть пример десублимации. При заморозках почва покрывается инеем - тонкими кристалликами льда, в которые превратились водяные пары из воздуха.
Теплота испарения по своей величине равна теплоте конденсации и зависит от температуры и давления процесса, уменьшаясь с приближением их критическим величинам
Конденсация процесс перехода вещества из парообразного состояния в жидкое;
При конденсации резко уменьшается объем среды и образуется вакуум.
Кавитация.
Кавита́ция — процесс парообразования и последующего схлопывания пузырьков пара с одновременным конденсированием пара в потоке жидкости, сопровождающийся шумом и гидравлическими ударами, образование в жидкости полостей (кавитационных пузырьков, или каверн), заполненных паром самой жидкости, в которой возникает.
При увеличении скорости жидкости давление в ней падает. Если абсолютное давление при этом достигает значения равного давлению насыщенных паров при данной температуре, то в данном месте начинается кипение, выделение паров и газов. Такое явление называется кавитацией.
Кавитация – это местное нарушение сплошности течения с образованием паровых и газовых пузырей (каверн) обусловленное местным падением давления в потоке.
Именно, кавитация является определяющими фактором для величины высоты всасывания насоса, т. к чем больше высота всасывания - тем большее разряжение нужно создать, чтобы закачать жидкость в насос, как только величина этого разряжения приблизится к значению давления насыщенных паров возникнет неблагоприятный эффект - нарушение сплошности потока - кавитацию.
Кавитация сопровождается характерным шумом, а при длительном воздействии также эрозионным разрушением металлических стенок. Дело в том, что в центрах захлопывающихся пузырьков давление подскакивает до 1500 ¸ 2000 ат, а температуры – до1000 ¸ 1500°С. От мгновенного разрушения гидросистему спасает только то, что объемы, в которых наблюдаются такие параметры, микроскопически малы, а распространяясь по жидкости давление и температура очень быстро падают.
Но если пузырек захлопывается на поверхности трубы или гидроагрегата, то высокое давление и температура воздействуют на металл и разрушают его, выкрашивают.
Механическое воздействие сопровождается химическим, так как в растворенном воздухе процент содержания кислорода существенно выше, чем в атмосферном, так как кислород растворяется в жидкостях лучше, чем азот.
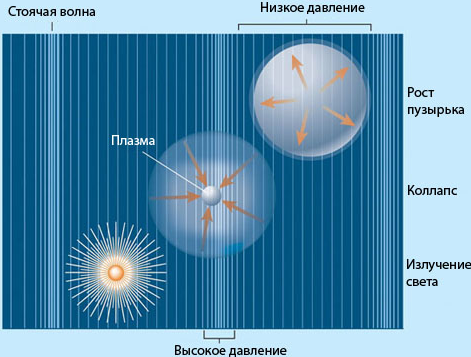
Схлопывание кавитационных пузырей приводит к тому, что энергия окружающей жидкости сосредотачивается в очень небольших объёмах.
Тем самым, образуются места повышенной температуры и возникают ударные волны, которые являются источниками шума и приводят к эрозии металла. Шум, создаваемый кавитацией, является особой проблемой на подводных лодках, так как снижает их скрытность.
Кавитация ведёт к большому износу рабочих органов и может значительно сократить срок службы винта и насоса. В метрологии, при использовании ультразвуковых расходомеров, кавитационные пузыри модулируют волны в широком спектре, в том числе и на частотах излучаемых расходомером, что приводит к искажению его показаний.
Хотя кавитация нежелательна во многих случаях, есть исключения. Например, сверхкавитационные торпеды, используемые военными, обволакиваются в большие кавитационные пузыри. Существенно уменьшая контакт с водой, эти торпеды могут передвигаться значительно быстрее, чем обыкновенные торпеды. Так сверхкавитационная торпеда «Шквал», в зависимости от плотности водной среды, развивает скорость до 370 км/ч.
Кавитация используется при ультразвуковой очистке поверхностей твёрдых тел. Специальные устройства создают кавитацию, используя звуковые волны в жидкости. Кавитационные пузыри, схлопываясь, порождают ударные волны, которые разрушают частицы загрязнений или отделяют их от поверхности. Таким образом, снижается потребность в опасных и вредных для здоровья чистящих веществах во многих промышленных и коммерческих процессах, где требуется очистка как этап производства.
В промышленности кавитация часто используется для гомогенизации (смешивания) и отсадки взвешенных частиц в коллоидном жидкостном составе, например, смеси красок или молоке. Многие промышленные смесители основаны на этом принципе.
Кавитацию используют для обработки топлива. Во время обработки топливо дополнительно очищается (при проведении химического анализа сразу обнаруживается существенное уменьшение количества фактических смол)[2], и перераспределяется соотношение фракций (в сторону более лёгких). Их проводят частные компании и институты, например Российский государственный университет нефти и газа им. И. М. Губкина.
Также были разработаны кавитационные водные устройства очистки, в которых граничные условия кавитации могут уничтожить загрязняющие вещества и органические молекулы. Спектральный анализ света, испускаемого в результате сонохимической реакции, показывает химические и плазменные базовые механизмы энергетической передачи. Свет, испускаемый кавитационными пузырями, называется сонолюминесценцией.
Кавитационные процессы имеют высокую разрушительную силу, которую используют для дробления твёрдых веществ, которые находятся в жидкости. Одним из применений таких процессов является измельчение твёрдых включений в тяжёлые топлива, что используется для обработки котельного топлива с целью увеличения калорийности его горения.






