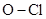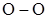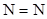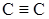При сопоставлении определений явлений горения и химического взрыва можно отметить, что химические реакции при горении и взрыве имеют некоторые общие характерные особенности.
Их протекание сопровождается выделением тепла. Если в результате химической реакции не выделяется заметного количества тепла, то такая реакция не может протекать в форме взрыва. Так, французский учёный Марсель Бертло (1827-1907 гг.) изучал разложение при нагревании оксалатов (солей щавелевой кислоты) различных металлов [1]. Результаты этих опытов представлены в табл. 1.1.
Таблица 1.1
Влияние теплового эффекта химической реакции на взрывчатость
Оксалатов металлов
| Уравнение химической реакции
| Тепловой эффект, кДж/моль
| Наличие взрывчатых свойств
оксалата
|
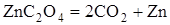
| -205,6
| Невзрывчатый
|
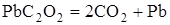
| -69,9
| Невзрывчатый
|

| +24,7
| Взрывчатость сомнительна
|
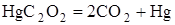
| +72,4
| Взрывчатый
|
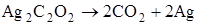
| +123,5
| Взрывчатый
|
Из приведенных данных видно, что реакции разложения, протекающие с поглощением тепла, не дают взрыва. Напротив, реакции, при которых выделяется значительное количество тепла, протекают со взрывом.
Отсюда следует, что первым необходимым условием того, чтобы химическая реакция могла протекать в форме горения или взрыва, является её экзотермичность, т.е. положительный тепловой эффект реакции.
Экзотермичность превращения ЭМ (ВВ) в продукты взрыва имеет различные причины.
Из табл. 1.1 видно, что теплóты образования продуктов реакции равны. Во всех реакциях образуется по два моля 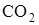 , а теплота образования элементов в виде простых веществ равна нулю, в тоже время тепловые эффекты реакций различны.
, а теплота образования элементов в виде простых веществ равна нулю, в тоже время тепловые эффекты реакций различны.
Это объясняется тем, что тепловой эффект реакции представляет собой разность между теплóтами образования из элементов продуктов реакции и исходного реагирующего вещества (реагента):
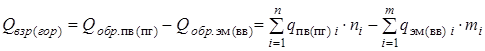 .
.
где
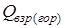
- теплота взрыва (горения) ЭМ (ВВ), кДж/моль (ккал/моль);
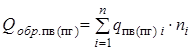 - суммарная теплота образования продуктов взрыва (горения) с учетом числа их грамм-молей -
- суммарная теплота образования продуктов взрыва (горения) с учетом числа их грамм-молей -  , кДж/моль (ккал/моль). Здесь
, кДж/моль (ккал/моль). Здесь  - теплота образования i -го продукта взрыва или горения;
- теплота образования i -го продукта взрыва или горения;
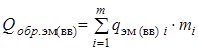 - суммарная теплота образования компонент ЭМ (ВВ) с учетом числа их грамм-молей -
- суммарная теплота образования компонент ЭМ (ВВ) с учетом числа их грамм-молей - 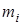 , кДж/моль (ккал/моль). Здесь
, кДж/моль (ккал/моль). Здесь 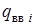 - теплота образования i -ой компоненты ЭМ (ВВ.
- теплота образования i -ой компоненты ЭМ (ВВ.
Например, взрывчатое превращение азида свинца протекает в соответствии с уравнением реакции
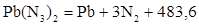 кДж.
кДж.
Разложение азида свинца протекает со взрывом, т.к. теплота образования азида свинца равна минус - 483,6 кДж/моль, а теплота образования продуктов взрыва равна нулю.
Хлористый азот распадается со взрывом по реакции
 .
.
Таким образом, если химическое соединение (реагент или ЭМ) является эндотермическим, т.е. образовалось из элементов с поглощением тепла, то при обратном процессе – распаде соединения на элементы (взрывчатом превращении) выделяется соответствующее количество тепловой энергии.
Теплота образования ЭМ (ВВ) или их компонент может быть эндотермичной, а ПВ (ПГ) - экзотермичной (например: гексоген 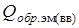 = - 93,4 кДж/моль, тетрил
= - 93,4 кДж/моль, тетрил 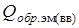 = - 55,7 кДж/моль).
= - 55,7 кДж/моль).
Теплота образования реагента ЭМ (ВВ) может быть положительна (например нитроглицерин: 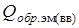 = 344,5 кДж/моль), но гораздо меньше, чем суммарная теплота образования ПВ (ПГ)
= 344,5 кДж/моль), но гораздо меньше, чем суммарная теплота образования ПВ (ПГ) 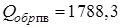 кДж/г-моль,
кДж/г-моль,
Откуда
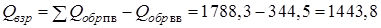 кДж/моль.
кДж/моль.
Поскольку продукты горения и взрыва в основном имеют положительные теплóты образования, то вещества с отрицательными теплóтами образования, способные к быстрой реакции с выделением тепла, с большой вероятностью могут оказаться взрывчатыми. Например, жидкая окись азота (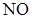 ), имеющая теплоту образования минус 90,4 кДж/моль (3014,5 кДж/кг), детонирует в стальной трубе со скоростью 5,62 км/с.
), имеющая теплоту образования минус 90,4 кДж/моль (3014,5 кДж/кг), детонирует в стальной трубе со скоростью 5,62 км/с.
Поэтому, когда теплота образования реагента велика, тепловой эффект реакции будет мал, или даже будет отрицательным (т.е. протекание данной реакции возможно лишь при подводе тепла извне).
Когда же теплота образования исходного вещества (ВВ или его компонент) невелика или имеет отрицательное значение, тепловой эффект реакции будет положительным, что делает возможным протекание реакции в форме горения или взрыва.
Чем больше выделяемая при взрыве теплота реакции и скорость ее распространения, тем больше энергия разрушения зарядов ВВ. Таким образом, теплота реакции взрывчатого превращения является критерием работоспособности ВВ – важнейшей его характеристикой.
Э кзотермичность реакции зависит от химической структуры вещества.
Экзотермичность превращения определяется тем, что прочность связей между атомами в продуктах превращения значительно больше, чем в самом ЭМ (ВВ).
Эндотермическими оказываются соединения в котором связаны атомы одного и того же элемента, т.н. эксплозофорные атомные группировки (Вант-Гофф [ФВ]).
В табл.1.2 приведены некоторые атомные группировки, сообщающие соединению взрывчатость (по Вант-Гоффу)
Таблица 1.2
| Группа
| Химические соединения
|
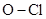
| хлораты и перхлораты
|
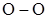
| озон, перекиси
|

| нитраты, нитриты, нитросоединения
|
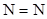
| азиды (азид свинца) и др.
|
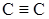
| ацетилен и его производные
|



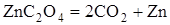
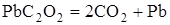

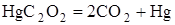
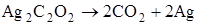
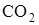 , а теплота образования элементов в виде простых веществ равна нулю, в тоже время тепловые эффекты реакций различны.
, а теплота образования элементов в виде простых веществ равна нулю, в тоже время тепловые эффекты реакций различны.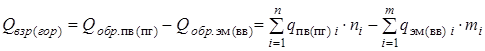 .
.
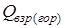 - теплота взрыва (горения) ЭМ (ВВ), кДж/моль (ккал/моль);
- теплота взрыва (горения) ЭМ (ВВ), кДж/моль (ккал/моль);
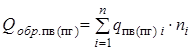 - суммарная теплота образования продуктов взрыва (горения) с учетом числа их грамм-молей -
- суммарная теплота образования продуктов взрыва (горения) с учетом числа их грамм-молей -  , кДж/моль (ккал/моль). Здесь
, кДж/моль (ккал/моль). Здесь  - теплота образования i -го продукта взрыва или горения;
- теплота образования i -го продукта взрыва или горения;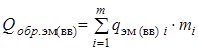 - суммарная теплота образования компонент ЭМ (ВВ) с учетом числа их грамм-молей -
- суммарная теплота образования компонент ЭМ (ВВ) с учетом числа их грамм-молей - 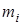 , кДж/моль (ккал/моль). Здесь
, кДж/моль (ккал/моль). Здесь 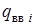 - теплота образования i -ой компоненты ЭМ (ВВ.
- теплота образования i -ой компоненты ЭМ (ВВ.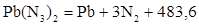 кДж.
кДж. .
.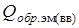 = - 93,4 кДж/моль, тетрил
= - 93,4 кДж/моль, тетрил 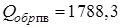 кДж/г-моль,
кДж/г-моль,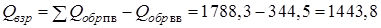 кДж/моль.
кДж/моль. ), имеющая теплоту образования минус 90,4 кДж/моль (3014,5 кДж/кг), детонирует в стальной трубе со скоростью 5,62 км/с.
), имеющая теплоту образования минус 90,4 кДж/моль (3014,5 кДж/кг), детонирует в стальной трубе со скоростью 5,62 км/с.