В соответствии с моделью идеального газа изменение расстояния между молекулами при не ведет к изменению энергии взаимодействия. Поэтому внутренняя энергия идеального газа от объема не зависит. Так как потенциальная энергия взаимодействия U потенц = const, то можно принять ее для идеального газа равной 0. Тогда U идеального газа представить, как сумму 3-х слагаемых:
U = U п.х.д.м. + U в.х.д.м. + U к.х.д.а.м., (1)
где:
U п.х.д.м. – кинетическая энергия поступательного хаотического движения молекул,
U в.х.д.м. – кинетическая энергия вращательного хаотического движения молекул,
U к.х.д.а.м. – механическая энергия, связанная с колебательным хаотическим движением атомов в молекулах.
Внутренняя энергия данной массы идеального газа зависит только от температуры. Однако внутренняя энергия одной и той же массы различных газов при одной температуре может отличаться, что определяется числом степеней свободы молекул. Число степеней свободы i – количество независимых координат, задающих положение молекулы в пространстве.
По теореме Больцмана: в условиях термодинамического равновесия средняя энергия, приходящаяся на одну степень свободы п.х.д.м. и в.х.д.м. – кТ/2; на одну степень свободы к.х.д.а.м. – кТ.
Внутренняя энергия некоторой массы идеального газа:
 (2)
(2)
где N – число молекул данного вида в системе.
Опыт показывает, (объяснение дает квантово-механическая теория), что в широком диапазоне температур молекулы двух- и трехатомных газов можно считать жесткими. Интервалы жесткости основных молекул, входящих в воздух: N2 – (29¸3300) К; О2 – (2,1¸3200) К; СО2 – (300¸2000) К; HСl – (3,0¸3300) К. Обусловлено это свойство молекул тем, что между атомами, в них входящими, реализуется достаточно сильная химическая связь – ковалентная связь.
В этом приближении N молекул однокомпонентного газа обладают внутренней энергией:
 (3)
(3)
где i – число степеней свободы, приходящихся на поступательное и вращательное хаотическое движение молекулы.
Таблица №1 (для жестких молекул).
| Газ
| Одноатомный
| Двухатомный
| Многоатомный
|
| Линейные молекулы
| Пространственные
молекулы
|
| i
|
|
|
|
|
Для моля такого газа:
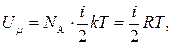 (4)
(4)
Для произвольной массы:
 (5)
(5)
В ситуации многокомпонентного газа:
 (6)
(6)
§2. Термическое и калорическое описание изопроцессов (V=const; p=const; T=const).
Если учесть уравнения и условия изопроцессов с идеальным газом и аналитическую зависимость внутренней энергии такого газа от Т, то первое начало термодинамики для произвольного элементарного процесса будет иметь вид:


В соответствии с (1) характеристики изопроцессов можно представить в таблице 2.
Термическое и калорическое описание изопроцессов.
Таблица 2.
| Процессы
| А
| Du
| Q
| Теплоемкость
|
| Сх
| Схm
|
V=сonst
(dV=0)
 P=cT
P=cT
|
| 
| Qv=Du
| 
| 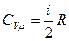
|
P = const
(dP = 0)
 V = сТ
V = сТ
| 
| 
| 
| 
| 
|
| T = const
(dT = 0)
PV = const
|  
|
| Qт = Ат
| ±¥
| ±¥
|

О воздухе.
Сухой воздух содержит: 78,1 % азота – N2; 21,0 % кислорода – О2; 0,94 % инертных газов – He, Ne и др.; 0,03 % СО2 и в небольшом количестве других газов.
1. Средняя молярная масса воздуха:

2. Среднее число степеней свободы молекул воздуха в широком температурном интервале практически совпадает с числом степеней свободы у жестких 2-х атомных молекул (их в воздухе чуть более 99 %).

В приведенных соотношениях:
m – масса рассматриваемой системы,
 - средняя молярная масса смеси газов,
- средняя молярная масса смеси газов,
ni – число молей (количество вещества) i –го газа;
 - общее количество вещества в системе, выраженное в молях;
- общее количество вещества в системе, выраженное в молях;
ii – число степеней свободы у молекул i – го газа;
 - среднее число степеней свободы для молекул смеси газов (многокомпонентной газовой системы).
- среднее число степеней свободы для молекул смеси газов (многокомпонентной газовой системы).
3. Средние значения молярных и удельных теплоемкостей:


Тогда в модельном представлении о воздухе, как идеальном газе из жестких молекул, отношение изобарической и изохорической теплоемкостей, обозначаемое g равно:

4. Реальный воздух влажный. Он содержит пары воды. Молекулы воды в газообразном состоянии, как пространственные жесткие, обладают 6-ю степенями свободы. При температуре 25оС и влажности 65 % доля молекул воды в воздухе не превышает 1,0 %. В отношении среднего значения степеней свободы у молекул такого воздуха это своеобразная компенсация присутствия в нем примерно такой же доли одноатомных молекул инертных газов (i = 3). Поэтому водяной пар, не конденсирующийся в эксперименте, дополнительно приближает среднее число степеней свободы молекул воздуха к пяти ( ).
).



 (2)
(2) (3)
(3)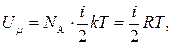 (4)
(4) (5)
(5) (6)
(6)

 P=cT
P=cT


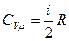
 V = сТ
V = сТ










 - средняя молярная масса смеси газов,
- средняя молярная масса смеси газов, - общее количество вещества в системе, выраженное в молях;
- общее количество вещества в системе, выраженное в молях; - среднее число степеней свободы для молекул смеси газов (многокомпонентной газовой системы).
- среднее число степеней свободы для молекул смеси газов (многокомпонентной газовой системы).


 ).
).


