

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...
Топ:
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Интересное:
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Лабораторные работы
Методическое пособие
по дисциплине «Химия»
Санкт-Петербург
2013 г.
Автор: Родякина Е.В., преподаватель высшей категории
Санкт-Петербургского политехнического колледжа.
Рецензент: Никитин В.А., канд. хим. наук, доцент кафедры химии
Санкт-Петербургского института машиностроения.
Данное пособие представляет собой методические указания к проведению лабораторных работ по дисциплине «Химия». Пособие предназначено для практического усвоения материала указанных тем, приобретения компетенций в области проведения химического эксперимента, развития организационных и коммуникационных компетенций.
В сборнике содержится материал, необходимый студентам как при самостоятельной подготовке к работе, так и при непосредственном выполнении работы на занятии. К работе прилагается бланк отчета.
Предисловие
В данном сборнике содержатся методические указания к работам, выполняемым студентами при изучении дисциплины Химия.
Назначение методических указаний – способствовать достижению следующих результатов обучения и развития студентов: умения выполнять химические опыты, подтверждающие свойства изученных веществ, распознавать вещества, пользоваться химической посудой и оборудованием, соблюдать правила охраны труда; сравнивать состав и свойства веществ, анализировать результаты наблюдаемых опытов на основе изученных законов и теорий.
Методические указания предназначены для использования студентами как при домашней подготовке к выполнению лабораторных работ, так и в процессе выполнения их в лаборатории.
Материал представлен в следующем порядке:
|
|
n Правила выполнения лабораторных работ.
n Лабораторные работы, содержащие разделы:
-- Цель работы.
-- Пояснения к работе, отражающие краткие теоретические сведения на основе минимума содержания по данному разделу дисциплины и с учетом требований к итогам его усвоения, определяемых ГОС СПО.
-- Задание, которое студент обязан выполнить при домашней подготовке к лабораторной работе.
-- Работа в лаборатории. Здесь содержатся инструкции по проведению опытов, приводится список необходимых реактивов и оборудования.
-- Содержание отчета.
-- Контрольные вопросы, позволяющие оценить выполнение требований Государственного образовательного стандарта к уровню знаний студентов по данному разделу дисциплины, в том числе и на этапе допуска к работе.
n Литература.
Лабораторные работы помогают студентам усвоить основные законы и теоретические положения химии, узнать свойства важнейших веществ и способы их получения, прививают навыки в проведении простейших химических исследований и определений, выполняемых в производственных условиях или в заводских лабораториях.
Правила выполнения лабораторных работ
Студенты допускаются к работе после проверки готовности, производимой преподавателем.
Объем домашней подготовки включает повторение соответствующих теме разделов учебника, записей в рабочей тетради, подробное ознакомление с теоретическими сведениями, содержащимися в пояснениях к данной работе, ответы на контрольные вопросы.
Кроме теоретических знаний по теме работы, студенты должны четко представлять последовательность действий в соответствии с инструкциями раздела «Работа в лаборатории», и знать правила охраны труда при работе в химической лаборатории.
При выполнении опытов необходимо строго следовать инструкции и соблюдать все меры предосторожности.
После выполнения работы студенты должны представить отчет о проделанной работе с обсуждением полученных результатов и выводов.
|
|
Порядок выполнения работ, пропущенных
по уважительным причинам.
После проверки готовности студент выполняет работу с другой группой в отведенный для лабораторных работ и дополнительных занятий день (субботу).
Порядок выполнения работ, пропущенных
по неуважительным причинам.
Студент допускается к выполнению работы после проверки готовности в зачетную неделю.
Лабораторная работа 1. Химические свойства спиртов и альдегидов
Цель работы:
Осуществить реакции, подтверждающие химические свойства спиртов и альдегидов, объяснить при помощи химических уравнений сущность этих реакций.
Пояснения к работе
Химические свойства спиртов
1) Кислотные свойства: Спирты — амфотерные соединения, могут образовывать соли и комплексы с активными металлами. Например:
СН3 – СН2–ОН + Na —> СН3– СН2–ОNa + Н2
2) Взаимодействие с галогеноводородами:
R-OH + HHal —> RHal + H2O
HF не вступает в эту реакцию так как его кислотность недостаточна.
3) Межмолекулярная дегидратация(образование простых эфиров):
R-OH + R'-OH -> R-O-R' + H2O
Катализатором данной реакции служит кислота. Чаще всего используют серную кислоту. Легче всего реагируют третичные спирты.
4) Внутримолекулярная дегидратация:
C2H5OH —> CH2=CH2 + H2O
Спирты дегидратируются по правилу Зайцева. Легче всего отщепляют воду третичные спирты. Межмолекулярная и внутримолекулярная дегидратация являются конкурирующими реакциями. Но вторая протекает при более высокой температуре.
5) Реакция этерификации. Спирты реагируют с кислотами, при этом образуются сложные эфиры.
а)R—ОН + HNO3 —> R—О—NO2 + Н2О
б)R'-OH + R-COOH —> R-C(O)-OR' + H2O
Реакция является обратимой. Также при взаимодействии с неорганическими кислотами-окислителями(например с азотной) протекает побочная реакция - окисление.
6) Окисление спиртов Спирты окисляются легче, чем углеводороды. Первичные и вторичные спирты окисляются легче третичных. Первичные окисляются до альдегидов, вторичные — до кетонов. В случае первичных спиртов может протекать дальнейшее окисление образующихся альдегидов до соответствующих карбоновых кислот.
7) R-OH —> R-CHO —> R-COOH
Химические свойства альдегидов
1) Альдегиды медленно окисляются кислородом воздуха в карбоновые кислоты:
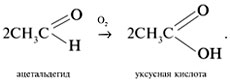
|
|
2) Качественная реакция на альдегиды – реакция «серебряного зеркала». Реакция состоит во взаимодействии альдегида RСНО с водно-аммиачным раствором оксида серебра(I), представляющим растворимое комплексное соединение [Ag(NН3)2]OH. Реакцию проводят при температуре, близкой к температуре кипения воды (80–100 °С). В результате на стенках стеклянного сосуда (пробирки, колбы) образуется осадок металлического серебра – «cеребряное зеркало»:
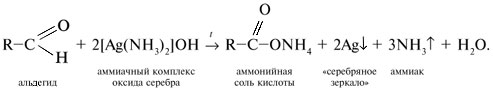
3) Восстановление гидроксида меди(II) в оксид меди(I) – другая характерная реакция альдегидов. Реакция протекает при кипячении смеси и состоит в окислении альдегида. Точнее сказать, происходит внедрение атома [О] окислителя Cu(OH)2 по связи С–Н альдегидной группы. При этом изменяются степени окисления карбонильного углерода (от +1 до +3) и атома меди (от +2 до +1). При нагревании голубого осадка Cu(OH)2 в смеси с альдегидом наблюдается исчезновение голубой окраски и образование красного осадка Cu2O:

4) Альдегиды присоединяют водород Н2 по двойной связи С=О при нагревании в присутствии катализатора (Ni, Pt, Pd). Реакция сопровождается разрывом  -связи в карбонильной группе С=О и присоединением по месту ее разрыва двух атомов Н молекулы водорода Н–Н. Таким образом из альдегидов получают спирты:
-связи в карбонильной группе С=О и присоединением по месту ее разрыва двух атомов Н молекулы водорода Н–Н. Таким образом из альдегидов получают спирты:

Работа в лаборатории
Опыт 1. Растворимость спиртов в воде
Реактивы и оборудование: спирты (этиловый, пропиловый, амиловый); фарфоровые чашки, пробирки.
В четыре пробирки наливают по 2 мл воды и в каждую добавляют по 0,5 мл этилового, пропилового, бутилового, амилового (или изоамилового) спиртов соответственно. Пробирки хорошо встряхивают. Отмечают, что этиловый и пропиловый спирты прекрасно растворяются в воде, а при растворении амилового спирта образуется эмульсия, которая быстро расслаивается. При этом изоамиловый спирт, подобно маслу, всплывает на поверхность воды. Отсюда и возникло название «сивушное масло», под которым понимают смесь высокомолекулярных одноатомных спиртов, в том числе и изоамилового. Объясните, почему выше перечаленные спирты по-разному растворяются в воде.
Опыт 2. Взаимодействие с металлическим натрием
Реактивы и оборудование: этиловый спирт, натрий металлический; пробирки, скальпель, пинцет, фильтровальная бумага, проволока, лучины.
|
|
В сухую пробирку наливают этиловый спирт и погружают в него кусочек чистого (свежеотрезанного, очищенного и отжатого от керосина) металлического натрия размером с горошину. Охлаждая пробирку в стакане с водой, предотвращают разогревание смеси и выкипание спирта. Когда газ станет выделяться спокойно, подносят к отверстию пробирки горящую лучину. Выделяющийся водород образует с воздухом смесь, вспыхивающую с характерным резким звуком. (Опыт демонстрационный)
Запишите уравнение реакции.
Опыт 3. Комплексообразование многоатомных спиртов
Реактивы и оборудование: глицерин, этиловый спирт, глицерин, сульфат меди (3%-ный водный раствор), гидроксид натрия (2н водный раствор), соляная кислота (разбавленная 1:5); пипетки, пробирки.
Поместите в пробирку 3 капли раствора сульфата меди, 3 капли раствора щёлочи и взболтайте. Появляется голубой студенистый осадок гидроксида меда (II). Добавьте в пробирку 2–3 капли многоатомного спирта. При взбалтывании осадок растворяется и появляется тёмно-синее окрашивание образовавшегося глицерата меди.
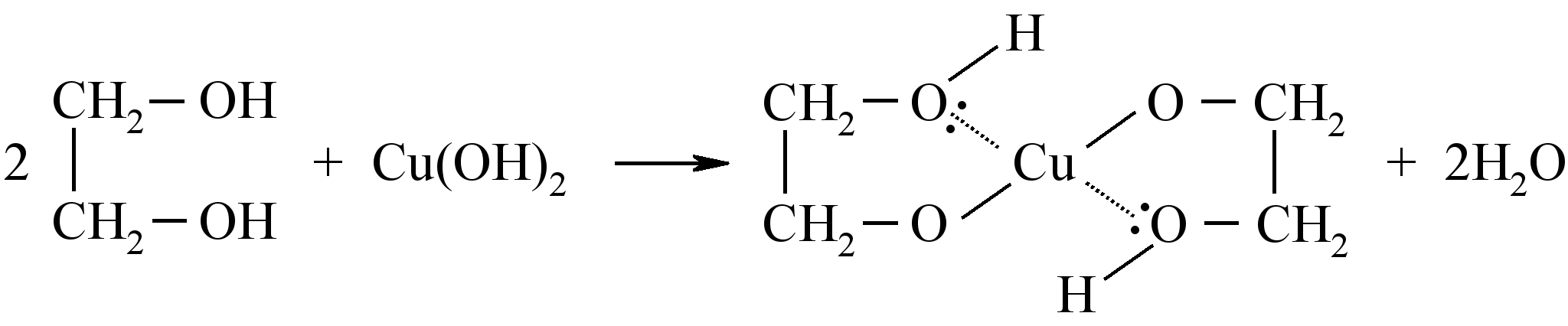
Опыт 4. Восстановление альдегидами соединений серебра
Реактивы: формальдегид.
Предварительно готовят аммиачный раствор окиси серебра, добавляя к 4-5 мл раствора нитрата серебра разбавленный водный аммиак по каплям до растворения первоначально образующегося осадка.
Раствор альдегида наливают (по 1 мл) в две пробирки и добавляют в каждую пробирку по 1 мл свежеприготовленного аммиачного раствора окиси серебра. В одну из пробирок добавляют еще 2-3 капли разбавленного раствора щелочи. Встряхнув пробирки, ставят их в штатив.
Отмечают, в какой пробирке изменение наблюдается раньше. Если серебро не выделяется, то нагревают пробирки с жидкостью несколько минут на водяной бане до 50-60оС.
Чтобы получить осадок серебра в виде зеркального слоя на стенках пробирки, перед проведением опыта следует тщательно вымыть пробирку горячим раствором щелочи и затем ополоснуть дистиллированной водой.
По окончании работы с аммиачным раствором окиси серебра необходимо сразу же вымыть посуду, находившуюся в работе, а образовавшиеся осадки и налеты на стенках растворить в разбавленной азотной кислоте.
Запишите уравнение реакции
Составьте отчет следующего содержания:
Цель работы:_____________________________________________
| № опыта | Порядок выполнения | Наблюдения | Уравнение реакции | Выводы |
Лабораторная работа 1.
Химические свойства спиртов и альдегидов
Отчет
Студент___________________________________________________________
Группа_______
Цель работы:
_____________________________________________________________________________________________________________________________________________________________________________________________________
|
|
| № опыта | Порядок выполнения | Наблюдения | Уравнение реакции | Выводы |
Пояснения к работе
Карбоновые кислоты содержат сильно полярную связь между атомами кислорода и водорода в гидроксильной группе, которая еще больше поляризуется под влиянием атома кислорода, входящего в состав карбонильной группы.
1). В водном растворе карбоновые кислоты обратимо диссоциируют:
RCOOH  RCOO- + Н+
RCOO- + Н+
Лакмус в растворе карбоновых кислот приобретает красный цвет.
Карбоновые кислоты — слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей.
2). Реагируют с
- активными металлами
2RCOOH + Mg → (RCOO)2 Mg+Н2
- основными оксидами
2RCOOH + СаО → (RCOO)2 Са+Н2О
- основаниями
RCOOH + NаОH → RCOONа+Н2О
- солями слабых кислот
RCOOH + NаHCО3 → RCOONа+Н2О+CО2
3). Взаимодействуют со спиртами:

Работа в лаборатории
Оборудование: пробирки, штатив, хим. ложка, инструкция по выполнению лабораторной работы
Реактивы: две полоски индикаторной бумаги, раствор соляной кислоты концентрацией 3 моль/л, раствор уксусной кислоты концентрацией 3 моль/л, магний, раствор гидроксида калия концентрацией 1 моль/л, фенолфталеин, раствор карбоната натрия.
Опыт 1. Сравнение свойств органической и неорганической кислот.
В этом опыте сравним силу (степень диссоциации) органической кислоты на примере уксусной и неорганической – на примере соляной. Для этого определим рН растворов этих кислот с помощью универсальной индикаторной бумаги. Приготовить две полоски индикаторной бумаги и нанести на одну полоску каплю раствора соляной кислоты концентрацией 3 моль/л, а на другую каплю раствора уксусной кислоты такой же концентрации 3 моль/л. Сразу же сравнить изменившийся цвет бумаги с цветной шкалой, определив значение рН. Сделать вывод о том, какая из кислот является боле сильной.
Опыт 2. Отношение уксусной и соляной кислот к металлам.
Для опыта приготовить две пробирки. В одну поместить 1 мл уксусной кислоты, а в другую 1 мл соляной кислоты. В каждую из пробирок насыпать на кончике ложечки стружку магния. В каком случае реакция протекает интенсивнее? Какой газ выделяется из раствора. Записать уравнения соответствующих реакций.
Опыт 3. Взаимодействие уксусной кислоты с основаниями.
Поместите в пробирку 1 мл раствора гидроксида калия и прибавить несколько капель фенолфталеина. Объясните изменение окраски раствора. Затем в пробирку по каплям прибавляйте раствор уксусной кислоты до обесцвечивания раствора. Чем вызвано исчезновение окраски раствора? Записать уравнение соответствующей реакции.
Опыт 4. Взаимодействие уксусной кислоты с солями слабых неорганических кислот.
В пробирку поместить раствор карбоната натрия и приливать по каплям уксусную кислоту концентрацией CH3COOH 3моль/л. Описать наблюдаемые явления. Записать уравнение соответствующей реакции. Какой газ выделяется из раствора?
Сделайте вывод по работе: какова сила карбоновых кислот (на примере уксусной кислоты)? Каковы сходные признаки между органическими и неорганическими кислотами?
Составьте отчет следующего содержания:
| № опыта | Порядок выполнения | Наблюдения | Уравнение реакции | Выводы |
Лабораторная работа 2.
Химические свойства карбоновых кислот
Отчет
Студент___________________________________________________________
Группа_______
Цель работы:
_____________________________________________________________________________________________________________________________________________________________________________________________________
| № опыта | Порядок выполнения | Наблюдения | Уравнение реакции | Выводы |
Цель работы
Ознакомление с условиями лабораторного практикума и формирование умений самостоятельно проводить экспериментальную работу на примере изучения основных закономерностей протекания реакций ионного обмена.
Пояснения к работе
Реакции ионного обмена – это реакции в растворах электролитов, при которых ионы одного вещества обмениваются с ионами другого вещества.
Электролитами называют вещества, которые в расплавах или в растворах при взаимодействии с растворителем распадаются на ионы (диссоциируют).
Ионы – это заряженные частицы, образованные из одного или нескольких атомов. Положительно заряженные ионы называют катионами, отрицательно заряженные – анионами.
Растворы сильных электролитов в результате полной диссоциации содержат в основном ионы, а растворы слабых электролитов содержат в основном нераспавшиеся (недиссоциированные) молекулы и небольшую часть ионов. Сила электролита характеризуется степенью диссоциации, которая показывает соотношение между числом распавшихся(диссоциированных) молекул и общим числом молекул: α = Nдис/Nобщ
К сильным электролитам (α > 30%) относят:
а) практически все растворимые соли;
б) кислоты: H2SO4, HNO3, HCl, HBr, HI, HClO4, HMnO4 и некоторые другие;
в) растворимые основания (щелочи) – гидроксиды металлов IA и IB групп периодической системы
К слабым электролитам относят остальные кислоты и основания, воду и другие вещества.
В реакциях ионного обмена наряду с растворимыми сильными электролитами участвуют (образуются или расходуются) нерастворимые вещества, газы, малодиссоциированные соединения (слабые электролиты). Уравнения ионообменных реакций записывают в трех формах: 1) молекулярной, 2) полной ионной и 3) сокращенной ионной. В качестве примера составим уравнение для реакции между растворами нитрата бария и сульфата натрия.
Молекулярное уравнение
Ba(NO3)2 + Na2SO4 = BaSO4$ + 2NaNO3
Полное ионное уравнение
Ba2+ + 2NO3-+ 2Na+ + SO42- = BaSO4$ + 2Na+ + 2NO3-
Сокращенное ионное уравнение
Ba2+ + SO42- = BaSO4$
При составлении ионных уравнений сильные растворимые электролиты записывают в виде ионов: катионов (положительно заряженных ионов) и анионов (отрицательно заряженных ионов). Нерастворимые вещества, газы и слабые электролиты записывают в виде молекул. Внимательно изучите таблицу растворимости – она не только подскажет, какие вещества нерастворимы, но и поможет вам правильно определить заряды катионов и анионов для сильных электролитов.
Сокращенное ионное уравнение наиболее ясно выражает сущность реакции. В нашем примере видно, что реакция свелась к образованию нерастворимого вещества (осадка) сульфата бария.
Реакции в растворах электролитов практически необратимы и идут до конца в случаях, когда образуется: а) осадок, б) газ, в) слабый электролит.
Примеры уравнений реакций с образованием осадка
Взаимодействие растворов кислоты и соли
H2SO4 + Pb(NO3)2 = PbSO4$ + 2HNO3
2H+ + SO42- + Pb2+ +2NO3- = PbSO4$ + 2H++ 2NO3-
Pb2+ + SO42- = PbSO4$
Взаимодействие растворов сильного основания (щелочи) и соли
2NaOH +MgSO4 = Mg(OH)2$ + Na2SO4
2Na+ + 2OH- + Mg2+ + SO42- = Mg(OH)2$ + 2Na+ + SO42-
Mg2+ + 2OH- = Mg(OH)2$
Взаимодействие растворов двух солей
AgNO3 + NaCl = AgCl$ + NaNO3
Ag+ NO3- + Na+ + Cl- = AgCl$ + Na+ + NO3-
Ag+ + Cl- = AgCl$
Взаимодействие газа (кислотного оксида) с сильным основанием
SO2 + Ca(OH)2 = CaSO3$ + H2O
SO2 + Ca2+ + 2OH- = CaSO3$ + H2O
Примеры уравнений реакций с образованием газа
Взаимодействие кислоты и соли
H2SO4 + K2SO3 = K2SO4 + H2O + SO2#
2H+ + SO42- + 2K+ + SO32- = 2K+ + SO42 - + H2O + SO2#
2H+ + SO32- = H2O + SO2#
Взаимодействие сильного основания и соли
NaOH + NH4NO3 = NaNO3 + NH3# + H2O
Na+ + OH- + NH4+ + NO3- = Na+ + NO3- + NH3# +H2O
NH4+ + OH- = NH3# +H2O
Примеры уравнений реакций с образованием слабого электролита
Реакция нейтрализации
2NaOH + H2SO4 = Na2SO4 + 2H2O
2Na+ + 2 OH- + 2 H+ + SO42- = 2Na++ SO42-+ 2 H2O
OH- + H+ = H2O
Взаимодействие нерастворимого основания и кислоты
Cu(OH)2 + H2SO4 = CuSO4 + 2 H2O
Cu(OH)2 + 2H+ + SO42- = Cu2+ + SO42- + H2O
Cu(OH)2 + 2H+ = Cu2+ + H2O
Образование слабой кислоты
2NaCH3COO + H2SO4 = Na2SO4 + CH3COOH
2Na+ + CH3COO- + 2H+ + SO42-= 2Na+ + SO42- + CH3COOH
CH3COO- + H+ = CH3COOH
Задание для самопроверки и получения допуска к работе в лаборатории
При домашней подготовке необходимо:
1. Самостоятельно изучить методические рекомендации к данной лабораторной работе, конспект и литературу по теме.
2. Подготовить ответы на контрольные вопросы.
3. Решить экспериментальную задачу.
Контрольные вопросы
1. Какие реакции называют реакциями ионного обмена?
2. Что такое ионы? В результате какого процесса они образуются?
3. Какие вещества называют сильными электролитами?
4. Какие вещества называют сильными электролитами? Назовите некоторые из них.
5. Какие вещества называют слабыми электролитами?
6. В каких случаях реакции ионного обмена необратимы?
7. Как записываются уравнения реакций ионного обмена?
Экспериментальная задача.
Даны растворы:
серной кислоты,
гидроксида натрия,
хлорида бария,
cульфата меди(II).
Пользуясь таблицей растворимости, определите, при сливании каких растворов будут образовываться нерастворимые вещества (осадки). Составьте уравнения соответствующих реакций в молекулярной, ионной и сокращенной ионной формах.
Работа в лаборатории
Реактивы: Оборудование:
раствор карбоната натрия (Na2CO3) штатив
раствор серной кислоты (H2SO4) шесть пробирок
раствор гидроксида натрия (NaOH)
раствор хлорида бария (BaCl2)
раствор сульфата меди (CuSO4)
измельченный мел (CaCO3 с примес.)
индикатор фенолфталеин
Порядок работы:
1. Реакции обмена, сопровождающиеся выделением газа.
Подготовить две пробирки.
Опыт 1.1. В первую пробирку налить раствор карбоната натрия и добавить по каплям раствор кислоты.
Опыт 1.2. Во вторую пробирку положить кусочек мела и добавить по каплям раствор кислоты.
2. Реакции обмена с образованием слабого электролита.
Подготовить одну пробирку.
Опыт 2.1. В пробирку налить раствор гидроксида натрия и добавить две-три капли индикатора. К полученному раствору добавить по каплям раствор кислоты до исчезновения окраски индикатора.
3. Реакции обмена, сопровождающиеся образованием осадка.
Пользуясь таблицей растворимости солей и оснований в воде, подберите из имеющихся реактивов такие растворы, которые при взаимодействии между собой привели бы к образованию нерастворимого соединения (осадка).
Подготовьте необходимое число пробирок.
Осуществите на практике эти реакции.
В ходе работы все наблюдения необходимо заносить в отчет.
По окончании эксперимента необходимо записать в отчете уравнения всех проведенных реакций в молекулярном, полном и сокращенном ионном виде.
На основании сокращенных ионных уравнений объяснить свои наблюдения и сущность происходящих превращений.
Лабораторная работа 3
Цель работы
Осуществить реакции, подтверждающие химические свойства кислот и оснований и объяснить при помощи сокращенных ионных уравнений сущность этих реакций.
Пояснения к работе
Электролитической диссоциацией называют процесс распада электролитов на ионы в водных растворах или в расплавах. При диссоциации молекулы электролитов (кислот, солей, оснований) распадаются на положительно заряженные ионы, называемые катионами и отрицательно заряженные ионы, называемые анионами. Катионы и анионы в растворе химически связаны с молекулами воды – гидратированы, но для простоты написания уравнений электролитической диссоциации в них обычно гидратацию не показывают.
Кислоты.
Диссоциация кислот:
HCl 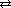 H+ + Cl-
H+ + Cl-
HNO3 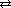 H+ + NO3-
H+ + NO3-
Диссоциация многоосновных кислот происходит ступенчато:
первая ступень H2S 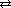 H+ + HS-
H+ + HS-
вторая ступень HS- 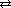 H+ + S2-
H+ + S2-
Из уравнений диссоциации видно, что общим для всех кислот является присутствие в растворе катионов водорода(H+).
Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода(H+).
Именно катионы водорода являются причиной общих свойств всех кислот: кислый вкус, изменение окраски индикаторов, взаимодействие с металлами, основными оксидами, основаниями.
Химические свойства кислот
1) Диссоциация
HCl = H+ + Cl-
2) Взаимодействие растворов кислот с металлами:
2HCl + Zn = ZnCl2 + H2#
2H+ + 2Cl- + Zn0 = Zn2+ + 2Cl- + H20#
2H+ + Zn0 = Zn2+ + H20#
3) Взаимодействие кислот с основными оксидами:
H2SO4 +MgO = MgSO4 + H2O
2H+ + SO42- +MgO = Mg2+ + SO42- + H2O
2H+ +MgO = Mg2+ + H2O
4) Взаимодействие кислот с основаниями (реакция нейтрализации):
HNO3 + NaOH = NaNO3 + H2O
H+ + NO3- +Na+ + OH- = Na+ + NO3- + H2O
H+ + OH- = H2O
Сокращенные ионные уравнения этих взаимодействий еще раз показывают, что именно катионы водорода (H+) участвуют в реакциях со стороны кислот.
Кислоты могут реагировать с солями, если образуется газ, осадок или слабый электролит (см. “Реакции ионного обмена”).
H2SO4 + K2CO3 = K2SO4 + CO2# + H2O
2Н+ + SO42- + 2K+ + CO32- = 2K+ + SO42- + CO2# + H2O
2Н+ + CO32- = CO2# + H2O
H2SO4 + Ва(NO3)2 = ВаSO4$ + 2HNO3
2Н+ + SO42- + Ba2+ + 2NO32- = BaSO4$ + 2H+ + 2NO32-
Ва2+ + SO42- = ВаSO4$
H2SO4 + 2NaF = Na2SO4 + 2HF
2Н+ + SO42- + 2Na+ +2F- = 2Na+ + SO42- + 2HF
Н+ + F- = HF
Основания.
Диссоциация оснований:
NaOH D Na+ + OH-
KOH D K+ + OH-
Диссоциация многокислотных оснований происходит ступенчато:
первая ступень Ba(OH)2 D BaOH+ + OH-
вторая ступень BaOH+ D Ba+ + OH-
Из уравнений диссоциации видно, что общим для всех оснований является присутствие в растворе гидроксид-ионов(OH-).
Основания – это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы(OH-).
Именно гидроксид-ионы являются причиной общих свойств всех оснований:
изменение окраски индикаторов (для растворимых оснований – щелочей), взаимодействие с кислотными оксидами, с кислотами, с растворами солей.
Задание для самопроверки и получения допуска к работе в лаборатории
При домашней подготовке необходимо:
1. Самостоятельно изучить методические рекомендации к данной лабораторной работе, конспект и литературу по теме.
2. Подготовить ответы на контрольные вопросы.
3. Решить экспериментальную задачу.
Контрольные вопросы
1. Дайте определение кислотам и основаниям в свете теории электролитической диссоциации.
2. Какие ионы определяют химические свойства кислот с точки зрения теории электролитической диссоциации? Перечислите эти свойства.
3. Какие ионы определяют химические свойства основанний с точки зрения теории электролитической диссоциации? Перечислите эти свойства
Экспериментальная задача.
В лаборатории имеются вещества: железо металлическое, медь металлическая, оксид кремния(IV), оксид бария, соляная кислота, гидроксид магния, раствор хлорида цинка. С какими из перечисленных веществ будут реагировать: а) раствор серной кислоты; б) раствор гидроксида натрия? Составьте уравнения соответствующих реакций в молекулярной, ионной и сокращенной ионной форме
Работа в лаборатории
Реактивы: Оборудование:
раствор серной кислоты H2SO4 штатив
раствор гидроксида натрия NaOH. стеклянная трубка
раствор гидроксида кальция Ca(OH)2 семь пробирок
(известковая вода)
раствор карбоната натрия Na2CO3
раствор сульфата меди CuSO4
порошок оксида меди(II) CuO
цинк металлический Zn
индикатор лакмус
Порядок работы:
1. Химические свойства кислот.
Подготовьте четыре пробирки и налейте в каждую по 1мл раствора кислоты.
Опыт 1.1. Действие кислот на индикаторы.
В первую пробирку добавить по каплям раствор индикатора лакмуса.
Опыт 1.2. Взаимодействие кислот с металлами.
Во вторую пробирку опустить кусочек цинка.
Опыт 1.3. Взаимодействие кислот с основными оксидами.
В третью пробирку аккуратно насыпать немного порошка оксида меди.
Опыт 1.4 Взаимодействие кислот с основаниями.
В первую пробирку с раствором кислоты в присутствии индикатора добавить по каплям раствор гидроксида натрия до изменения окраски индикатора.
Опыт 1.5. Взаимодействие кислот с солями.
В четвертую пробирку пролить раствор карбоната натрия.
2. Химические свойства оснований.
Подготовьте три пробирки и налейте в каждую раствор гидроксида кальция.
Опыт 2.1. Действие растворимых оснований (щелочей) на индикаторы.
В первую пробирку добавить раствор индикатора лакмуса.
Опыт 2.2. Взаимодействие оснований с кислотными оксидами.
Во вторую пробирку опустить трубку и выдыхать через нее (осторожно!)
в раствор углекислый газ – оксид углерода(VI).
Опыт 2.3. Взаимодействие оснований с кислотами.
В первую пробирку с раствором гидроксида кальция в присутствии индикатора добавить по каплям раствор кислоты до изменения окраски индикатора.
Опыт 2.4. Взаимодействие растворимых оснований (щелочей) с солями.
В третью пробирку прилить раствор сульфата меди(II).
Отчет
Лабораторная работа
Цель работы
Путем испытания растворов солей индикаторами доказать, какие соли подвергаются гидролизу и определить реакцию среды данных растворов.
Пояснения к работе
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуется слабый электролит.
Гидролиз соли – это разновидность ионообменной реакции. Реакция протекает в направлении, обратном реакции нейтрализации. Поэтому при гидролизе соли образуются кислота (или кислая соль) и основание (или основная соль), и обычно среда раствора становится соответственно щелочной или кислой. Будет ли соль подвергаться гидролизу и какое значение рН приобретет раствор, можно определить, зная силу кислот и оснований, которыми образована соль.
К сильным электролитам относят: а) практически все растворимые соли; б) кислоты: H2SO4, HNO3, HCl, HBr, HI, HClO4, HClO3, HMnO4, HCrO3; в) растворимые основания (щелочи) – гидроксиды металлов IA и IB групп периодической системы:
KOH, NaOH, LiOH, Ba(OH)2, Ca(OH)2. К слабым электролитам относят остальные кислоты и основания, воду и другие вещества.
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются (KCl, Na2SO4, Ba(NO3)2 и др.). Среда водного раствора остается нейтральной.
Если растворимая соль содержит хотя бы один ион слабого электролита (основания, кислоты), то такая соль обязательно подвергается гидролизу; характер среды при этом соответствует более сильному электролиту, образовавшему соль. То есть соль сильного основания и слабой кислоты дает щелочную среду, рН > 7 (Na2CO3, K2SO3, (CH3COO)2Ba и др.); соль слабого основания и сильной кислоты дает кислую среду, рН < 7 (AlCl3, Zn(NO3)2, CuSO4 и др.). Если оба электролита слабые, то в зависимости от того, какой из них сильнее, среда становится слабокислой, нейтральной или слабощелочной.
Напишем уравнения гидролиза. Обычно уравнения гидролиза записывают в трех формах: сокращенной ионной, ионной и молекулярной. Удобнее начинать с сокращенной ионной формы, которая отражает сущность процесса гидролиза – взаимодействие ионов соли с водой. Необходимо помнить, что в реакции участвуют ион слабого электролита и одна молекула воды (H+OH-).
1. Соли, образованные слабым основанием и сильной кислотой
хлорид аммония NH4Cl
NH4+ + H2O D NH4OH + H+
NH4+ + Cl- + H2O D NH4OH + H+ + Cl-
NH4Cl + H2O D NH4OH + HCl
хлорид алюминия AlCl3
Al3+ + H2O D AlOH2+ + H+
Al3+ + 3Cl- + H2O D AlOH2+ + H+ + 3Cl-
AlCl3 + H2O D AlOHCl2 + HCl
Обычно реакция гидролиза с участием многозарядного иона протекает по
более сложной схеме, включающей несколько стадий. Об этом следует помнить, но нет необходимости писать остальные стадии, так как первая достаточно полно характеризует процесс: образование иона Н+ указывает на кислую среду раствора, осадок Al(OH)3 не образуется, потому что гидролиз протекает преимущественно по первой стадии.
2. Соли, образованные

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!