ЗАНЯТИЕ 13
Тема: БАКТЕРИОФАГИ.
ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ БАКТЕРИОФАГОВ.
ГЕНЕТИКА МИКРООРГАНИЗМОВ.
МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЙ
В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Цель занятия: изучить строение и свойства вирулентных и умеренных бактериофагов, их взаимодействие с бактериальной клеткой, освоить качественные и количественные методы определения фагов.
Изучить фенотипическую и генотипическую изменчивость микроорганизмов, познакомиться с классификацией мутаций бактерий, оценить последствия изменчивости для бактериальных клеток. Познакомиться с процессами обмена генетической информацией у бактерий; изучить явления трансформации, коньюгации и трансдукции в бактериальных клетках; оценить роль умеренного бактериофага в переносе генетической информации, определить роль внехромосомных генетических элементов для бактерий, познакомиться с молекулярно-генетическими исследованиями
План занятия
1. Строение и свойства бактериофага.
2. Вирулентные и умеренные фаги. Их отличия, типы взаимодействия с микробной клеткой.
3. Взаимодействие вирулентного фага с бактериальной клеткой.
4. Умеренный бактериофаг. Явление лизогении и фаговой конверсии.
5. Применение бактериофага в практической медицине.
6. Качественные и количественные методы определения фагов. Методы выделения фага из объектов окружающей среды.
7. Фаготипирование бактерий.
8. Организация генетического материала бактерий. Репликация ДНК. Генотип и фенотип.
9. Изменчивость микроорганизмов и ее виды.
10. Модификации у бактерий.
11. Мутации у бактерий. Отличие мутаций от других видов изменчивости микроорганизмов. Классификация мутаций по происхождению, молекулярным механизмам и последствиям для бактериальной клетки.
12. Практическое использование учения о мутациях.
13. Рекомбинация – обмен генетической информацией.
14. Трансформация, ее механизм, основные этапы.
15. Коньюгация. Роль полового фактора. F+, F־, Hfr-клетки.
16. Трансдукция, ее механизм. Роль умеренного бактериофага.
17. Внехромосомные генетические структуры: строение, классификация, функции (плазмиды, транспозаны, Is-последовательности).
18. Молекулярно-биологические методы исследований в клинической практике (ПЦР, иммуноблотинг и др.)
19. Медицинская биотехнология.
20. Генетическая инженерия. Препараты медицинского и ветеринарного назначения полеченные методом генной инженерии.
Оформление протокола лабораторного занятия (выполнить дома)
1. Нарисовать бактериофаги, виды б/фагов, взаимодействие с бактериальной клеткой (рис. 13.1, 13.2)
2. Записать методику постановки фаготипирования, титрования фага по Аппельману, Грациа, метод Отто (принцип) и оставить место для фото демонстрационного посева и записи учета результата; для записи учета результата титрования фага по Аппельману нарисовать таблицу 13.2
3. Вклеить или нарисовать рис 5.4 из учебника А.А. Воробьева отражающий процессы трансформации, трансдукции и конъюгации (на схемах имеются 2 ошибки, попробовать их определить!!!) стр. 111
4. Записать после схемы понятия:
- конъюгация;
- трансдукция;
- трансформация;
5. Кратко законспектировать методику ПЦР. Применение (См Атлас Воробьёва и доп. материал).
Задания для выполнения лабораторной работы.
1. Изучить демонстрационные посевы, зафиксировать их (сфотографировать или нарисовать).
2. По качественным методам сделать вывод. По количественному методу Аппельмана дать заключение.
ДОПОЛНИТЕЛЬНЫЙ МАТЕРИАЛ
БАКТЕРИОФАГИ.
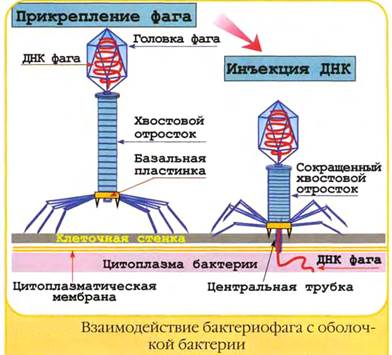
Рис 13.1 Взаимодействие бактериофага с оболочкой бактерии
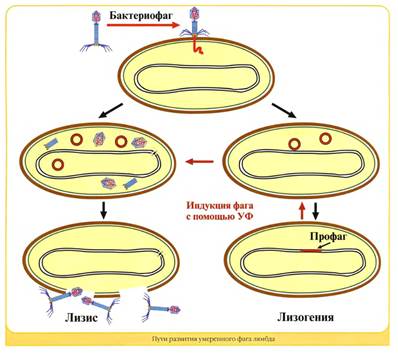
Рис 13.2. Развитие умеренного фага
Подготовка материала
Материалом, из которого выделяют фаг, обычно являются фильтраты, полученные с помощью бактериальных фильтров из объектов внешней среды, органов и выделений человека и животных, культур микроорганизмов и т. д.
Перед фильтрацией исследуемый материал подготавливают следующим образом:
Жидкости (кровь, мочу, воду, смывы с предметов и т. п.) освобождают от крупных частиц с помощью бумажного фильтра или центрифугированием, чтобы они не забили поры бактериального фильтра.
Вязкий материал (гной, кал) эмульгируют в изотоническом растворе натрия хлорида или бульоне, после чего освобождают от крупных частиц, как описано выше.
Плотный материал (кусочки органов, пищи и т. п.) предварительно измельчают - обычно растирают в ступке со стерильным кварцевым песком. Вместо песка можно использовать стерильные кончики пастеровских пипеток или битые покровные стекла. Растертый материал тщательно эмульгируют в изотоническом растворе натрия хлорида или бульоне и освобождают от крупной взвеси.
Подготовленный материал пропускают через бактериальный фильтр, освобождая от посторонней микрофлоры.
Культуры микроорганизмов (известные или изучаемые). В работе с фагом применяют 20-24-часовые культуры, выращенные на агаре, или 2-6-часовые культуры в жидких средах. Чистоту культуры устанавливают в мазках, окрашенных фуксином Пфейффера или по Граму. Из культур, выращенных на скошенном агаре, готовят взвесь. В пробирку с культурой наливают 3-5 мл изотонического раствора натрия хлорида. Вращая пробирку между ладонями, осторожно смывают культуру с поверхности среды так, чтобы не намочить пробку. Взвесь переносят в стерильную пробирку и разводят изотоническим раствором натрия хлорида 1:10 (0,5 мл взвеси в 4,5 мл раствора).
При работе с фагом необходима стерильная посуда (градуированные и пастеровские пипетки, чашки Петри, пробирки, колбы, ступки), термостат, фильтровальное устройство, центрифуга, штативы, прибор для счета колоний.
Внимание! Вся работа с фагом требует соблюдения асептики.
Качественные методы
О наличии фага в том или ином субстрате узнают по лизису чувствительной к нему микробной культуры (тест-культура).
Обнаружение фага на плотных средах. Тест-культуру засевают "газоном" (см. главу 7) на поверхность агара в чашке Петри. Посев подсушивают в термостате 30-40 мин при открытой крышке, после чего на него наносят каплю изучаемого материала. Через несколько минут, когда жидкость впитается, чашки помещают в термостат на 18-20 ч. Если в изучаемом материале есть фаг, произойдет лизис культуры и на месте, куда была нанесена капля, культура или совсем не вырастет (сплошной лизис) или образуются отдельные колонии фага.
Обнаружение фага в жидких средах. В две пробирки с одинаковым количеством бульона вносят по одной капле культуры, микроба, в отношении которого изучают фаг. В одну из них добавляют исследуемый фаг или фильтрат материала, в котором его определяют. Вторая пробирка служит контролем роста культуры. Пробирки помещают в термостат на 12-20 ч. Учет результатов производят только при наличии роста культуры в контроле (помутнение среды). Отсутствие видимого роста или последующее просветление среды в пробирке с исследуемым материалом свидетельствует о присутствии фага. Если содержимое этой пробирки мутное, исследование необходимо дополнить посевом на плотную среду: помутнение могло произойти от роста устойчивой к фагу культуры. Только в том случае, если в посеве на агар фаг не будет обнаружен, можно сделать вывод, что его нет в изучаемом материале.
Количественные методы
Количественные методы имеют большое значение при проведении многих исследований, в том числе и фага. Врачу нужно знать активность фага, чтобы правильно установить его дозу при лечебно-профилактическом применении, исследователю - чтобы выяснить, как изменяется активность фага в эксперименте.
Активность фага выражают понятием титр, различая титр фага в жидкой и на плотной среде.
При исследовании в жидкой среде (по Аппельману) титр фага - это наибольшее его разведение (или наименьшее количество), которое подавляет рост тест-культуры в условиях данного опыта.
На плотной среде (титрование по Грациа) титр фага - количество частиц (корпускул) фага в 1 мл исходного материала.
Титрование фага по Аппельману (в жидкой среде). При титровании фага объем и состав среды, температура, аэрация, количество микробов, пробирки, в которых проводят титрование (диаметр, конфигурация дна, толщина стекла), должны быть одинаковыми. Изменяется только количество фага.
Все компоненты, участвующие в биологических опытах, подлежат обязательному контролю на правильность их работы.
При титровании фага ставят контроль фага и бульона на стерильность, контроль культуры - на ее жизнеспособность.
Постановка опыта. 1. В 12 стерильных пробирок наливают по 4,5 мл стерильного бульона. Уровень жидкости во всех пробирках должен быть одинаковым. Если это не так, значит допущена ошибка. В этом случае нестандартную пробирку заменяют новой и заново наполняют бульоном. При разливе бульона пользуются пипетками вместимостью 5-10 мл.
2. Пробирки ставят в штатив и нумеруют от 1 до 10, на одной из оставшихся пробирок пишут "КК" (контроль культуры), на другой - "КФ" (контроль фага). Все пробирки, в которых проводят опыт, должны быть надписаны.
3. В десяти пробирках готовят последовательные десятикратные разведения фага от 10-1 до 10-10 (табл. 13.2). В 1-ю пробирку вносят 0,5 мл фага. Такое же количество вносят в пробирку контроля фага. Сменив пипетку, новой пипеткой тщательно перемешивают содержимое 1-й пробирки и переносят 0,5 мл его во 2-ю пробирку; 0,5 мл содержимого 2-й пробирки переносят в 3-ю и так далее до 10-й пробирки, меняя каждый раз пипетки. Перемешав содержимое 10-й пробирки, 0,5 мл жидкости из нее выливают в дезинфицирующий раствор. Также поступают с содержимым пробирки контроля фага. Для разведения фага пользуются пипетками вместимостью 1-2 мл. Проверяют уровень жидкости в пробирках. Он должен быть одинаковым.
Методы выделения фагов
Прямой метод. Фаг получают и изучают непосредственно в фильтратах исследуемого материала. О наличии и активности фага узнают по лизису чувствительной к нему культуры.
Как правило, прямой метод не дает убедительных результатов из-за малого количества содержащегося в фильтрате фага. Для повышения его количества используют методы обогащения.
Метод обогащения. Подготовленный фильтрат вносят в 2-3-часовую бульонную культуру соответствующих микроорганизмов. Посев инкубируют в термостате. Фаг размножается в клетках культуры и титр его значительно увеличивается. После этого бульон фильтруют и в фильтрате определяют свойства и активность фага.
Препараты фагов
При производственном получении препаратов фага пользуются хорошо изученными штаммами микроорганизмов и фагов, которые обычно выращивают в реакторах, что позволяет получать большие количества фаголизата.
Фаги выпускают в жидком виде (ампулы и флаконы), в таблетках и свечах. Таблетки фагов, предназначенные для применения через рот, покрыты кислотоустойчивой оболочкой, защищающей фаги от действия соляной кислоты желудочного сока.
Все препараты фагов подлежат обязательному контролю на отсутствие посторонней флоры, безвредность и активность (титр), который осуществляется на выпускающем их производстве. Выборочный контроль производят в Государственном НИИ стандартизации и контроля медицинс-ких биологических препаратов им. Л. А. Тарасевича. Выпускаемый фаг снабжен этикеткой, на которой указано: учреждение, его выпускающее, название фага, серия, номер контроля и срок годности. Каждая упаковка снабжена наставлением по применению и хранению фага. 
ГЕНЕТИКА МИКРООРГАНИЗМОВ.
Опыт по изучению феномена роения Proteus mirabilis на питательном агаре и на агаре с 1% сухой желчью в чашках Петри.
Выявление фенотипической изменчивости можно провести в опыте с феноменом роения у Proteus mirabilis. Сначала изучают колонии бактерий рода Proteus, выросшие на питательном агаре в чашке Петри через 24 ч после посева разведенной культуры. Отмечают, что все колонии протея окружены «зоной роения». Пересевают колонии петлей на поверхность агара с 1% желчью в чашках Петри и инкубируют при 370С 18-24 ч. Все колонии протея, выросшие на питательном агаре с желчью, не имеют «зон роения». Вновь пересевают колонию в чашку Петри с питательным агаром и инкубируют при 370С 18-24 ч. Наблюдают, что все колонии, выросшие на питательном агаре, окружены «зоной роения».
Изменение фенотипа протея на питательной среде с желчью (утрату роения) следует считать модификацией, т.к. налицо все три ее отличительных признака: определенность (связь отсутствия роения с определенным фактором – желчью), общность изменений (утрата роения наблюдается у всех колоний популяции), обратимость (при отсутствии желчи в питательной среде восстанавливается исходный фенотип).




Рис.11. Феномен роения Proteus mirabilis на чашке Петри с МПА
Рис. 12. Феномен роения отсутствует на чашке Петри с МПА и 1% желчью
ЗАНЯТИЕ 13
Тема: БАКТЕРИОФАГИ.
ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ БАКТЕРИОФАГОВ.
ГЕНЕТИКА МИКРООРГАНИЗМОВ.
















