Вопрос 31(Определение жесткости воды трилонометрическим методом)
А. Определение нормальности трилона Б производится по стандартному 0,05 н раствору MgSO4.
· В коническую колбу отмерить пипеткой 15 мл 0,05 н раствора MgS04, добавить 85 мл дистиллированной воды (до 100 мл мерным цилиндром), прилить 5 мл аммиачного буферного раствора и 5 капель индикатора хромогена черного, после чего провести титрование раствором трилона Б.
· Пробу титровать до появления голубой окраски от одной прилитой капли трилона Б, что свидетельствует об исчезновении ионов Mg2+.
Дальнейшее прибавление трилона Б не изменяет голубой окраски раствора, поэтому следует внимательно следить за постепенным изменением окраски от винно-красной через переходные окраски (фиолетовую, грязно-синюю) до голубой.
Титрование провести дважды.
· Рассчитать поправочный коэффициент к нормальности трилона Б рассчитать по формуле
К = (nмлMgSO4) /(пмлтрилона Б).
где n – количество использованного раствора, мл.
Б. Определение общей жесткости пробы трилонометрическим методом.
· Пипеткой отмерить 100 мл испытуемой воды в коническую колбу, добавить буферный раствор и индикатор (в том же количестве, что и при определении поправочного коэффициента) и титровать раствором трилона Б. Определение повторить и взять средний результат.
· Вычисление общей жесткости в мг-экв/л произвести по формуле
Нобщ мг-экв/л = (n*N*K*1000) / V,
где n - количество трилона Б, израсходованное на титрование, в мл; К - поправочный коэффициент к нормальности трилона Б; V - объем пробы, в мл; N - нормальность трилона Б.
Вопрос 33(Определение активности ионов водорода(рН показатель)
Под водородным показателем среды понимают наличие свободных, активных ионов водорода. Концентрацию их принято выражать значением рН от 1 до 14.
Значение рН 7 соответствует нейтральной среде, меньше 7 - кислой, больше 7 - щелочной.
Значение рН определяют электрометрическим и колориметрическими методами.
Для ориентировочного определения рН воды применяют различные индикаторные (лакмусовые) бумажки, а также универсальный индикатор со шкалой сравнения.
В полевых условиях реакцию (рН) воды определяют по изменению цвета лакмусовой бумажки. Посинение красной лакмусовой бумажки - означает, что реакция щелочная (рН > 7,0), покраснение синей - реакция кислая (рН < 7,0).
Для анализа с универсальным индикатором в пробирку, предварительно ополоснутую исследуемой водой, наливают 3-5 мл пробы и добавляют 2-3 капли индикатора. Содержимое перемешивают и по цвету раствора определяют значение рН:
Красно-розовый - 2,
Красно-оранжевый - 3,
Оранжевый - 4,
Желто-оранжевый - 5,
Лимонно-желтый - 6,
Желто-зеленый - 7,
Зеленый - 8,
Сине-зеленый - 9,
Фиолетовый - 10,
По саннормативу рН питьевой воды должен быть в пределах 6,0-9,0.
Способы определения: Лакмусовая бумага и Ph Метр, второй же наиболее точный способ определения уровня ph – с помощью ph метра. Эти приборы стоят дороже, нежели лакмусовая бумага, но обеспечивают точность измерений вплоть до сотых!
Рh метры делятся на бытовые (портативные) и лабораторные. Так как в основном используются бытовые Ph метры, их мы и рассмотрим. Различаются они:
1. степенью защиты от воды
2. автоматическая калибровка или нет
3. точностью.
В 45(расчет количества реагентов на проведение регенерации)
расчет необходимых объёмов (мл) растворов компонентов водной фазы, проводят по формуле (1.1):
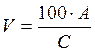 , (1.1)
, (1.1)
где А - необходимое количество реагента, г; С - концентрация растворов реагентов в % маc., приготовленных.
Поскольку некоторое количество воды вносится с растворами компонентов водной фазы, объем дистиллированной воды, необходимой для введения в одну ампулу, оказывается меньше.
Так как растворы хлорида калия, сульфата железа, ронгалита и трилона Б имеют низкие концентрации, без большой ошибки объем вносимой с ними воды можно приравнять к объемам самих растворов.
Вопрос 31(Определение жесткости воды трилонометрическим методом)
А. Определение нормальности трилона Б производится по стандартному 0,05 н раствору MgSO4.
· В коническую колбу отмерить пипеткой 15 мл 0,05 н раствора MgS04, добавить 85 мл дистиллированной воды (до 100 мл мерным цилиндром), прилить 5 мл аммиачного буферного раствора и 5 капель индикатора хромогена черного, после чего провести титрование раствором трилона Б.
· Пробу титровать до появления голубой окраски от одной прилитой капли трилона Б, что свидетельствует об исчезновении ионов Mg2+.
Дальнейшее прибавление трилона Б не изменяет голубой окраски раствора, поэтому следует внимательно следить за постепенным изменением окраски от винно-красной через переходные окраски (фиолетовую, грязно-синюю) до голубой.
Титрование провести дважды.
· Рассчитать поправочный коэффициент к нормальности трилона Б рассчитать по формуле
К = (nмлMgSO4) /(пмлтрилона Б).
где n – количество использованного раствора, мл.
Б. Определение общей жесткости пробы трилонометрическим методом.
· Пипеткой отмерить 100 мл испытуемой воды в коническую колбу, добавить буферный раствор и индикатор (в том же количестве, что и при определении поправочного коэффициента) и титровать раствором трилона Б. Определение повторить и взять средний результат.
· Вычисление общей жесткости в мг-экв/л произвести по формуле
Нобщ мг-экв/л = (n*N*K*1000) / V,
где n - количество трилона Б, израсходованное на титрование, в мл; К - поправочный коэффициент к нормальности трилона Б; V - объем пробы, в мл; N - нормальность трилона Б.



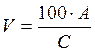 , (1.1)
, (1.1)


