Химическая связь – это взаимодействие(притяжение) частиц. Природа химической связи различна, но при образовании связи атомы стремятся приобрести устойчивую восьмиэлектронную (октет) или двухэлектронную (дуплет) внешние оболочки. В зависимости от того, как происходит обмен электронами, различают следующие виды химической связи:
- ковалентная
- ионная
- металлическая
- водородная.
В процессе химического взаимодействия атомы с незавершенными внешними электронными уровнями завершают их и приобретают устойчивую электронную конфигурацию.
Ковалентная связь
Ковалентная связь возникает между атомами с одинаковыми или близкими электроотрицательностями. Электроотрицательность – это свойство атомов оттягивать к себе электроны от других атомов. При взаимодействии таких атомов полного перехода электронов к одному из атомов не происходит, связь осуществляется за счет образования общей пары электронов, одновременно принадлежащих обоим атомам. Ковалентная связь – это связь между атомами, которая осуществляется за счет образования общей пары электронов.
Различают две разновидности ковалентной связи: неполярную и полярную.
Неполярная ковалентная связь возникает при взаимодействии двух одинаковых атомов с образованием двухатомных молекул Н2, Сl2, N2, F2 и др. Рассмотрим взаимодействие двух атомов хлора при образовании молекулы С12. Валентные электроны условно изображают точками:
........
: Cl ∙ + ∙ Cl: →: Cl: Cl:
........
Неспаренные электроны Общая пара электронов.
Каждый атом хлора имеет семь электронов на последнем уровне: три неподеленные пары и один неспаренный электрон. При взаимодействии атомов хлора друг с другом каждый из них приобретает один электрон до устойчивой восьмиэлектроннной конфигурации. Неспаренные электроны с противоположными спинами связываются в общую пару электронов. Общее электронное облако располагается на одинаковом расстоянии от атомных ядер. Электромагнитное поле такой молекулы симметрично, полюсов нет. Ковалентная неполярная связь возникает между атомами с одинаковой электоотрицательностью.
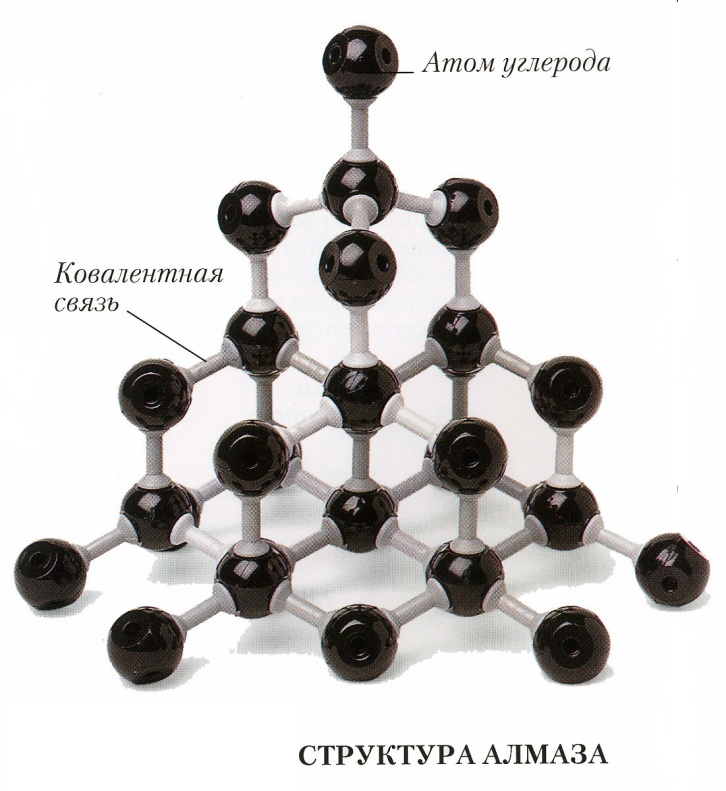 Вещества с ковалентной неполярной связьюмогут существовать в форме молекул (например, водород Н2, кислород О2,). Но также вещества с ковалентной неполярной связью могут образовывать атомные кристаллические решетки (кремний, углерод – алмаз, графит, фуллерены, графен)).
Вещества с ковалентной неполярной связьюмогут существовать в форме молекул (например, водород Н2, кислород О2,). Но также вещества с ковалентной неполярной связью могут образовывать атомные кристаллические решетки (кремний, углерод – алмаз, графит, фуллерены, графен)).
Полярная ковалентная связь образуется при взаимодействии атомов с различной электроотрицательностью, например, атомов водорода и хлора:
....
Н ∙ + ∙Cl: → Н: Cl:
....
Неспаренные электроны Общая пара электронов.
В этом случае общая электронная пара смещена к атому с большей электроотрицательностью – хлору. Вследствие смещения электронной пары у атома хлора возникает частичный отрицательный заряд, а у атома водорода – частичный положительный. Создаются полюса. Ковалентная полярная связь возникает между атомами с разной электроотрицательностью.
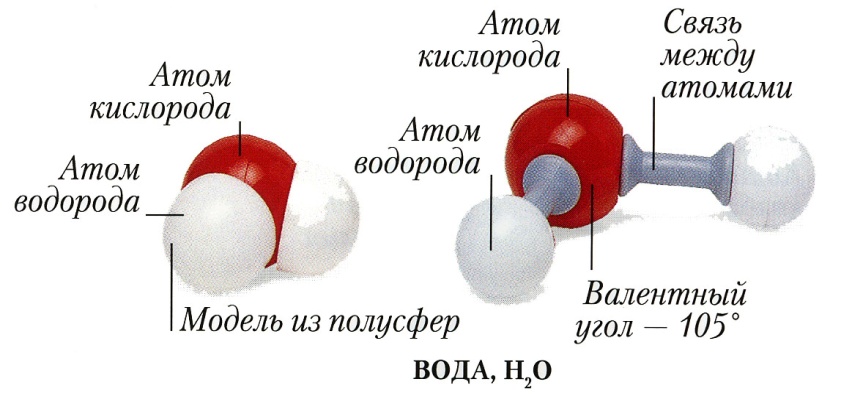 Молекула, у которой имеются два полюса, называется диполь.
Молекула, у которой имеются два полюса, называется диполь.
Вещества с ковалентной полярной связьюмогут существовать в форме молекул (например, вода Н2О, серная кислота Н2SО4), а также могут образовывать атомные кристаллические решетки (оксид кремния(кварц) SiO2, оксид бериллия BeO).
Ионная связь
Ионная связь возникает между атомами элементов, резко отличающихся по величине электроотрицательности. Так, например, при взаимодействии атомов натрия и хлора электроотрицательности которых значительно отличаются, электрон полностью переходит к более электроотрицательному атому хлора. Атомы при этом превращаются в ионы. Ионы – это заряженные частицы, образованные из атомов в результате отдачи или принятия электронов.
Атом металла натрия легко теряет один наружный электрон, превращаясь в положительно заряженный ион (катион):
+11Na0)2е)8е)1е → +11Na+)2е)8е
Na0 – 1е→ Na+
Атом неметалла хлора присоединяет один электрон, превращаясь в отрицательно заряженный ион (анион):

+17Cl0)2е)8е)7е →+17Cl‒)2е)8е)8е
Cl0 + 1е →Cl–
Каждый из ионов при этом приобретает устойчивую восьмиэлектронную конфигурацию. Между ионами Na+ и С1─ возникают силы электростатического притяжения, в результате чего образуется соединение NaCl:
Na+ + Cl‒ = NaCl
Таким образом, ионная связь – это связь между ионами, возникающая за счет электростатического притяжения между ними. Соединения, которые образуются путем притяжения ионов, называются ионными. Они существуют в форме ионной кристаллической решетки. Ионные соединения образуются между элементами главных подгрупп I и II групп и элементами главных подгрупп VI и VII групп, то есть между ярко выраженными металлами и ярко выраженными неметаллами.
Металлическая связь
Металлическая связь существует внутри кристаллической решетки простых веществ – металлов. Атомы металлов обладают способностью легко терять внешние электроны и превращаться в положительно заряженные ионы (катионы). Катионы металлов находятся в узлах металлической кристаллической решетки, а отделившиеся (свободные) электроны находятся в пространстве между ними, свободно перемещаясь. Именно свободные электроны обеспечивают связь между катионами металлической кристаллической решетки.
 Металлическая связь – это связь между катионами металлической кристаллической решетки, которая осуществляется при помощи свободных электронов
Металлическая связь – это связь между катионами металлической кристаллической решетки, которая осуществляется при помощи свободных электронов
Именно металлическая связь за счет наличия свободных электронов (электронного газа) является причиной общих физических свойств всех металлов. Эти свойства:
– металлический блеск
– электропроводность
– высокая теплопроводность
– пластичность (ковкость)
Водородная связь
Водородная связь возникает между отдельными молекулами, или между частями большой молекулы. Водородная связь осуществляется за счет слабого притяжения между атомами водорода одной молекулы и атомами сильно электроотрицательного элемента другой молекулы. Несмотря на то, что водородная связь слабее других видов химической связи, от неё зависят важнейшие свойства таких веществ, как, например, вода, спирты, белки и др.
Вопросы для самопроверки.
1. Что такое химическая связь?
2. Дайте определение ковалентной связи.
3. Охарактеризуйте неполярную и полярную ковалентную связь.
4. Дайте определение ионной связи.
5. В чем сходство и в чем различие между ковалентной и ионной связью?
6. Определите вид химической связи в веществах: серная кислота, фторид калия, кремний, хлорид бария, углекислый газ, азот, сероводород.
Урок 21
ВОДНЫЕ РАСТВОРЫ

Растворы
– это однородные (гомогенные) системы, состоящие из двух и более компонентов (составных частей) и продуктов их взаимодействия. Могут существовать растворы твердых, жидких и газообразных веществ в жидких растворителях, а также однородные смеси (растворы) твердых жидких и газообразных веществ.
Растворитель
– это вещество, в котором растворены другие вещества. Если растворитель – вода, говорят о водных растворах. Далее речь пойдет именно о водных растворах. Водные растворы имеют огромное значение в природе и технике. Многие химические реакции протекают в растворах.
Важной характеристикой любого раствора является его состав. Содержание растворенного вещества (в определенных единицах) в единице массы или объема раствора называют концентрацией.
Существуют различные способы численного выражения концентрации: массовая доля растворенного вещества, молярная концентрация и др.



 Вещества с ковалентной неполярной связьюмогут существовать в форме молекул (например, водород Н2, кислород О2,). Но также вещества с ковалентной неполярной связью могут образовывать атомные кристаллические решетки (кремний, углерод – алмаз, графит, фуллерены, графен)).
Вещества с ковалентной неполярной связьюмогут существовать в форме молекул (например, водород Н2, кислород О2,). Но также вещества с ковалентной неполярной связью могут образовывать атомные кристаллические решетки (кремний, углерод – алмаз, графит, фуллерены, графен)). Молекула, у которой имеются два полюса, называется диполь.
Молекула, у которой имеются два полюса, называется диполь.
 Металлическая связь – это связь между катионами металлической кристаллической решетки, которая осуществляется при помощи свободных электронов
Металлическая связь – это связь между катионами металлической кристаллической решетки, которая осуществляется при помощи свободных электронов



