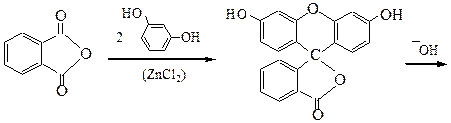МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
Государственное образовательное учреждение
высшего профессионального образования
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ПРИКЛАДНОЙ БИОТЕХНОЛОГИИ
(МГУПБ)
Кафедра органической химии
С.А. ЯНКОВСКИЙ, В.В. КОЛПАКОВА, Г.Х. КУДРЯКОВА
Органическая химия
ОРГАНИЧЕСКАЯ ХИМИЯ
В СХЕМАХ И ТАБЛИЦАХ
Учебно-методическое пособие для студентов специальностей
260301, 260302, 260303, 260501, 260505, 240502, 261201, 240901,
240902, 020803, 110501, 111201, 280102, 080502, 080115, 280102
и подготовки бакалавров по направлениям 110501, 260100
МОСКВА 2010
УДК 547
ББК 24.2
Я 60
Рецензенты: Е.Н. Олсуфьева, д-р хим. наук, ведущий научный сотрудник
ГУ НИИНА АМН РФ;
А.П. Нечаев, д-р техн. наук, заслуженный деятель науки РФ, профессор кафедры «Органическая и пищевая химия» МГУПП
С.А. Янковский
Органическая химия в схемах и таблицах / С.А. Янковский; В.В. Колпакова; Г.Х. Кудрякова. – М.: МГУПБ, 2010 – 170 с.
Под редакцией В.В. Колпаковой
В учебно-методическом пособии в наглядной форме в виде схем и таблиц представлены основные разделы лекционного курса органической химии (строение, реакционная способность, физические и химические свойства различных классов соединений и их производных, методы синтеза) и справочный материал. Пособие предназначено для студентов всех факультетов и специальностей при выполнении домашних заданий и самостоятельной подготовке к коллоквиумам, контрольным работам, практическим и лабораторным занятиям.
Утверждены УМО МГУПБ в качестве учебно-методического пособия.
© МГУПБ, 2010
ВВЕДЕНИЕ
Пособие составлено в соответствии с рабочими программами курсов «Органическая химия», «Органическая химия и химия биологически-активных соединений», «Химия природных соединений», читаемых для студентов технологических специальностей МГУПБ. Оно предназначено помочь студентам в усвоении лекционного курса дисциплины.
Пособие состоит из 17 разделов, большинство из которых посвящено основным классам органических соединений и, используя строгую классификацию материала, вмещает большой объем информации – основные понятия, закономерности физических свойств и химических превращений, механизмы основных реакций, большой справочный материал.
По каждому разделу акцент сделан на самые важные стороны химических превращений, опущены малосущественные и не слишком характерные свойства, причем эти сведения изложены в простой, лаконичной форме. Однотипная схема характеристики органических веществ и большое количество таблиц обзорного и обобщающего характера позволит учащимся лучше понять и запомнить закономерности в изменениях свойств и общие химические свойства органических соединений каждого класса. Это наглядный краткий конспект, в котором легко ориентироваться, пользуясь жесткой классификацией материала, развитой системой заголовков и шрифтовых выделений, а также обстоятельным оглавлением в конце.
Пособие рассчитано удовлетворить разнообразные потребности пользователей, начиная от получения кратких первичных сведений общего характера и кратких сведений по классификации и номенклатуре органических соединений (раздел 1), наведения разовых справок и кончая последовательным ознакомлением с материалом. Последние разделы пособия учитывают специфику требований по органической химии, предъявляемых выпускающими кафедрами вуза и предназначены для магистров и дипломников, выполняющих научно-исследовательскую работу в лабораториях МГУПБ. Поэтому особое внимание уделено описанию свойств природных, биологически-активных и других органических веществ, которые компонентами пищевых продуктов или используются при их производстве в качестве разнообразных добавок. Также приводятся данные по спектральной и химической идентификации веществ, необходимые при проведении анализа или определения соответствия показателей составов продукции ГОСТам.
Терминология, определения и обозначения приведены в соответствии с используемыми в отечественной химической литературе.
Пособие оформлено таким образом, чтобы, по возможности, каждому отдельному вопросу соответствовала отдельная страница. Это дает возможность тиражирования для использования в качестве иллюстративного дополнения к конспектам лекций или для демонстрации на аудиторных занятиях в виде слайдов.
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
| Углерод, водород
| При нагревании органического вещества с избытком окислителя (оксид меди) в процессе окислительной деструкции углерод превращается в углекислый газ, водород - в воду:
[С] + 2СuО ¾® СО2 + 2Сu; [2Н] + СuО ¾® Н2O + Сu
СО2идентифицируют по помутнению раствора Ва(ОН)2;
Н2О -по посинению бесцветного порошка безводного сульфата меди
|
| Азот
| Проба Лассеня:вещество сплавляют с натрием; экстрагируют водой и кипятят с раствором FeSO4(образуется NaOH при взаимодействии избытка натрия с водой); охлаждают и добавляют раствор FeCl3и избыток соляной кислоты - образуется синий осадок берлинской лазури:
Na + [С] + [N] ¾® NaCN
FeSO4 + NaOH ¾® Fe(OH)2 ¯ + Na2SO4
6 NaCN + Fe(OH)2 ¾® Na4[Fe(CN)6] + 2 NaOH
Na4[Fe(CN)6] + FeCl3 ¾® NaFe [Fe(CN)6] ¯ + 3 NaCl
берлинская лазурь
Другой метод заключается в последовательной обработке цианида натрия полисульфидом аммония и FeCl3 с появлением красного окрашивания:
NaCN + (NH4)2Sx ¾® NaSCN + (NH4)2Sx –1
6 NaSCN + FeCl3 ¾® Na3[Fe(SCN)6] + 3 NaCl
|
| Сера
| Вещество сплавляют с натрием; сульфид-анион обнаруживают реакцией с ацетатом свинца (образуется черный осадок сульфида свинца) или по появлению фиолетовой окраски при действии нитропруссида натрия.
2 Na + [S] ¾® Na2S
(CH3COO)2Pb + Na2S ¾® 2 CH3COONa + PbS↓
Na2S + Na2 [Fe(CN)5 (NО)] ¾® Na4[Fe(CN)5 (NОS)]
Органическое вещество разрушают нагреванием со смесью KNO3 и Na2CO3. Сера окисляется до SO42-, который идентифицируют по образованию белого осадка cульфата бария, нерастворимого в кислотах:
Na2CO3 + [S] + 3 [О] ¾® Na2SO4 + СО2
ВаС12 + Na2SO4 ¾® 2 NaCl + BaSO4 ¯
|
| Галогены
| Вещество сплавляют с натрием;водный экстракт обрабатываютAgNO3 -образуются осадки галогенидов серебра: хлорида(белый, растворяется в NH4OH), бромида(желтый, плохо растворяется в NH4OH), йодида(темно-желтый, нерастворим в NH4OH). Проба Бейльштейна: медная проволока, смоченная органическим галогенидом, при внесении в бесцветное пламя горелки окрашивает его в сине-зеленый цвет.
|
ТИПЫ ИЗОМЕРИИ
| Отношение к взаимопереходу
(в норм. усл.)
| Структурная изомерия
| Пространственная изомерия
|
| | Изомерия углеродного скелета


| Геометрическая

 цис- транс-
цис- транс-
|
| Статическая (устойчивы)
| Положения кратной связи (функциональной группы)


| Оптическая

|
| | Функциональной группы

|
S-конфигурация R-конфигурация
|
| Динамическая
(в равновесии)
| Таутомерия

| Конформационная
 заслоненная и заторможенная конформации этана
заслоненная и заторможенная конформации этана
|
СТЕРЕОИЗОМЕРЫ
| Оптическая активность –способность веществавращать плоскостьплоскополяризо-ванного света. Вещество должно быть хиральным и содержать один из энантиомеров в избытке.
|
| Хиральный атом(стереоцентр, асимметрический атом) – атом, связанный с четырьмя различными заместителями
|
| Энантиомеры – стереоизомеры являющиеся несовместимыми зеркальными изображениями; имеют одинаковые абсолютные величины углов оптического вращения, но противоположные по знаку.
Энантиомер, вращающий плоскость поляризованного света вправо, назывется правовращающим энантиомером и обозначается (+), влево – левовращающими обозначается (–).
|
 D -глюкоза L- глюкоза L -аланин D -аланин D -глюкоза L- глюкоза L -аланин D -аланин
|
|
| Рацемат –смесь, состоящая из эквимольных количеств обоих энантиомеров
|
Диастереомеры– стереоизомеры, молекулы которых не являются зеркальными изображениями друг друга (энантиомерами). Диастереомеры, в отличие от энантиомеров, имеют различные физические свойства и различные величины удельного вращения. Так, в D-ряду имеются четыре диастереомерных тетрозы

|
Мезо-соединения – содержат более одного асимметрического атома углерода и имеют плоскость симметрии, разделяющую молекулу на две половины, являющиеся зеркальными отображениями друг друга; оптически неактивны.

|
трео- Форма – стереоизомер, имеющий два стереоцентра и существующий в виде пары энантиомеров. В проекционной формуле Фишераимеет два одинаковых заместителя по разные стороны.

| эритро -Форма –стереоизомер, имеющий два стерео-центра и существующий в виде пары энантиомеров. В проекционной форме Фишера имеет два одинаковых заместителя по одну сторону.
| |
ПРИ ХИРАЛЬНОМ ЦЕНТРЕ
| Номер, группа
| Формула
| | Номер, группа
| формула
|
|
1. Водород
2. Метил
3. Этил
4. Пропил
5. Бутил
6. Пентил
7. Изопентил
8. Изобутил
9. Аллил
10. Неопентил
11.2-пропинил
(пропаргил)
12. бензил
13. изопропил
14. винил
15. вторбутил
16. циклогексил
17. 1-пропенил
18. третбутил
19. изопропенил
20. этинил
21. фенил
22. формил
23. ацетил
24. бензоил
25. карбокси
26. метоксикарбо-
нил
27. этоксикарбо-
нил
|
-H
-CH3
-C2H5
-CH2CH2CH3
-CH2CH2CH2CH3
-CH2(CH2)3CH3
-CH2CH2CH(CH3)2
-CH2CH(CH3)2
-CH2CH=CH2
-CH2C(CH3)3
-CH2CºCH
-СH2C6H5
-CH(CH3)2
-CH=CH2
-CH(CH3)CH2CH3
-C6H11
-CH=CHCH3
-C(CH3)3
-C(CH3)=CH2
-CºCH
-C6H5
-CHO
-C(O)CH3
-C(O)C6H5
-COOH
-COOCH3
-COOC2H5
|
|
28.Бензилокси-
карбонил
29.третбутилок - сикарбонил
30. Амино
31.Аммонио
32.Метиламино
33. Этиламино
34.Фениламино35Ацетиламино
36. Бензоил-
амино
37. Диметил-
амино
38.Диэтиламино
39. Триметил-
аммонио
40. Нитрозо
41. Нитро
42. Гидрокси
43. Метокси
44. Этокси
45. Бензилокси
46. Фенокси
47. Ацетокси
48.Бензоилокси
49. Фтор
50. Меркапто
51. Метилтио
52. Сульфо
53. Хлор
54. Бром
55. Иод
|
-СOOCH2C6H5
-COOC(CH3)3
-NH2
-N+H3
-NHCH3
-NHC2H5
-NHC6H5
-NHC(O)CH3
-NHC(O)C6H5
-N(CH3)2
-N(C2H5)2
-N+(CH3)3
-NO
-NO2
-OH
-OCH3
-OC2H5
-OCH2C6H5
-OC6H5
-OC(O)CH3
-OC(O)CH2C6H5
-F
-SH
-SCH3
-SO3H
-Cl
-Br
-I
|
АЛКАНЫ И ЦИКЛОАЛКАНЫ
ХЛОРИРОВАНИЕ АЛКАНОВ

Возникновение асимметрического атома углерода. Хлор присоединяется с любой стороны плоского свободного радикала по двум направлениям с образованием энантиомеров в равных количествах.
ХИМИЧЕСКИЕ РЕАКЦИИ МЕТАНА

Метан – первый член гомологического ряда алканов, наиболее устойчив к химическому взаимодействию.
Подобно другим алканам, вступает в реакции радикального замещения SR (галогенирование, нитрование, сульфохлорирование).
На воздухе образует взрывоопасные смеси, что является основной причиной взрывов на угольных шахтах.
Применение: получение синтез-газа, ацетилена, технического углерода, синильной кислоты, нитрометана, хлоропроизводных, фреонов.
КОНФОРМАЦИИ ЭТАНА
Атомы углерода, связанные одинарной s-связью, свободно вращаются относительно друг друга. Для молекулы этана (СН3-СН3) возможно бесконечное число различных расположений атомов водорода в пространстве. Незакрепленные, постоянно меняющиеся расположения атомов в пространстве называются конформациями и ихизображают проекциями Ньюмена.
Конформации отличаются потенциальной энергией (Е), т.к. атомы Н и связи С-Н отталкиваются тем сильнее, чем ближе они находятся друг к другу. Из бесконечного числа конформаций выделяют две:
заслоненная конформация, обладающая максимальной энергией, когда атомы Н при различных атомах С наиболее приближены друг к другу;
заторможенная конформация, обладающая минимальной энергией, в которой эти атомы максимально удалены друг от друга.

двугранный угол, град.
Разница в ~12 кДж/моль велика для утверждения того, что в данный момент времени абсолютное большинство молекул этана находятся в заторможенной конформации; эта величина и слишком мала, чтобы препятствовать вращению одной метильной группы относительно другой.
КОНФОРМАЦИИ БУТАНА
Молекула БУТАНА имеет больше конформаций, чем этан. Наибольшую разность энергий имеют конформации, возникающие при вращении относительно друг друга атомов С2 и С3. СН3- группы сильнее отталкиваются друг от друга, чем атомы водорода, поэтому разность энергий между заслоненной и заторможенной конформациями больше, чем у этана (20 кДж/моль). Выделяют скошенную конформацию,когда метильные группы удалены друг от друга, но находятся ближе, чем в заторможенной конформации.

КОНФОРМАЦИИ ЦИКЛОГЕКСАНА,
АЛКЕНЫ, ДИЕНЫ
Цис-транс-номенклатура
Цис-изомеры – геометрические изомеры, в которых заместители, образующие главную углеродную цепь в молекуле вещества, расположены по одну сторону относительно двойной связи или плоскости цикла.

цис-гептен-3 цис-1,2-диметилциклопропан
Транс-изомеры – геометрические изомеры, в которых заместители, образующие главную углеродную цепь в молекуле вещества, расположены по разные стороны относительно двойной связи или плоскости цикла.

транс-2-метилгексен-3 транс-1,2-диметилциклопен тан
Е, Z-номенклатура
Старшинство групп определяется атомным номером элемента, атом которого связан с С-атомом при двойной связи, а при одном и том же элементе атомными номерами следующих элементов вдоль цепи заместителя (I > Br > Cl > F > OCH3 > OH > NH2 > COOH > CHO > CH2OH > CN > C6H5 > CºCH > CH=CH2 > CH2CH3 > CH3 > H). Если старшая группа (или атом) при одном винильном атоме углерода находится по одну сторону со старшей группой (или атомом) у другого винильного атома углерода, то это Z-изомер (старшие группы -Вr и -OCH3), если по разные стороны от плоскости двойной связи, то это Е-изомер. В случае алкенов цис-изомеры являются Z-изомерами, а транс-изомеры - Е-изомерами, так как соответствуют расположению главной цепи по отношению к двойной связи.

Z-изомер Е-изомер
ПО ДВОЙНОЙ СВЯЗИ
В результате окислительного расщепления двойной связи под действием хромовой смеси или перманганата калия (кипячение в прис. H2SO4) образуются кетоны, карбоновые кислоты или их смеси:


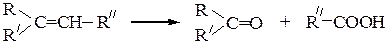
Циклоалкены в аналогичных условиях превращаются в ациклические дикарбоновые кислоты, кетокислоты или дикетоны:

Алкен, имеющий два заместителя при С-атоме,образующем двойную связь, превращается в кетон. Алкен, имеющий один заместитель при С-атоме у двойной связи, превращается в кислоту.
Озонолиз. При взаимодействии алкенов с озоном вначале образуется озонид, гидролиз которого приводит к альдегидам, кетонам или их смеси, в зависимости от строения алкена:

ПОЛИМЕРИЗАЦИЯ
Полимеризация - процесс получения высокомолекулярных соединений (полимеров) за счет последовательного присоединения молекул низкомолекулярного ненасыщенного вещества (мономера) к активному центру, расположенному на конце нарастающей цепи.
Схема полимеризаци алкенов и диенов:
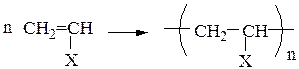 , где n - степень полимеризации;
, где n - степень полимеризации;
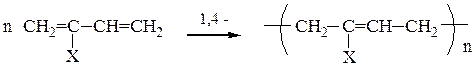
СОПОЛИМЕРИЗАЦИЯ
Сополимеризация – процесс полимеризации, протекающий с участием двух различных мономеров:
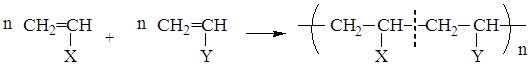
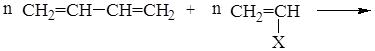

СТЕРЕОРЕГУЛЯРНЫЕ ПОЛИМЕРЫ
Стереоспецифическая полимеризация – процесс образования полимеров с упорядоченной пространственной структурой (стереорегулярные полимеры)
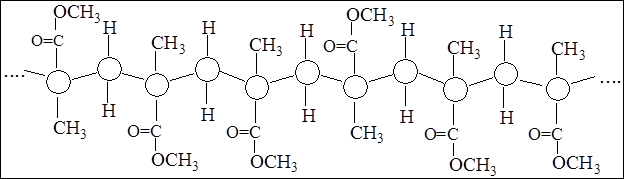
ВУЛКАНИЗАЦИЯ
Вулканизация -процесс превращения каучука в резину за счет сшивания линейных макромолекул, как правило, сульфидными мостиками
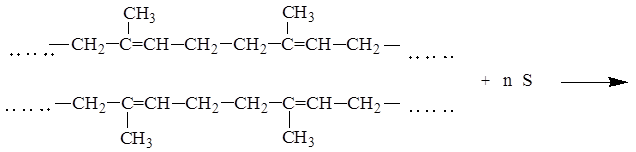
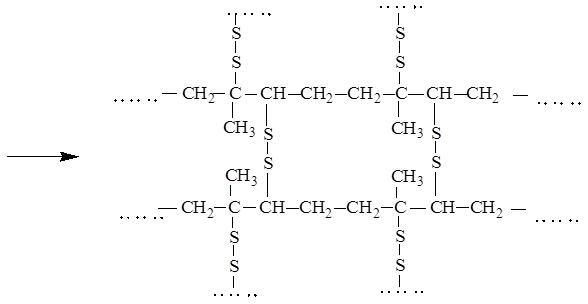
ТЕЛОМЕРИЗАЦИЯ ЭТИЛЕНА
Зарождение цепи:

Инициатор
Продолжение цепи:
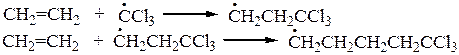
Передача цепи:

Продукты теломеризации этилена - смесь тетрахлоралканов:

АЛКИНЫ
ФИЗИЧЕСКИЕ СВОЙСТВА АЛКИНОВ
| Название
| Формула
| Т пл.
0С
| Т.кип.
0 С
| ρ, г· см-3
|
| Ацетилен
Пропин
Бутин-1
Бутин-2
Пентин-1
Пентин-2
3-метилбутин-1
Гексин-1
Гептин-1
Октин-1
Нонин-1
Децин-1
Гексин-2
Гексин-3
3,3-диметилбутин-1
Октин-4
Децин-5
Октадецин-1
Фенилацетилен
Дифенилацетилен
| НС≡СН
НС≡С–СН3
НС≡С–СН2–СН3
СН3–С≡С–СН3
НС≡С–(СН2)2–СН3
СН3–С≡С–СН2–СН3
(СН3)2СН–С≡СН
НС≡С–(СН2)3–СН3
НС≡С–(СН2)4–СН3
НС≡С–(СН2)5–СН3
НС≡С–(СН2)6–СН3
НС≡С–(СН2)7–СН3
СН3–С≡С–(СН2)2–СН3
СН3–СН2–С≡С–СН2–СН3
(СН3)3С–С≡СН
СН3(СН2)2С≡С(СН2)2СН3
СН3(СН2)3С≡С(СН2)3СН3
НС≡С–(СН2)15–СН3
НС≡С–С6Н5
С6Н5–С≡С–С6Н5
| - 82
- 105
- 130
─
- 95
- 101
─
- 124
- 80
- 70
- 65
- 36
- 92
- 51
- 81
+ 27
- 45
+ 62,5
| - 83,5
- 23
- 8,5
29,5
| 0,62
0,6785
0,668
0,688
0,688
0,713
0,685
0,719
0,733
0,747
0,763
0,770
0,730
0,725
0,669
0,748
0,760
0,802
0,930
|
| Вид связи
| Энергия, кДж/моль
| Длина, нм
|
| С–С СН3–СН3
| 347-356
| 0,154
|
| С=С СН2=СН2
| 611-632
| 0,134
|
| С≡С СН≡СН
| 833-837
| 0,120
|
МЕТОДЫ СИНТЕЗА АЛКИНОВ

4.3АЦЕТИЛЕН
НС≡СН, этин
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
ФИЗИЧЕСКИЕ СВОЙСТВА АРЕНОВ
| Название
| Формула
| Т пл.
0С
| Т.кип.
0 С
| ρ, г· см-3
|
| Бензол
Толуол
о -Ксилол
м -Ксилол
п- Ксилол
1,2,3-триметилбензол
1,2,4-триметилбензол
1,3,5-триметилбензол (мезитилен)
1,2,3,4-тетраметилбензол
1,2,3,5-тетраметилбензол
1,2,4,5-тетраметилбензол
Пентаметилбензол
Гексаметилбензол
Этилбензол
Гексаэтилбензол
Пропилбензол
Изопропилбензол
(кумол)
Бутилбензол
изо-Бутилбензол
втор-Бутилбензол
трет-Бутилбензол
1-метил-4-изопропил-
бензол (цимол)
транс-1,2-дифенилэтилен
(транс-стильбен)
цис-1,2-дифенилэтилен
(цис-стильбен)
Дифенилметан
Трифенилметан
Бифенил
Нафталин
Антрацен
Флуорен
Инден
Фенантрен
Азулен
| С6H6
С6H5CH3
1,2-С6H4(CH3)2
1,3-С6H4(CH3)2
1,4-С6H4(CH3)2
1,2,3-С6H3(CH3)3
1,2,4-С6H3(CH3)3
1,3,5-С6H3(CH3)3
1,2,3,4-С6H2(CH3)4
1,2,3,5-С6H2(CH3)4
1,2,4,5-С6H2(CH3)4
С6H(CH3)5
С6(CH3)6
С6H5CH2CH3
С6(CH2CH3)6
С6H5(CH2)2CH3
С6H5СН(CH3)2
С6H5(CH2)3CH3
С6H5CH2СН(CH3)2
С6H5CH(CH3)СН2СН3
С6H5C(CH3)3
1,4-СН3С6Н4СН(CH3)2
транс-
С6Н5–СН=СН–С6Н5
цис-
С6Н5–СН=СН–С6Н5
С6Н5–СН2–С6Н5
(С6Н5)3СН
С6Н5–С6Н5





| + 5,5
- 93
- 28
- 54
- 25
- 44
- 45
- 6,5
- 24
- 95
- 100
- 96
- 81
- 83
- 58
- 70
+ 1
70,5
- 2
─
|
159.5
173,5
145 (13 мм рт.ст)
| 0,878
0,867
0,880
0,864
0,861
0,895
0,876
0,864
0,902
0,867
0,830
0,862
0,862
0,860
0,867
0,864
0,867
0,857
0,970
1,000
|
СТРОЕНИЕ МОЛЕКУЛЫ БЕНЗОЛА

|
| Схема образования σ-связей в молекуле бензола
|

|
| Схема образования π-связей в молекуле бензола
А и Б – боковое перекрывание облаков р-электронов в двух проекциях, В – распределение электронной плотности над и под плоскостью атомных ядер
|
ХИМИЧЕСКИЕ СВОЙСТВА БЕНЗОЛА
БЕНЗОЛ – простейший ароматический углеводород
Получение: дегидроциклизация гексана
Дегидрирование циклогексана
Циклотримеризация ацетилена
Бензол легко реагирует с электрофильными реагентами (галогены, HNO3, H2SO4) c образованием продуктов замещения, соответственно С6H5Cl, C6H5NO2, C6H5SO3H.
При наличии одного заместителя, в зависимости от его природы, дальнейшее электрофильное ароматическое замещение может направляться преимущественно в орто- и пара-положения или же в мета-положение (см. правило ориентации).
Для бензола характерны:
· высокая термическая и химическая устойчивость.
· неспособность реагирования с сильными окислителями (KMnO4,
K2Cr2O7).
Бензол разрушается при озонолизе с образованием глиоксаля или окислении кислородом (450 ºС, катализатор V2O5) до малеинового ангидрида.
Бензол подвергается гидрированию до циклогексана и хлорированию на свету до гексахлорциклогексана.
. 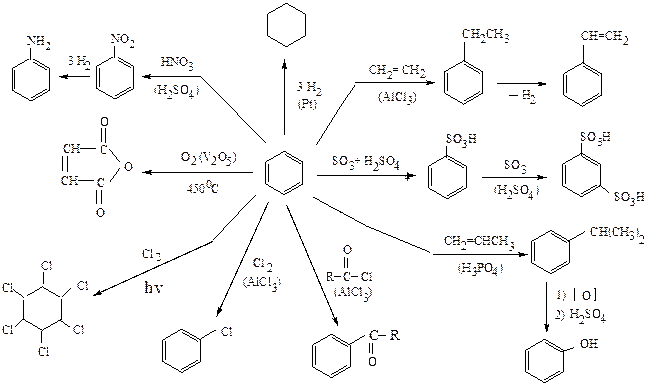
В БЕНЗОЛЕ

Нитробензол
1. Образование иона нитрония (конц. HNO3):

2. Реакция электрофильного замещения (SE):

p-комплекс s-комплекс
3. Регенерация катализатора:

Соли азотной кислоты смещают равновесие в сторону недиссоциированных молекул HNO3, тем самым уменьшают концентрацию нитроний-катиона и замедляют реакцию. Добавление H2SО4, наоборот, способствует протонированию азотной кислоты, связывает образующуюся воду, сдвигает равновесие в сторону образования нитроний-катиона и стимулирует протекание реакции по типу SE.
ОБЛАСТИ ПРИМЕНЕНИЯ
ДЛЯ ПРОИЗВОДНЫХ БЕНЗОЛА

Реакция Фриделя-Крафтса

Реакция Кольбе-Шмидта

Реакция Гаттермана

Реакция Губена-Геша

Реакция Вильсмейера

хлорметилирование (реакция Блана)

Реакция азосочетания

A- бромизопропилбензол
Основание краситель
Красителя
Этапы синтеза кристаллического фиолетового:
- получение n,n¢-диметиламинобензофенона (кетон Михлера);
- алкилирование - N,N-диметиланилином в присутствии POCl3;
- обработка третичного спирта НСl:

кетон Михлера

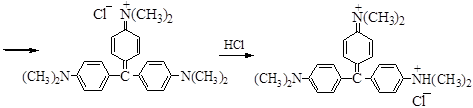
фиолетовый зеленый
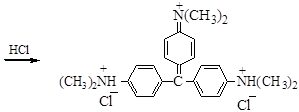
желтый
При действии HCl на кристаллический фиолетовый по мере протонирования атомов азота бензольные кольца лишаются сопряжения и делокализации заряда, окраска изменяется от фиолетовой до желтой. В щелочной среде краситель обесцвечивается и превращается в исходный спирт.
Фуксин
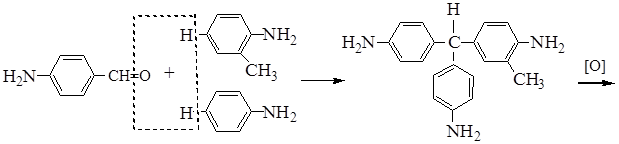
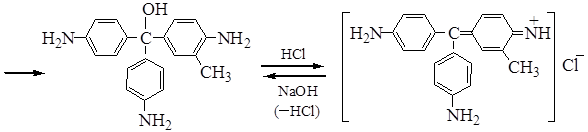 бесцветное красное
бесцветное красное
Малахитовый зеленый

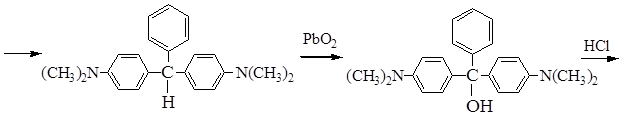 Лейкооснование малахитового зеленого Карбинольное основание
Лейкооснование малахитового зеленого Карбинольное основание
(бесцветное) (бесцветное)
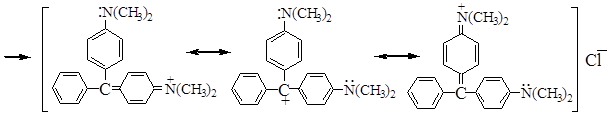 Предельные структуры катиона красителя малахитового зеленого
Предельные структуры катиона красителя малахитового зеленого
Фенолфталеин
В отличие от трифенилметановых красителей, содержащих аминогруппы (крист. фиолетовый, малахитовый зеленый), фталеины, имеющие в своем составе гидроксильные группы, в щелочной среде переходят в хиноидные структуры, сопровождающиеся усилением окраски.

Фенолфталеин (бесцветный)

Фенолфталеин (малиновый)
Избыток щелочи обесцвечивает фенолфталеин, как и другие красители трифенилметанового ряда:

бесцветный
Флуоресцеин
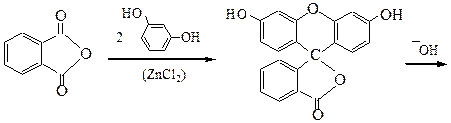
желтый

оранжевый (с зеленоватой флуоресценцией)
ФИЗИЧЕСКИЕ СВОЙСТВА
| Название
| Формула
| Т пл.
0С
| Т.кип.
0 С
| ρ, г· см-3
|
| Хлористый метил
Бромистый метил
Йодистый метил
Хлористый этил
Бромистый этил
Йодистый этил
Хлористый пропил
Бромистый пропил
Бромистый изопропил
Хлористый бутил
Бромистый бутил
Йодистый бутил
Бромистый изобутил
Бромистый третбутил
Хлористый пентил
Бромистый пентил
Йодистый пентил
Хлористый гексил
Бромистый гексил
Йодистый гексил
Хлористый октил
Бромистый октил
Йодистый октил
Хлористый винил
Бромистый винил
Бромистый аллил
Хлористый метилен
Бромистый метилен
Йодистый метилен
Хлороформ
Бромоформ
Йодоформ
Тетрахлорид углерода
Тетрабромид углерода
Тетрайодид углерода
1,2-дихлорэтан
1,2-дибромэтан
1,2-дийодэтан
1,1-дихлорэтан
1,1-дибромэтан
1,1-дийодэтан
Тетрахлорэтан
| CH3Cl
CH3Br
CH3I
CH3CH2Cl
CH3CH2Br
CH3CH2I
CH3CH2CH2Cl
CH3CH2CH2Br
(CH3)2CHBr
CH3CH2CH2CH2Сl
CH3CH2CH2CH2Br
CH3CH2CH2CH2I
(CH3)2CHCH2Br
(CH3)3CBr
CH3(CH2)3CH2Cl
CH3(CH2)3CH2Br
CH3(CH2)3CH2I
CH3(CH2)4CH2Cl
CH3(CH2)4CH2Br
CH3(CH2)4CH2I
CH3(CH2)6CH2Cl
CH3(CH2)6CH2Br
CH3(CH2)6CH2I
СH2=СH–Сl
СH2=СH–Br
СH2=СH–CH2Br
СH2Cl2
СH2Br2
СH2l2
СHCl3
СHBr3
CHI3
CCl4
CBr4
CI4
Cl CH2CH2Сl
BrCH2CH2Br
ICH2CH2l
CH3CHСl2
CH3CHBr2
CH3CHI2
Cl2CHCHСl2
|
- 97
- 93
- 64
- 139
- 119
- 111
- 123
- 110
- 89
- 123
- 112
- 103,5
- 120
- 20
- 99
- 88
- 86
- 83
- 85
─
- 160
- 138
- 119
- 97
- 53
- 63,5
─
171 (разл)
- 35
- 10
- 97
─
─
- 42,5
|
- 24
4,5
59,5
101,5
132,4
- 14
180 (разл)
61,5
149,5
210 (разл)
76,5
189,5
90 (возг)
разл.
|
0,920
1,732
2,279
0,910
1,430
1,933
0,890
1,353
1,310
0,884
1,300
1,617
1,250
1,223
0,883
1,246
1,517
0,872
1,173
1,441
0,969
1,517
1,398
1,336
2,495
3,325
1,500
2,890
4,008
1,595
3,42
4,32
1,257
2,170
2,132
1,174
2,089
2,840
1,602
|
СПИРТЫ И ФЕНОЛЫ
Нуклеофильное
Замещение при
Электрофильное замещение
Алкенов, сложные эфиры
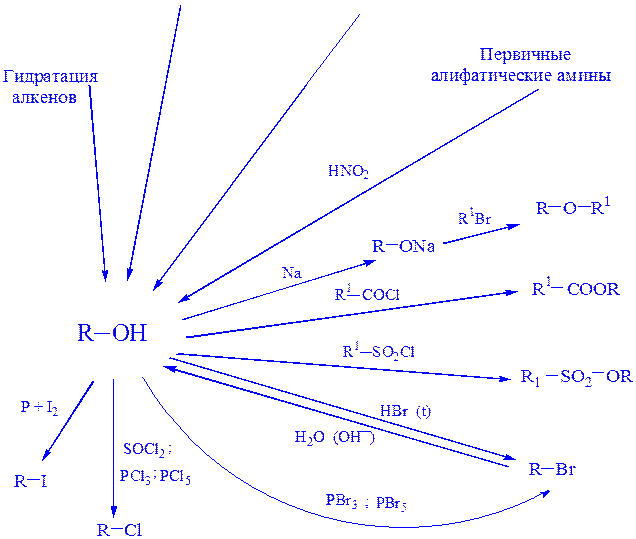
ДЕГИДРАТАЦИЯ СПИРТОВ
Внутримолекулярная дегидратация спиртов с образованием алкенов. Направленность реакции определяется правилом Зайцева – атом водорода отщепляется от соседнего наименее гидрогенизированного атома углерода:


Межмолекулярная дегидратация спиртов с образованием простых эфиров:



Простые эфиры образуются при небольшом количестве кислоты (катализатор) и низкой температуре, иначе образуются алкены. Разбавление спиртов инертным растворителем также способствует подавлению межмолекулярной реакции.
Простые эфиры с хорошим выходом получают из первичных спиртов. В случае вторичных и особенно третичных алканолов в продуктах дегидратации преобладают алкены, что вызвано более легкой стабилизацией соответствующих катионов путем отщепления протона и образования двойной связи.
Удаление алкенов из простых эфиров осуществляют промыванием их H2SO4, а затем водой до рН 7 в промывных водах.
Синтез глицерина из жира

7.9 СПОСОБЫ ПОЛУЧЕНИЯ И ХИМИЧЕСКИЕ РЕАКЦИИ ФЕНОЛА
Получение фенолов
1. Из хлорбензола при 3000С: C6H5 –Cl + NaOH ¾® C6H5 –OH + NaCl
2. Cплавлением солей бензолсульфокислоты со щелочью (320-3500С):
C6H5 –SO3Na + NaOH ¾® C6H5 –ONa + Na2SO3
C6H5 –ONa + HCl ¾® C6H5 –OH + NaCl
3. Кумольный метод: C6H5 –CH(CH3)2 + O2 ¾® C6H5 –C(CH3)2
│
O–OH
C6H5 –C(CH3)2 ¾® C6H5 –OH + СН3–С–СН3
│ ║
O–OH О
Химические реакции фенола

АЛЬДЕГИДЫ И КЕТОНЫ
ФИЗИЧЕСКИЕ СВОЙСТВА КЕТОНОВ
| Название карбонильного
соединения
| Формула
| Мол
масса
| Тпл./т.к
0С
| ρ, г. см-3
| Растворимость
200,100 г воды
|
|
Ацетон
Метилэтилкетон
Пентанон-2
Пентанон-3
Гексанон-2
Гексанон-3
Гептанон-2
Метилизобутилкетон
Октанон-2
Нонанон-2
Деканон-2
Ацетофенон
Пропиофенон
Бутирофенон
Бензофенон
Циклопентанон
Циклогексанон
|
СН3СОСН3
СН3СОСН2СН3
СН3СО(СН2)2СН3
СН3СН2СОСН2СН3
СН3СО(СН2)3СН3
СН3СН2СО(СН2)2СН3
СН3СО(СН2)4СН3
СН3СО( |






 цис- транс-
цис- транс-





 заслоненная и заторможенная конформации этана
заслоненная и заторможенная конформации этана
 D -глюкоза L- глюкоза L -аланин D -аланин
D -глюкоза L- глюкоза L -аланин D -аланин












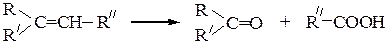


 , где n - степень полимеризации;
, где n - степень полимеризации;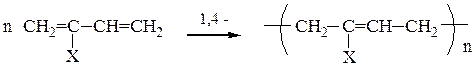
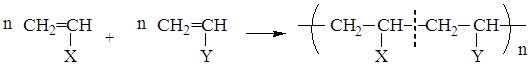
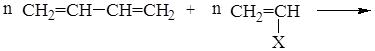





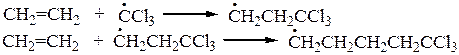











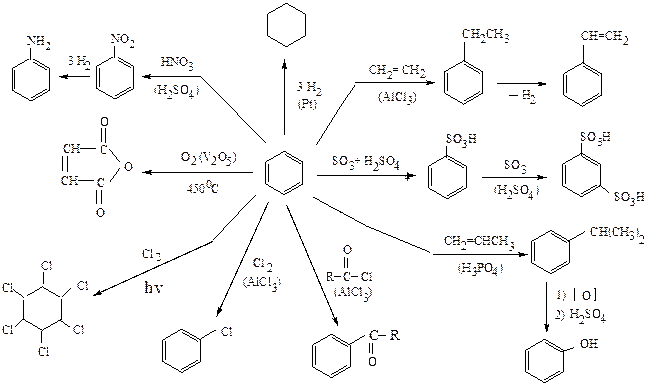













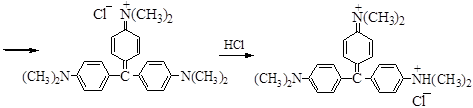


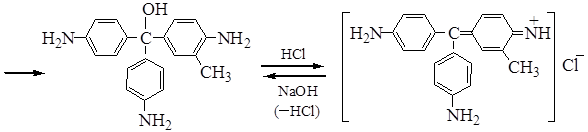 бесцветное красное
бесцветное красное
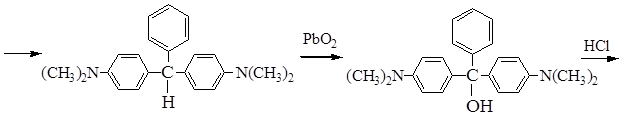 Лейкооснование малахитового зеленого Карбинольное основание
Лейкооснование малахитового зеленого Карбинольное основание Предельные структуры катиона красителя малахитового зеленого
Предельные структуры катиона красителя малахитового зеленого