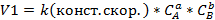Химическая реакция, протекающая в пределах одной фазы, называется гомогенной химической реакцией.
Химическая реакция, протекающая на границе раздела фаз, называется гетерогенной химической реакцией.
Для простых реакций, протекающих в одну стадию, когда стехиометрическое уравнение отражает истинных ход процесса, показатели степени в кинетическом уравнении скорости реакции представляют собой стехиометрические коэффициенты.
В случае же сложных реакций, протекающих через несколько стадий, когда общее стехиометрическое уравнение не отражает действительного хода реакции, показатели степени в уравнении скорости реакции не будут соответствовать стехиометрическим коэффициентам.
Химические реакции, в результате которых исходные вещества практически полностью превращаются в конечные продукты, называются необратимыми.
Химические реакции, которые протекают одновременно а двух противоположных направлениях — прямом и обратном — называются обратимыми.
Реакции, отличающиеся по тепловому эффекту – эндо- и экзотермические. Превращения энергии при химических реакциях. Первый закон термодинамики. Функции состояния: внутренняя энергия, энтальпия, энтропия, энергия Гиббса.
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты.
Эндотермическая реакция - химическая реакция, при которой происходит поглощение теплоты.
Выделение или поглощение энергии происходит в виде теплоты. Это позволяет судить о наличии в веществах определенного количества некоторой энергии (внутренней энергией реакции).
При химических реакциях происходит освобождение части энергии, содержащейся в веществах, это носит название теплового эффекта реакции. по которому можно судить об изменении количества внутренней энергии вещества.
Во время химических реакций происходит взаимное превращение энергий – внутренней энергии веществ в тепловую, лучистую, электрическую и механическую, и наоборот.
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
ΔU = A + Q,
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
Из (ΔU = A + Q) следует закон сохранения внутренней энергии. Если систему изолировать от внешних воздействий, то A = 0 и Q = 0, а следовательно, и ΔU = 0.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:

где A' — работа, совершаемая системой (A' = -A).
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Функцией состояния называется такая переменная характеристика системы, которая не зависит от предыстории системы и изменение которой при переходе системы из одного состояния в другое не зависит от того, каким образом было произведено это изменение.
Внутренняя энергия характеризует общий запас системы (все виды энергии системы)
Энтропия – есть мера неупорядоченности системы. Энтпропия вводится как функция состояния, изменение которой определяется отношением количества теплоты, полученное или отданное системой при t – T.
Энтальпией образования сложного вещества из простых веществ называется тепловой эффект реакции образования данного вещества из простых веществ в стандартных состояниях, отнесенный к 1 молю получающегося вещества
Энергия Гиббса - это величина, показывающая изменение энергии в ходе химической реакции.
Основные понятия химической кинетики. Скорость химической реакции. Факторы, влияющие на скорость реакции в гомогенных и гетерогенных процессах.
Химическая кинетика – изучает скорость химической реакции и зависимость ее от различных факторов, а также механизм протекания химических реакций.
Скоростью химической реакции называют число элементарных актов реакции, происходящих в единицу времени.
Скорость химической реакции зависит от:
1) концентрации реагирующих веществ;
2) температуры;
3) присутствия катализаторов;
4) природы реагирующих веществ;
5) степени измельчения твердого вещества;
6) перемешивания, если вещества находятся в растворенном состоянии.
Vист = 
Средняя скорость каждой реакции определяется изменением молярной концентрации реагирующих в-в за промежуток времени. (моль/(литр*с))
21. Влияние концентрации на скорость химической реакции. Закон действующих масс.
Закон действующих масс показывает зависимость скорости хим. реакц. от концентрации реагир. в-в.
Скорость хим. реакт. Прямо пропорциональна произв. конц. реагирующих в-в, взятых в степенях их стехиометрических коэф.

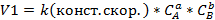


Для газовых реакций можно пользоваться парциальным давлением.
Закон справедлив только для ГОМОГЕННЫХ систем. Если система гетерогенная, то скор. Реакц. Зависит от пов-ти раздела(степени давления) твердой фазы.