Закон действующих масс – описывает взаимосвязь между концентрацией реагирующих веществ и скоростью химической реакции, обнаруженную русским ученым-химиком Н.Н. Бекетовым и голландскими химиками К. Гульдбергом и П. Вааге.

 aA + bB cC + dD
aA + bB cC + dD
Скорость Vп прямой химической реакции между А и В,по закону действующих масс, пропорциональна произведению концентраций реагирующих веществ в степенях, равных коэффициентам реакции:
Vп = Kп[А]а[В]b,
где Kп – коэффициент пропорциональности, он равен скорости реакции при концентрациях веществ 1 моль/л.
В первый момент протекания реакции концентрации исходных веществ имеют наибольшее значение и скорость прямой реакции велика. При взаимодействии их концентрация падает и скорость уменьшается. При появлении в системе продуктов реакции и возрастании их концентраций увеличивается скорость обратной реакции. В момент равенства скоростей прямой и обратной реакции наступает химическое равновесие, при котором состав системы становится постоянным.
K = 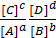
При химическом равновесии отношение произведения концентрации продуктов реакции к произведению концентраций исходных веществ есть величина постоянная, называемая константой химического равновесия (K).
Теории кислот и оснований:
Согласно теории Оствальда – Аррениуса: кислоты – электролиты, которые при диссоциации образуют протоны H+ и кислотный остаток; основания – электролиты, которые при диссоциации образуют гидроксильную группу и ион Me (NH4+).
Kд = 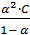
Согласно теории Бренстеда – Лоури: кислоты – доноры H+; основания – акцепторы H+.
Соединения, которые могут как отдавать, так и принимать H+, называются амфолиты.
В процессе передачи H+ образуются сопряженная пара кислоты и основания.

 NH4+ (кислота) NH3 (основание) + H+
NH4+ (кислота) NH3 (основание) + H+

 HCN (кислота) + OH- (основание) CN (основание) + H2O (кислота)
HCN (кислота) + OH- (основание) CN (основание) + H2O (кислота)
HCN и CN – сопряженная пара
Достоинством этой теории является возможность учесть влияние конкретного растворителя на кислотно-основное взаимодействие. K (NH4+) a (acid), K (NH3) b (basic).
Согласно теории Льюиса: кислоты – вещества, которые в своем строении имеют свободную орбиталь;
 BF3
BF3
 кислоты
кислоты
Cu2+
основания – вещества или частицы, которые имеют неподеленную электронную пару (: NH3).
 Cu2+ + NH3 [Cu(NH3)2]2+ - кислотно-основное взаимодействие по Льюису.
Cu2+ + NH3 [Cu(NH3)2]2+ - кислотно-основное взаимодействие по Льюису.
Эта теория расширила понятия о кислотах и основаниях, но недостатком ее является то, что классификация веществ по Льюису зависит от субъективного взгляда исследователя на природу химической связи.
Согласно теории Усановича: кислоты – вещества, которые отдают любые катионы и H+ и присоединяют любые анионы; основания отдают анионы, включая электроны, и принимают протоны.
ОВР – частный случай – недостаток этой теории.
В гомогенных системах для характеристики равновесия вводят понятие константы равновесия. Различают термодинамическую константу равновесия (K0), которая не учитывает побочных процессов и рассчитана для идеальных систем; реальную константу (K), которая учитывает параллельно протекающие процессы осаждения и комплексообразования; условную константу (K’), которая учитывает электростатические взаимодействия в системах.
Для того, чтобы отличать одну константу от другой по-разному обозначают концентрации реагирующих и полученных соединений.
Схема равновесия гомогенной системы:

 aA + bB cC + dD
aA + bB cC + dD
· K0 = 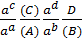 – термодинамическая константа равновесия K0, a – активная концентрация.
– термодинамическая константа равновесия K0, a – активная концентрация.
Для того, чтобы отличить термодинамическую константу K0 от другой константы, концентрации продуктов реакции и исходных веществ записывают в виде активной концентрации a.
Термодинамическая константа приводится в химических справочниках.
Для расчетов используется –lgK = pK.
· K = 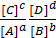 - реальная константа K
- реальная константа K
Концентрации записывают в виде равновесных.
· K’ =  – условная константа K’.
– условная константа K’.
Концентрации в ней записываются в виде общих концентраций.
Мы исследуем реальную систему, поэтому необходимо учитывать влияние растворителя, силу электролитов, участвующих во взаимодействии, а также величину заряда и радиус ионов, которые находятся в растворе.
Эти взаимодействия определены теорий Дебая-Хюккеля:
полному взаимодействию исходных веществ в растворе мешает наличие ионов растворителя, а также величина заряда исходных веществ и соединений в растворе (ионная сила раствора).
Активная концентрация [моль/л]:
a = 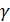 ∙C,
∙C,
где 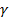 - коэффициент активности (пропорциональности).
- коэффициент активности (пропорциональности).
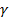 зависит от ионной силы раствора и от заряда частиц.
зависит от ионной силы раствора и от заряда частиц.
Ионная сила раствора определяется концентрацией и зарядом всех ионов, находящихся в растворе.
I = 0.5∙ 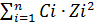
При различном значении ионной силы раствора коэффициент активности рассчитывается:
· При I ≤ 0.05 -lg 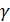 = 0.5∙Zi2
= 0.5∙Zi2 
· При I ≤ 0.1 -lg 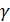 =
= 
· При I ≤ 0.5 -lg 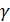 =
= 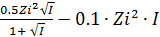
Расчет среды данного раствора.
В растворах сильных электролитов:
· 
 Кислоты: HCl H+ + Cl-, pH = -lg[H+], [H+] = Cкислоты, pH = -lgCкислоты
Кислоты: HCl H+ + Cl-, pH = -lg[H+], [H+] = Cкислоты, pH = -lgCкислоты
Если Cкислоты (HA) ≤ 10-5 М, т.е. раствор сильно разбавлен, в этом случае для расчета концентрации [H+] необходимо учитывать ионное произведение воды.
В таком растворе [H+] = Cкислоты + [OH-], т.к. kw = [H+]∙[OH-]; [OH-] = kw/[H+];
[H+] = Cкислоты + kw/[H+];
[H+]2 = Cкислоты ∙ [H+] + kw;
[H+] = 
· 
 Основания: NaOH Na+ + OH-; [OH-] = Cоснования; pOH = -lg[OH-]; kw = [H+]∙[OH-] = 10-14;
Основания: NaOH Na+ + OH-; [OH-] = Cоснования; pOH = -lg[OH-]; kw = [H+]∙[OH-] = 10-14;
[H+] = kw/Cоснования; pkw = pH + pOH; pH = 14 – pOH
Если раствор разбавлен (C≤10-5), то:
[H+] = kw/Cоснования;
[H+] = 
В растворах слабых электролитов (органические соединения, H2CO3, H2S…, диссоциация 1-30%):
· 
 Кислоты: CH3COOH CH3COO- + H+; K = [CH3COO-][H+]/[CH3COOH];
Кислоты: CH3COOH CH3COO- + H+; K = [CH3COO-][H+]/[CH3COOH];
[CH3COOH] = Cкислоты – Cдиссоциированной кислоты; [CH3COO-] = [H+].
Т.к. Cкислоты >>> Cдиссоциированной кислоты; K = [H+]2/Cкислоты;
[H+] = 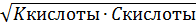
· Основания: kw = [H+]∙[OH-];
[H+] = 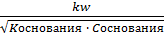
Для слабых электролитов, у которых  > 5%, а Kдис. > 10-4 концентрация [H+] рассчитывается:
> 5%, а Kдис. > 10-4 концентрация [H+] рассчитывается:
[H+] =  - для кислот;
- для кислот;
[H+] = 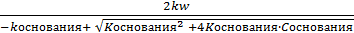 - для оснований.
- для оснований.
БУФЕРНЫЕ СИСТЕМЫ.
v Расчет констант гидролиза и рН при гидролизе.
Гидролизу подвергается 3 типа растворимых кислот:
· соли, образованные слабым основанием и сильной кислотой (NH4Cl).
· соли, образованные слабой кислотой и сильным основанием (CH3COONa)
· соли, образованные слабой кислотой и слабым основанием, гидролиз и по катиону и по аниону.
Количественной характеристикой процесса гидролиза является константа гидролиза и степень гидролиза.
· Константа гидролиза для соли, гидролизующейся по катиону: Кг = Кw/Косн
· Константа для соли, гидролиз. по аниону: Кг = Кw/Кк-ты
· Для соли, гидролиз. по катиону и аниону: Кг = Кw/Косн*Кк-ты
Связь Кг со степенью гидролиза аналогична связи Кд со степенью диссоциации:
Кг = h2c/1-h т.е Кг = h2c
Рассчитаем концентрацию [H+] в растворах гидролизующихся солей:
· [H+] = Кw/ кв. корень из (Кг*Ссоли) – для соли, гидролиз. по аниону
· [H+] = кв. корень из (Кг*Ссоли) – для соли, гидролиз. По катиону
· [H+] = кв. корень из (Кw*Кк-ты/Косн) – для соли, гидролиз. по катиону и аниону
· [H+] = кв. корень из (КI*КII) – для кислых солей
v К буферным относят растворы веществ, способные сохранять постоянное значение рН при добавлении к ним небольших количеств сильных кислот или оснований, а также при разбавлении.
Буферный раствор содержит либо слабую кислоту и ее соль (кислотные буферные системы), либо слабое основание и его соль (основные буферные системы).
Различают:
· Ацетатный буфер (укс.к-та и её соль)
· Аммиачный (NH4OH и NH4Cl)
· Фосфатный (NaH2PO4 и Na2HPO4)
· Цитратный
· Тартратный и др.
Механизм действия:
Буферные системы характеризуют двумя параметрами: значением создаваемого рН и буферной емкостью.
Для каждой буферной системы существует буферная емкость, которая определяет, при каком количестве (мольэкв) добавленного сильного электролита значение рН буфера изменяется на 1.
П = дельта С/дельта рН
Максимальное П у таких буферов, в которых конц. Слабого эл-та и его соли равны. П тем больше, чем выше конц. Его компонентов.
Расчет для системы, состоящей из слабой к-ты и ее соли:
[H+] = Кк-ты * (Ск-ты/Ссоли)
Для системы, состоящей из слабого основания и его соли:
[H+] = Кw/Косн * Ссоли/Сосн = Кг * Ссоли/Сосн
Буферные системы широко распространены в природе. Например, кровь человека имеет постоянный рН (~ 7,4), создаваемый специальной буферной системой крови. Буферные растворы широко применяют в качественном и количественном анализе для создания и поддержания определенного значения рН среды при проведении реакций. Цветные качественные реакции с органическими реагентами выполняют при строго определенных значениях рН, создаваемых с помощью буферных растворов. В химическом анализе широкое применение нашел ряд буферных растворов — ацетатный (СН3СООН + CH3COONa), формиатный (НСООН + HCОONa), фосфатны (Na2HP04 + NaH2P04), аммиачный (NH3 + NH4C1) и др.




 aA + bB cC + dD
aA + bB cC + dD
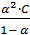

 HCN (кислота) + OH- (основание) CN (основание) + H2O (кислота)
HCN (кислота) + OH- (основание) CN (основание) + H2O (кислота) BF3
BF3 кислоты
кислоты Cu2+ + NH3 [Cu(NH3)2]2+ - кислотно-основное взаимодействие по Льюису.
Cu2+ + NH3 [Cu(NH3)2]2+ - кислотно-основное взаимодействие по Льюису.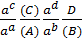 – термодинамическая константа равновесия K0, a – активная концентрация.
– термодинамическая константа равновесия K0, a – активная концентрация. – условная константа K’.
– условная константа K’.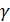 ∙C,
∙C,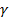 - коэффициент активности (пропорциональности).
- коэффициент активности (пропорциональности).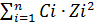


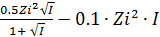

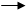 Кислоты: HCl H+ + Cl-, pH = -lg[H+], [H+] = Cкислоты, pH = -lgCкислоты
Кислоты: HCl H+ + Cl-, pH = -lg[H+], [H+] = Cкислоты, pH = -lgCкислоты


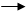 Кислоты: CH3COOH CH3COO- + H+; K = [CH3COO-][H+]/[CH3COOH];
Кислоты: CH3COOH CH3COO- + H+; K = [CH3COO-][H+]/[CH3COOH];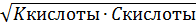
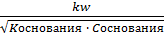
 > 5%, а Kдис. > 10-4 концентрация [H+] рассчитывается:
> 5%, а Kдис. > 10-4 концентрация [H+] рассчитывается: - для кислот;
- для кислот;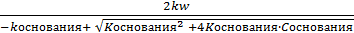 - для оснований.
- для оснований.


