Химическая промышленность является одним из крупнейших потребителей воды и воздуха. Например, на ее цели у нас в стране расходуется около 1млн. м3 воды в сутки.
На Земле огромное количество воды (примерно 1,5 млрд. км3), однако использованию подлежит только пресная вода, запасы которой весьма ограничены (около 0,3% от объема гидросферы).
Природная вода подразделяется на атмосферную, поверхностную и подземную.
Атмосферная вода (дождь, снег) содержит наименьшее количество примесей, и ее используют для водоснабжения безводных и засушливых районов.
Поверхностные воды – это воды открытых водоемов.
Морская вода представляет собой многокомпонентный раствор электролитов, содержащий практически все компоненты земной коры.
Подземные воды характеризуются значительным содержанием минеральных солей, но малым содержанием органических веществ и кислорода.
В зависимости от солесодержания природные воды подразделяются
на пресную воду (солесодержание до 1 г на 1кг воды), солоноватую (1-10 г на 1кг) и соленую (больше 10 г на 1кг воды).
Кроме того, в водах содержатся взвешенные части, которые придают ей мутность.
Важнейшими характеристиками воды являются: общая щелочность, жесткость, окисляемость или химическое потребление кислорода (ХПК) и активность (или pН).
Общая щелочность (Що) – это сумма концентраций анионов: ОН- (гидроксида), НСО3-(гидрокарбоната), СО32- (карбоната), НSiО3- (гидросиликата), PO43- (фосфата) и др. В природных водах, как правило, содержится наибольшее количество гидрокарбонат - иона (НСО3-).
Жесткость воды – это одна из важнейших характеристик, которая обусловлена наличием в ней солей кальция и магния. Различают 3 вида жесткости: временную (карбонатную), постоянную и общую.
Временная жесткость обусловлена присутствием хорошо растворимых гидрокарбонатов кальция и магния, поэтому ее называют еще карбонатной жесткостью. Она может быть устранена при нагреве воды до температур выше 60 °С. При этом эти соли разлагаются по следующим реакциям:
Са(НСО3)2 → СаСО3↓ + СО2↑ + Н2О,
2Мg(НСО3)2 → МgСО3·Мg(ОН)2↓ + 3СО2↑ + Н2О.
Образующиеся осадки выделяются в виде рыхлого слоя накипи на
греющих поверхностях. Для предотвращения этих реакций температура
отработанной воды после холодильников не должна превышать 40 - 45 °С!!!
Постоянная или некарбонатная жесткость обусловлена содержанием в воде сульфатов, силикатов, хлоридов и нитратов кальция и магния. Эти соли при нагревании не разлагаются, однако их растворимость при температуре выше 100 °С резко снижается. Выделяющиеся при этом мельчайшие кристаллы солей образуют на греющих поверхностях очень плотный и прочный слой накипи. Постоянная жесткость особенно опасна в паровых котлах, где воду нагревают при высоком давлении до очень высоких температур.
Сумма временной и постоянной жесткости называется общей жесткостью. По величине общей жесткости (Жо) природные воды подразделяются на:
- мягкую воду (Жо < 2 мг-экв/л),
- воду со средней жесткостью (2 < Жо < 10 мг-экв/л),
- жесткую воду (Жо > 10 мг-экв/л).
Окисляемость или химическое потребление кислорода (ХПК) – это количество кислорода в миллиграммах на литр, необходимого для окисления примесей, присутствующих в воде в основном органического происхождения. Чем больше таких примесей, тем больше ХПК воды. Например, величина ХПК артезианской воды минимальная 1- 3 мг/л, речной воды 5-60 мг/л.
Активность (или рН) воды – это отрицательный десятичный логарифм концентрации ионов водорода в воде, т. е. рН = - lg[ CH +].
Если рН < 7, то вода кислая, рН > 7 – вода щелочная. Большинство природных вод имеют рН в пределах 6,5 - 8,5.
На химических предприятиях используют различные воды: речную, артезианскую, фильтрованную, обессоленную, охлажденную и т. д.
2. 1. 4. Промышленная водоподготовка
В зависимости от производственной необходимости применяются следующие методы водоподготовки: механические, физико-химические и химические.
Механические методы – это наиболее дешевые методы, их применяют как предварительную стадию водоподготовки. Они включают в себя осветление и фильтрование.
Осветление проводят, в основном, путем осаждения мельчайших взвешенных частиц. Как известно, при ламинарном режиме (критерий Рейнольдса < 0,2) скорость осаждения частиц (w ос)описывается законом Стокса:
 ,
,
где d ч – эквивалентный диаметр частиц, м;
rч – плотность частиц, кг/м3;
rж – плотность жидкости, кг/м3;
m – динамический коэффициент вязкости жидкости, Па×с;
g – ускорение свободного падения, 9,81 м/с2.
Как видно из этого уравнения, скорость осаждения может быть увеличена за счет укрупнения размера частиц, уменьшения вязкости воды, а также путем замены ускорения силы тяжести на более значительные центробежные ускорения.
Укрупнение частиц достигается путем обработки воды специальными добавками: коагулянтами и флокулянтами.
В качестве коагулянтов используют чаще всего соли поливалентных металлов: Al2(SO4)3, Fe2(SO4)3, FeCl3 и др. Эти соли, растворяясь в воде, разрушают двойной электрический слой (ДЭС), имеющийся на поверхности взвешенных частиц. Кроме того, коагулянты как соли, образованные сильными кислотами и слабыми основаниями в воде гидролизуются. Этому способствует щелочная среда, для создания которой воду слегка подщелачивают Образующиеся при этом гелеобразные осадки гидроксидов алюминия и железа (Al(OH)3 и Fe (OH)3) способствуют слипанию взвешенных частиц с образованием крупных хлопьеобразных осадков.
Флокулянты – высокомолекулярные органические и неорганические вещества, на концах молекул которых имеются радикалы. Растворяясь в воде, эти молекулы своими радикалами склеивают отдельные частицы в крупные агрегаты – флокулы. В качестве флокулянтов чаще всего используют полиакриламиды (ПАА) различной молекулярной массы, карбоксилметилцеллюлозу (КМЦ) и активную кремниевую кислоту.
Очень часто коагулянты и флокулянты используют совместно.
Для уменьшения вязкости воду иногда подогревают. Например, при нагреве воды до 35 – 40 оС вязкость ее снижается практически в 2 раза. Такой прием экономически оправдан, например, для осветления питательной воды паровых котлов.
Для интенсификации осаждения в последнее время взамен обычных гравитационных отстойников начали использовать отстойные центрифуги с фактором разделения до 1000 и более единиц. Однако эти центрифуги довольно сложны и требуют больших энергозатрат.
Конечной стадией осветления является фильтрование. В качестве фильтрующих материалов чаще всего используют слой зернистых материалов. Это может быть песчано-гравийная смесь (ПГС), кварцевый песок, дробленый антрацит, керамзит, перлит (вспученный вулканический песок) и др.
Химические методы. Умягчение воды – это очистка воды от солей жесткости. Наиболее старым методом умягчения является известково-содовый метод, который позволяет снизить общую жесткость до 0,2-0,3 мг-экв/л.
На первой стадии устраняется временная жесткость путем обработки воды гашеной известью - Са(ОН)2. Поэтому этот процесс называется еще известкованием воды. При этом удаляются также ионы железа и растворенный углекислый газ:
Са(НСО3)2 + Са(ОН)2 → 2СаСО3↓ + 2Н2О,
Мg(НСО3)2 + 2Са(ОН)2 → 2СаСО3↓ + Mg(ОН)2 ↓ + 2Н2О,
FeSO4 + Ca(OH)2 → Fe(OH)2↓ + CaSO4↓, - обезжелезивание воды
CO2 + Ca(OH)2 → CaCO3↓ + H2O. - декарбонизация воды
Если вода используется только в качестве хладагента, то процесс умягчения на этой стадии завершается!!!
Вторая стадия. Если требуется устранение и постоянной жесткости, например, при приготовлении питательной воды для паровых котлов, в которых производится нагрев более 100 °С, то ее дополнительно обрабатывают кальцинированной содой (Na2CO3):
MgSO4 + Na2CO3 → MgCO3↓ + Na2SO4,
MgCl2 + Na2CO3 → MgCO3↓ + 2NaCl,
CaSO4 + Na2CO3 → CaCO3↓ + 2Na2SO4 .
Третья стадия. Иногда для дополнительного повышения степени умягчения воды ее дополнительно обрабатывают тринатрийфосфатом (Na3PO4):
3Са2+ + 2Na3PO4 → Са3(РО4)2↓ + 6Na+,
3Mg2+ + 2Na3PO4 → Mg3(РО4)2↓ + 6Na+.
Образующиеся фосфаты кальция и магния практически нерастворимы и поэтому полностью кристаллизуются, выделяются в осадок и обеспечивают очень высокую степень умягчения. (Жо понижается от 0,2 - 0,3 до 0,01мг-экв/л). Однако тринатрийфосфат довольно дорог.
Образующиеся осадки отделяют от воды в отстойниках или в отстойных центрифугах, для ускорения осаждения воду обрабатывают флокулянтами.
Достоинство известково-содового метода заключается в его универсальности, т.е. пригодности практически для всех видов вод.
Недостатки метода – повышенный расход реагентов, громоздкость используемых отстойников, относительно низкая эффективность умягчения, невозможность обессоливания воды.
Физико-химические методы. В настоящее время для умягчения и обессоливания воды все больше используется новый более прогрессивный метод ионного обмена, а также метод обратного осмоса.
Метод ионного обмена основан на способности специальных твердых веществ – ионитов поглощать из воды положительные ионы (катионы) или отрицательные ионы (анионы) в обмен на другие одноименно заряженные ионы, содержащиеся в воде. В соответствие со знаком поглощаемых ионов различают катиониты и аниониты.
Катиониты (R-/Na+ или R-/H+) – это нерастворимые в воде вещества, имеющие неподвижный анион R-, обусловливающий его нерастворимость. Другое название этого радикала – матрица.
Катион (Na+ или H+), напротив, очень подвижен и способен вступать в реакции обмена с содержащимися в воде катионами. В зависимости от типа катиона различают Na–катионит и H–катионит. К катионитам относятся специально синтезированные вещества: алюмосиликагели, сульфоуголь, а в последнее время - синтетические смолы.
Аниониты (R+/OH-) – это также нерастворимые соединения с твердым катионом (R+) и подвижной гидроксильной группой, которая легко вступает в реакции обмена с анионами, содержащимися в воде. К таким соединениям относятся искусственные смолы сложного состава.
Важнейшей характеристикой ионитов является обменная емкость, которая показывает способность поглощать определенное количество ионов из раствора. При достижении заданного предела ионной емкости проводится регенерация ионита.
Обмен ионов натрия, содержащихся в катионите, называется процес-
сом Na-катионирования воды. Этот процесс используют для умягчения
воды по реакциям:
2R-/ Na+ + Ca2+ Û 2R-/ Ca2+ + 2Na+,
2R-/ Na+ + Mg2+ Û 2R-/ Mg2+ + 2Na+.
Обмен ионов водорода в Н-катионите носит название Н-катиони-рованием воды и применяется для обессоливания воды. При этом в воду переходят ионы водорода, которые подкисляют ее, и рН снижается:
2R-/H+ + Ca2+ Û 2R-/Ca2+ + 2H+,
2R-/H+ + Mg2+ Û 2R-/Mg2+ + 2H+.
Н-катионирование воды обязательно сочетается с ее последующим анионированием!!! Поглощение анионов из растворов анионитами протекает по реакции:
R+/ОH- + Cl- Û R+/Cl- + OH-,
2R+/ОH- + SO42- Û 2R+/SO4 2- + 2OH-.
В результате этого вода насыщается гидроксид-ионами и она нейтрализуется:
Н+ + ОН- → Н2О.
Все эти реакции обратимые, что позволяет производить регенерацию дорогостоящих ионитов после их насыщения ионами, содержащимися в воде.
Регенерацию Na-катионитов, обычно, осуществляют промывкой их растворами поваренной соли (NaCl) или сульфата натрия (Na2SO4).
Регенерацию Н-катионита проводят промывкой разбавленными растворами серной или соляной кислот, а регенерацию анионитов – раствором NaOH.
На рис. 4 приведена принципиальная схема обессоливания и деаэрации воды.
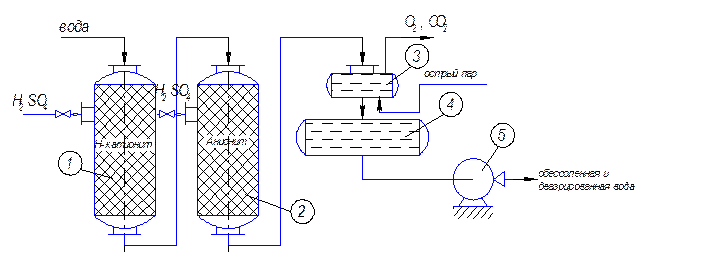
Рис. 4. Принципиальная схема обессоливания и деаэрации воды:
1 - катионитовая колонна; 2 - анионитовая колонна; 3 - «головка» деаэратора; 4 - аккумулятор обессоленной и деаэрированной воды; 5 – насос.
Исходную воду предварительно осветляют, фильтруют и обезжелези-
вают. Обезжелезивание воды проводят пропуская через нее воздуха. При этом происходит реакция:
2Fe2+ + 1,5O2 + 3H2O → 2Fe(OH)3↓.
Образующийся осадок гидроксида железа отделяют от воды. Проходя через катионитовую 1 и анионитовую 2 колонны, вода обессоливается. Как правило, процесс проводят в несколько ступеней (в две или даже три). Далее вода поступает в «головку» деаэратора 3, где ее нагревают при помощи острого водяного пара. При этом из воды удаляются растворенные кислые газы, в основном кислород и углекислый газ.
Для улучшения контакта воды с острым паром в «головке» имеются форсунки, разбрызгивающие воду на специальные тарелки, которые ее дополнительно диспергируют.
Деаэрированная вода стекает в аккумулятор (накопитель) 4 и оттуда перекачивается насосом 5 потребителям.
Основное применение такая вода находит в тепловых электростанциях и парокотельных цехах для получения водяного пара. Растворенные газы, содержащиеся в воде при испарении полностью переходят в пар.
Повышая коррозионную активность пара они одновременно резко ухудшают его теплофизические свойства (снижают коэффициент теплоотдачи к теплопередающим поверхностям). Это происходит потому, что при конденсации водяные пары превращаются в воду, которая выводится из теплообменника через специальные конденсатоотводчики. Содержащиеся в паре примеси газов не конденсируются, накапливаются внутри теплообменника и ухудшают теплообмен. Поэтому теплообменники в этом случае необходимо часто «продувать», т. е. выпускать накопившиеся газы вместе с паром в атмосферу.
Кроме того, деаэрация, как уже указывалось, позволяет уменьшить коррозионную активность воды и водяного пара.
Если количество растворенных газов невелико, то используют химическую деаэрацию воды, связывая их, например, сульфитом натрия (Na2SO3), гидразином и другими реагентами.
В последнее время взамен ионного обмена начали использовать еще более современный метод обессоливания – метод обратного осмоса. Он заключается в пропускании воды через специальные мембраны (молекулярные сита). Молекулы воды, имеющие очень маленький радиус, проходят через мембраны, а ионы растворенных солей задерживаются.
Атмосферный воздух
Общая масса воздуха в атмосфере Земли – 5100 триллионов тонн. В воздухе содержится большое количество компонентов (об. %): азот – 78,16, кислород – 20,90, аргон – 0,93 и инертные газы (гелий, неон, криптон, ксенон в сумме – 0,1), а также пары воды, СО2, взвешенные капельки воды и пыль. Для упрощения в технологических расчетах условно принимают, что воздух состоит из 79 % азота и 21 % кислорода. Средняя молекулярная масса воздуха принимается равной 29, а плотность при нормальных условиях 1,293 кг/м3.
Воздух используется в химической промышленности, в основном, как
сырье или как реагент в технологических процессах, а также как окислитель при сжигании топлива.
Из воздуха путем низкотемпературной ректификации выделяют чистый кислород, азот и инертные газы (в основном, аргон). Кислород используется взамен воздуха для интенсификации процессов окисления (так называемое кислородное дутье). Азот применяют в синтезе аммиака как сырье или как инертный газ. Перед употреблением воздух в зависимости от характера производства подвергают специальной очистке, отделяя пыль, влагу, катализаторные яды, углекислый газ и т. д. Например, в производстве азотной кислоты забор воздуха осуществляется за пределами предприятия по специальному воздуховоду длиной несколько километров и на высоте около 60 м.
Большое количество воздуха расходуется при сжигании топлива в топках, для повышения КПД топок воздух подогревают теплом отходящих топочных газов.
Сжатый воздух используют для перемешивания жидкостей в барботажных аппаратах, для распыливания жидкости в форсунках и т.д.
В последние годы широкое применение находят аппараты воздушного охлаждения (АВО). Использование АВО позволяет резко сократить расход охлаждающей воды.



 ,
,



