Задание:
При взаимодействии фенилаллена С6Н5СН=С=СН2 с хлоформом в присутствии трет-бутилата калия выделен хлорид (М≈200, % Cl 35,6), данные о спектрах которого приведены на рис. 20. Определить структуру соединения.

Рис. 20. УФ-спектр в гептане: 221 нм (lgε 3,84), 276 нм (lgε 2,27). Спектр ПМР снят при 40 МГц. Точные значения химических сдвигов сигналов, Гц: 1 – 49, 2 – 55, 3 – 58, 4 – 63, 5 – 67, 6 – 75, 7 – 84, 8 – 107, 9 – 112, 10 – 115, 11 - 120
Решение:
Основываясь на методе получения хлорида и содержания галогена (два атома хлора в молекуле), можно прийти к заключению, что исследуемый хлорид является продуктом присоединения частицы СCl2 (дихлоркарбена) к фенилаллену. В данном случае наряду с нормальными продуктами присоединения карбена к кратным связям аллена можно ожидать образования продуктов их изомерных превращений с изменением углеродного скелета или с миграцией атомов галогена. В молекуле продукта кроме фенильной группы может (судя по составу) присутствовать группировка, содержащая:
а) тройную связь;
б) две двойную связи;
в) один цикл и двойную связь;
г) два цикла.
В ИК-спектр соединения наблюдаются полосы фенильной группы (3060, 3030, 1603, плечо 1590, 1500, 760, 700 см-1). В области 1700 – 1800 см-1 имеются две полосы средней интенсивности при 1730 и 1783 см-1. Наличие полос с такими частотами для соединений, не содержащих карбонильной группы, указывает на присутствие в молекуле трехуглеродного цикла с экзо- или эндоциклической двойной связью. В области валентных СН-колебаний нет сильных полос ниже 3000 см-1, что согласуется со структурой, содержащей ароматические, олефиновые или циклопропановые СН-связи. На этом основании мы можем исключить из рассмотрения все варианты структур, кроме содержащих трехчленный цикл с кратной связью.
Наблюдаемые в УФ-спектре соединения две полосы поглощения средней интенсивности по положению соотвествуют такой структуре, в которой фенильная группа изолирована от С=С-связи, т.е. стирольный хромофор отсутствует. Это дает основание в дальнейшем обсуждать лишь следующие фрагменты в молекуле хлорида.
В спектре ПМР видны сигналы протонов фенильной группы (7,03 м.д.) и две группы сигналов в сильном поле. Отсутствие сигналов в области 4 – 6 м.д. дает основание исключить из рассмотрения все структуры, в которых протона находятся при С=С-связи. Визуально сильнопольную часть спектра хлорида можно было бы отнести к спектру системы АВХ: АВ-часть в районе 1,2 – 2,1 м.д. и Х-часть в районе 2,7 – 3,0 м.д. Однако для интерпретации происхождения сигналов следует провести полную расшифровку спектра. Можно предположить, что меньшее число линий в АВ-части является следствием слиянием двух близко расположенных линий в одну. Действительно, в указанной группе сигналов линия 6 (при ν 75 Гц) имеет наибольшую интенсивность и, по-видимому, является основной. Поступая далее с линией 6, как состоящей из двух, мы, согласно указаниям на с. 93., вычислим константу JАВ. Она равна 8,5 Гц и соответствует расстояниям между линиями 1-3, 2-4, 5-6 и 6-7. Затем составляем два квартета типа АВ двумя вариантами:
I – линии 1, 3, 5, 6 и 2, 4, 6, 7 с центрами 62 и 69 Гц соответственно;
II – линии 1, 3, 6, 7 и 2, 4, 5, 6 с центрами 67 и 65 Гц соответственно.
Для варианта I расстояние между центрами квартетов равно 7 Гц, а для варианта II – 2 Гц. Анализ Х-части, содержащей 4 линии, показывает, что сумма констант (JАХ+JВХ), равная 13 Гц, - расстояние между линиями 8 и 11, соответствует I варианту. Разность (JАХ-JВХ) вычислили по уравнению (4.15), а величину  - по уравнению (4.17). JАХ-JВХ=3 Гц,
- по уравнению (4.17). JАХ-JВХ=3 Гц,  =17 Гц. Центр мультиплета АВ равен 66 Гц. Далее вычислим все параметры спектра АВХ:
=17 Гц. Центр мультиплета АВ равен 66 Гц. Далее вычислим все параметры спектра АВХ:  74 Гц (1,85 м.д.),
74 Гц (1,85 м.д.),  58 Гц (1,44 м.д.),
58 Гц (1,44 м.д.),  113 Гц (2,83 м.д.), JАВ 8,5 Гц, JАХ 8 Гц, JВХ 5 Гц.
113 Гц (2,83 м.д.), JАВ 8,5 Гц, JАХ 8 Гц, JВХ 5 Гц.

Ответ:
Таким образом, сигналы в сильном поле относятся к трем неэквивалентным протонам, находящимся в спин-спиновом взаимодействии между собой. На этом основании можно исключить структуры, содержащие циклопропеновое кольцо, так как в них имеются только два типа протонов, а не ври. Из производных же метиленциклопропана единственной структурой, удовлетворяющей всем приведенным спектральным характеристикам, является 2-фенил-1-дихлорметилен циклопропан. Положение протонов А, В и Х в молекуле хлорида показано ниже:
6. Совместное использование данных спектров ПМР и ЯМР13С для идентификации органического соединения.
Задание:
Определить строение углерода с Ткип ~ 200 ºС по спектрам ПМР и ЯМР13С (рис. 21).

Рис. 21. ПМР и ЯМР13С – спектры вещества
Решение:
На основании порядка величины температуры кипения углеводорода можно заключить, что он содержит не более 12 атомов углерода (см. табл. 1).
В спектре ЯМР13С наблюдается семь линий, из которых только одна находится в области насыщенных С-атомов (δС<50 м.д.). Учитывая, что исследуемое соединение является углеводородом, самый слабопольный малоинтенсивный сигнал (δС 206,0 м.д.) однозначно следует отнести к центральному атому С алленового фрагмента. Крайним же атомам этого фрагмента, по-видимому, отвечают сигналы при δС 92,3 и 87,5 м.д. Причем эти атомы С не могут быть безводородными, так как интенсивности указанных сигналов существенно превышают таковую сигнала при δС 206,0 м.д. Остающиеся три сигнала слабопольной области на основании их химических сдвигов (δ 124,8, 126,6, 133,2 м.д.) следует приписать ароматическим атомам С. Учитывая общее число атомов углерода, надо признать, что в молекуле имеется только одно бензольное ядро. Отсюда также вытекает, что и трехуглеродный алленовый фрагмент тоже только один. Наконец, очевидно, что единственному сильнопольному сигналу (δС 12,0 м.д.) может отвечать только метильная группа (одна или две эквивалентные). К сожалению, выявить тип замещения бензольного ядра не удается, прежде всего, вследствие совпадения сигналов ароматических атомов С различной разновидности (при сделанных выводах о фрагментах молекулы нельзя представить в ней бензольное ядро с менее чем четырьмя разновидностями атомов С).
Таким образом, из анализа спектра ЯМР13С можно сделать вывод о присутствии моно- или симм-дизамещенного алленового фрагмента, моно-, ди- или тризамещенного бензольного ядра, одной или двух метильных групп.
Обратимся к анализу спектра ПМР. В нем наблюдаются четыре группы сигналов (δ, м.д.): 1,7, мультиплет (протоны при насыщенном С-атоме), 5,4 и 6,0 мультиплеты (протоны при олефиновых атомах С), 7,2, мультиплет (ароматические протоны) – с соотношением интенсивностей 3:1:1:5. Эта информация позволяет прийти к следующим выводам относительно структуры:
1) в соединении только одна метильная группа;
2) алленовый фрагмент является симм-дизамещенным;
3) бензольное ядро содержит один заместитель.
Эти выводы соответствуют единственной структуре, а именно: 1-фенил-1,2-бутадиену:
 .
.
В полном согласии с выбранной структурой находится и наблюдаемая мультиплетность сигналов алифатических протонов в спектре ПМР. Действительно, эти протоны составляют спиновую систему А3МХ. Отсюда протонам метильной группы (А3) соответствуют четыре линии (дублет дублетов), определяющие две константы спин-спинового взаимодействия: JAM =6 Гц, JAX =3 Гц. Сигнал при δ 5,4 м.д. выглядит как симметричный квинтет с расстоянием между компонентами мультиплета, равным 6 Гц. Этот сигнал отвечает олефиновому протону М, для которого соблюдается равенство JAM=JMX=6 Гц. Поэтому сигнал выглядит квинтетом (4+1), а не дублетом квартетов (3+1)∙(1+1). Наконец, сигнал при δ 6,0 м.д. вместо ожидаемого дублета квартетов (JAX≠JMX) дает сигнал, состоящий из семи линий, вследствие перекрывания отдельных линий квартетов из-за кратности констант спин-спинового взаимодействия.
Ответ:
1-фенил-1,2-бутадиен.
7. Совместное использование спектров ПМР, ЯМР13С, УФ и состава.
Задание:
Определить строение соединения состава С22Н22О4, УФ-, ПМР- и ЯМР13С-спектры которого представлены на рис 22.

Рис. 22. УФ-, ПМР- и ЯМР13С-спектры вещества:
УФ-спектр в гексане, кювета 1 см, 7,5 мг/л. Спектр ЯМР13С – в CDCl3+CCl4. Спектр ПМР – 100 МГц.
Решение:
Указанная в условии брутто-формула свидетельствует о высокой ненасыщенности соединения (ФН=12). Обратимся вначале к спектру ЯМР13С с полным подавлением спи-спинового взаимодействия с протонами, чтобы выяснить особенности углеродного скелета и, в частности, углеродные фрагменты – носители ненасыщеннсоти. Мы видим, что семь из девяти пиков* находятся в области 115 – 200 м.д., характерной для сигналов  , остальные два пика – в области сигналов
, остальные два пика – в области сигналов 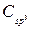 . Таким образом, очевидно, что ненасыщенность молекулы обусловлена прежде всего ароматическими кольцами и двойными связями С=С и С=О, но в молекуле нет тройных связей С ≡ С и алленовых фрагментов.
. Таким образом, очевидно, что ненасыщенность молекулы обусловлена прежде всего ароматическими кольцами и двойными связями С=С и С=О, но в молекуле нет тройных связей С ≡ С и алленовых фрагментов.
Проведем более детальных анализ положения сигналов в спектре ЯМР13С. Два пика, отвечающие насыщенным атомам С, заметно различаются по химическому сдвигу. Учитывая наличие в составе соединения атомов кислорода, можно предположить, что слабопольный пик 2 (δс 59,8 м.д.) относится к атому С, не соседствующему с атомом О. Обратимся теперь к сигналам ненасыщенных атомов углерода. Пик 9 (δс 164,8 м.д.) следует однозначно приписать карбонильному атому углерода фрагмента О-С=О. Пики 4, 5 и 6 своими положением, относительной интенсивностью и близостью химических сдвигов заставляют предположить, что они относятся к метиновым атомам С монозамещенного бензольного ядра, не содержащего в качестве заместителя сильнопольных акцепторов или доноров электронов. При таком предположении дополнительные данные для характеристики монозамещенного бензольного ядра дает пик 7, положение и относительная интенсивность которого вполне отвечает требованиям для безводородного атома С, причем второй из них, имеющий малую интенсивность, подобно пикам 7 и 9, по-видимому, соответствует атому С, не соединенному с атомом водорода.
Проанализируем теперь относительную интенсивность всех сигналов в спектре ЯМР13С. Учитывая ожидаемую заниженную интенсивность безводородных атомов С, отнесение пиков 4, 5, 6 и 7 к типу монозамещенного бензольного ядра и соизмеримость интенсивностей сигналов 1, 2, 3 и 6, можно вывести относительное распределение атомов С по пикам спектра – 1:1:1:2:2:1:1:1:1. Суммирование этих относительных чисел дает 11, но поскольку в молекуле 22 атома углерода, то остается принять следующее распределение их по девяти пикам – 2:2:2:4:4:2:2:2:2. Это означает, что в молекуле имеется некоторый элемент симметрии, относительно которого ее углеродных скелет разделен ан две идентичные половинки.
В спектре ПМР наблюдается четыре группы сигналов с соотношением интенсивностей (в направлении увеличения напряженностей поля (5:1:2:3). Сумма этих относительных чисел равна 11, т.е. в два раза меньше числа атомов Н в молекуле. Таким образом, информация о распределении в молекуле атомов Н подтверждает уже сделанный вывод о ее симметрии. Теперь можно выявить водородсодержащие фрагменты, которые с молекуле должны быть представлены дважды. Квартет δ 4,05 м.д. и триплет δ 1,15 м.д. указывают на наличие фрагмента ОСН2СН3, синглет при δ 6,4 м.д. свидетельствует о присутствии метинового олефинового фрагмента, а мультиплет с центром δ 7,4 м.д. подтверждает присутствие фенильной группы.
Обобщая информацию, полученную из спектров ЯМР13С и ПМР, констатируем, что каждая из идентичных половин молекулы содержит фрагменты: С6Н5-, -СООСН2СН3, >С-СН. Эти фрагменты могут быть сочленены шестью способами в одновалентную половину молекулы:

| 
| 
|
| А (цис- и транс-)
| Б (цис- и транс-)
| В (цис- и транс-)
|
Выбор между указанными вариантами структур можно сделать на основании УФ-спектра. В длинноволновой области спектра наблюдается интенсивная полоса при λ 270 нм и ε=25 000 (350∙0,52/0,0075), которая характеризует присутствие в молекуле сопряженного хромофора. Если сочленить фрагменты Б и В, то получающиеся молекулы включают 1,4-дифенил-1,3-бутадиеновый хромофор, который должен иметь максимум поглощения в области выше 300 нм. Поэтому такие варианты структур следует отбросить. Структуры на основе фрагмента А следует трактовать, как включающие либо два кросс-сопряженных хромоформа коричного эфира, либо хромофор муконового эфира с кросс-сопряженными фенильными ядрами. Обе трактовки предполагают появление полосы поглощения в области ниже 300 нм.
Ответ:
Поэтому структура диэтилового эфира β,β’-дифенилмуконовой кислоты (I) в наилучшей степени соответствует УФ-спектру, что и позволяет сделать окончательный вывод в пользу этой структуры:

| 
|
| I а, транс-, транс-
| I б, цис-, цис-
|
Сделать же отнесение конфигурации – цис-, цис- или транс-, транс- на основании представленных данных затруднительно (приводимые спектры принадлежать цис, цис-изомеру).
8. Совместное использование данных масс-спектров, ПМР и ЯМР13С для идентификации органического соединения
Задание:
Соединение, по условиям получения не содержащее азота, имеет спектры ПМР и ЯМР13С, представленные на рис. 23.
В масс-спектре этого вещества при энергии ионизации 12 эВ содержатся следующие пики с m/Z более 100:
185(1,3), 184(8,6), 154(4), 153(21), 152(90), 143(6), 130(5), 126(2), 125(11), 124(15), 122(2), 121(2), 120(12), 118(6), 117(100), 116(3), 114(2), 113(23), 114(4), 110(3), 108(3), 101(3), 100(49). Пик с m/Z прнебрежимо мал.

Рис. 23. ПМР и ЯМР13С – спектры вещества. ПМР –спектр – 100 МГц
Решение:
Из масс-спектра находим, что молекулярная масса соединения 184. По отсутствию заметного изотопного пика [М+2] можно заключить, что в состав молекулы могут входить только атомы С, Н и О. Гомологические координаты массового числа 184х=13, у=0. Пользуясь классификационной таблице ПVII, можно установить возможные брутто-формулы соединения: С13Н28, С14Н16, С12Н24О, С11Н20О2, С10Н16О3 и т.д. Брутто-формулу С14Н16 (формальная непредельность 7) следует исключить поскольку все соединения с такой непредельностью должны были бы давать в масс-спектре интенсивные пики молекулярных ионов, а в приведенном масс-спектре при 12 эВ этот пик невелик. Формула С13Н28 также исключается при анализе характеристических разностей ближайших к молекулярному осколочных ионов: в пределах массовых чисел до [М-50] два главных пика с m/Z 153 и 152 соответствуют частицам [М-31] и [М-32]. На основании этого можно утверждать, что соединение содержит метоксигруппу (группы), а число атомов углерода и кислорода равно 13.
Рассмотрим теперь спектр ЯМР13С с полным подавлением спин-спинового взаимодействия с протонами. В спектре наблюдаем 8 сигналов (триплет линий с центром при δс 76,9 м.д. соответствует растворителю – дейтерохлороформу), что указывает на наличие в молекуле соответствующего числа разновидностей атомов углерода. Проанализируем положение этих сигналов. Пик при δс 173,7 м.д. однозначно относится к карбонильному атому углерода фрагмента С-СО-О. Остальные сигналы находятся в области при δс <75 м.д., и поэтому их следует приписать насыщенным атомам углерода (сигнал с δс 73,6 м.д. попадает в область, характерную для концевых ацетиленовых и алленовых С-атомов, поэтому следовало бы ожидать появления наряду с ним также сигналов других С-атомов указанных фрагментов в более слабопольной области). Следовательно, соединение не содержит кратных углерод-углеродных связей. Относительно слабопольные сигналы при δс 73,6, 55,9 и 51,3 м.д. следует отнести к атомам С, находящимся в непосредственном соседстве с атомом кислорода. Анализ интенсивностей сигналов позволяет утверждать, что число атомов углерода десять, так как сигналы при δс 41,2 и 20,0 м.д. более чем в два раза превосходят все остальные сигналы и поэтому (с учетом суммарного числа атомов С и О) соответствуют двум атомам углерода каждый. Окончательный вывод (с учетом данных масс-спектрометрии): брутто-формула соединения С10Н16О3.
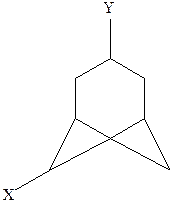
Обратимся к спектру ЯМР13С без подавления спин-спинового взаимодействия с протонами и выявим тонкую структуру семи сильнопольных сигналов (мультиплетность любого сигнала в спектре «без подавления» выявляется на том основании, что, во-первых, центр мультиплета совпадает с положением соответствующего сигнала в спектре «с полным подавлением», и, во-вторых, мультиплет симметричен относительно линии, проходящей через его центр). В направлении увеличения химического сдвига эти сигналы имеют следующие мультиплетности: триплет, дублет, дублет, квартет, квартет, дублет. Теперь очевидно, что с кислородом связаны две метильные группы и одна метиновая. Следовательно, все три имеющиеся в молекуле атома кислорода локализованы в двух фрагментах СН3О-С=О и СН-О-СН3. Кроме того, молекула содержит еще три метиновые группы и три метиленовые. Соответствующая найденной брутто-формуле формальная ненасыщенность равна 3. А поскольку одна единица ФН приходится на связь С=О, то заключаем, что углеродный скелет молекулы является бициклическим (ФН=2). Учитывая, что он должен включать три метиленовые группы, из которых две эквивалентные, и четыре метиновые, из которых также две эквивалентные, искомую структуру следует выбирать из следующих шести:

| 
| 
|
| (I)
| (II)
| (III)
|

| 
| 
|
| (IV)
| (V)
| (VI)
|
где Х – ОСН3, Y – СО2СН3.
При этом следует иметь в виду, что для каждой из представленных структур возможны четыре геометрических изомера.
Обратимся теперь к рассмотрению спектра ПМР. В нем наблюдается семь сигналов (в направлении увеличения напряженности поля): синглет 3,5 м.д., 3 Н; триплет 3,37 м.д., 1 Н; синглет 3,17 м.д., 3 Н; плохо разрешенный триплет 2,54 м.д., 2 Н; триплет 2,26 м.д., 1 Н; мультиплет 1,95-1,65 м.д., 4 Н; мультиплет 1,65 – 1,15 м.д., 2 Н. Наличие двух трехпротонных синглетов подтверждает присутствие в молекуле метаксикарбонильной и метоксильной групп.
Обратим внимание на два однопротонных триплета. Слабопольный из них должен быть приписан метиновому протону во фрагменте СН-О-СН3. Мультиплетность этого сигнала позволяет заключить, что соседям этой метиновой группы являются две эквивалентные метиновые группы. Таким образом, выявляется фрагмент >СН-СН(ОСН3)-СН<, которого не содержат структуры (I) и (IV). Другой однопротонный триплет отвечает также метиновой группе, соединенной с безводородным атомом углерода (СО2СН3 – группа) и двумя эквивалентными метиновыми группами. Таким образом, выявляется наличие фрагмента >СН-СН(СО2СН3)-СН<, объясняющего и наблюдаемый химический сдвиг (δ 2,26 м.д.) обсуждаемого протона. С эти выводом не согласуются структуры II, III и V. Таким образом, только структура VI содержит оба выявленных фрагмента. Остальные сигналы спектра ПМР также находят удовлетворительную интерпретацию, исходя из структуры VI: два сильнопольных сигнала отвечают триметиленовой цепочке, а двум эквивалентным метиновым протонам соответствует сигнал при 2,54 м.д. Отнесение последнего сигнала производится на основании четко выраженной асимметрии однопротонного триплета при δ 2,26 м.д.
Ответ:
Этим спектральным данным отвечает, следовательно, структура диметилового эфира 7-метоксинорпинан-6-карбоновой кислоты. Остается выяснить его конфигурацию. Сделаем это на основе спектра ПМР, а именно данных о величинах вицинальных констант спин-спинового взаимодействия (JНССН), получаемых из обсчетов триплетов, отвечающих протонам при С6 и С7. Обе эти константы, характеризующие взаимодействие указанных протонов с парой эквивалентных метиновых протонов при С1 и С5, для обсуждаемого соединения оказались одинаковыми и равными 6 Гц (0,06 м.д.*100 МГц=6 Гц). С другой стороны, учитывая известную зависимость вицинальной константы спин-спинового взаимодействия протонов от величины двугранного угла НССН (см. ПVIII), следовало ожидать, что в ряду геометрических изомеров будет характеризоваться специфичными для него величинами констант. Действительно, обратившись к геометрической модели норпинана, можно заметить, что двухгранный угол Н1ССН6-экзо составляет ~25º; ему соответствует константа J~6-7 Гц, а угол Н1-СС-Н6-эндо равен ~90º, что должно отвечать константе J~0 Гц. Полученные из спектра значения констант позволяют утверждать, что искомая молекула имеет конфигурацию с эндо-ориентацией как метоксильной, так и метоксикарбонильной групп:

Задачи на самостоятельное выполнение:
ИК-спектр
1. Установите, каким веществам принадлежат ИК-спектры, изображенные на рис. 24, если известно, что молекулярная масса соединения а не превышает 100, а соединения б имеет молекулярную массу около 60.
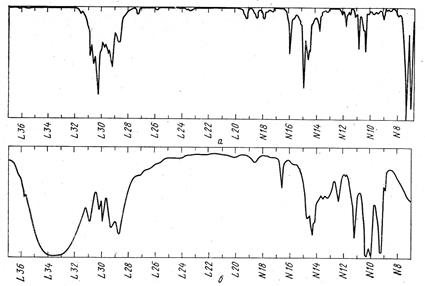
Рис. 24.
2. Укажите к каким классам могут принадлежать углеводород а и кислородное соединение б, спектры которых приведены на рис. 25.

3. Что можно сказать по ИК-спектру (рис. 26) о структуре вещества, содержащего 54,53 % углерода и 9,15 % водорода.

Рис. 26.
УФ-спектр
1. Установите строение кетона с молекулярной массой около 120, УФ-спектр которого этаноле представлен на рис. 27.

Рис. 27.
2. Какие выводы можно сделать о структуре карбоновой кислоты с молекулярной массой 138 при рассмотрении ее УФ-спектра (в этаноле) (рис. 28).

Рис. 28.
ПМР-спектр
1. Определите структуру двух изомерных нитросоединений С3H7NO2 по их спектрам (рис. 29).

Рис. 29.
2. Каково строение имеет производное карбоновой кислоты состава С6H13NO2, спектр ПМР которого показан на рис. 30? Соотношение интенсивностей сигналов в спектре равно 2:2:6:3.
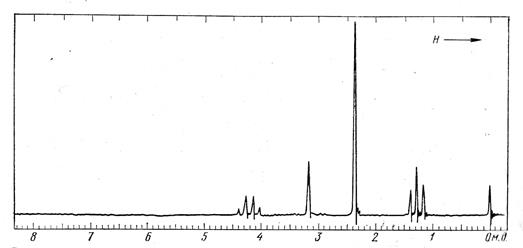
Рис. 30.
ЯМР-спектр
1. Какова структура углеводорода с т. кип. 60 ºС, имеющего спектра ЯМР13С:
19,5 (100), 34,0 (38).
2. Какова структура спектра спирта, имеющего следующий спектр ЯМР13С:
14,1 (65)к; 22,7 (81)т; 23,4 (100)к; 25,9 (98)т; 29,5 (80)т; 32,0 (75)т; 39,4 (86)т; 67,8 (86) д.
Масс-спектр
1. Сделайте заключение о строении двух содержащихся в нефти соединений, учитывая сравнительные относительные интенсивности пиков их спектров:
а) 107(3); 106(33); 105(6); 103(3); 92(8); 91(100); 89(2); 79(4); 78(7); 77(8); 65(8); 63(4); 52(4); 51(11); 50(4); 39(8);
б) 107(5); 106(63); 105(28); 104(3); 103(6); 92(8); 91(100); 89(2); 79(7); 78(7); 77(14); 65(7); 63(6); 62(2); 52(7); 51(14); 50(5); 39(14)
2. Что можно сказать о строении вещества, масс-спектр которого изображен на рис. 31?

Рис. 31.
3. Определите строение органических соединений, имеющих приведенные ниже спектры:
а) 61(3); 60(75); 45(98); 44(5); 43(100); 42(13); 41(4); 40(4); 31(3); 29(11);
б) 88(2,5); 87(1,5); 74(4); 73(31); 70(2); 61(5); 60(100); 55(9); 45(17); 44(4); 43(20); 42(22); 41(23); 40(2); 39(13); 38(3); 29(14).




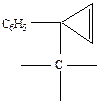
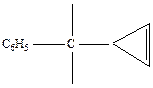


 - по уравнению (4.17). JАХ-JВХ=3 Гц,
- по уравнению (4.17). JАХ-JВХ=3 Гц,  74 Гц (1,85 м.д.),
74 Гц (1,85 м.д.),  58 Гц (1,44 м.д.),
58 Гц (1,44 м.д.),  113 Гц (2,83 м.д.), JАВ 8,5 Гц, JАХ 8 Гц, JВХ 5 Гц.
113 Гц (2,83 м.д.), JАВ 8,5 Гц, JАХ 8 Гц, JВХ 5 Гц.

 .
.
 , остальные два пика – в области сигналов
, остальные два пика – в области сигналов 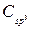 . Таким образом, очевидно, что ненасыщенность молекулы обусловлена прежде всего ароматическими кольцами и двойными связями С=С и С=О, но в молекуле нет тройных связей С ≡ С и алленовых фрагментов.
. Таким образом, очевидно, что ненасыщенность молекулы обусловлена прежде всего ароматическими кольцами и двойными связями С=С и С=О, но в молекуле нет тройных связей С ≡ С и алленовых фрагментов.






















