

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...
Топ:
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Интересное:
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Практические занятия
по дисциплине:
«Современные методы идентификации органических соединений»
Составитель:
К.т.н. Ногачева Э.Р.
Практическое занятие №1.
Практическое занятие №2
Использование масс-спектров для идентификации органических соединений
Масс-спектр имеющий и не имеющий пик молекулярного иона.
Задание: Установите структуру органического соединения по его масс-спектру:
88(3), 87(53), 73(1), 72(12), 58(1), 56(1), 45(22), 44(100), 43(44), 42(20), 41(3), 40(2), 31(3), 30(11), 29(2).
Решение:
Интенсивный пик с m/Z 87 можно отнести к молекулярному иону, что подтверждается наличием в спектре пика с m/Z 72=87-15. Слабый пик с m/Z 88 представляет собой изотопный пик. Соединение содержит нечетное число атомов азота, так кК имеет нечетную молекулярную массу. Выбор между его возможными брутто-формулами (см. ПXV) C5H13N, C3H9N3, C4H9NO, C3H5NO2 на основании интенсивности изотопного пика [М+1] ненадежен, так как для азотсодержащих соединений она обычно завышена.
Определение брутто-формулы вещества требует, таким образом, анализа гомологических серий осколочных ионов и характеристических разностей. Воспользовавшись табл. ПXVII, можно сделать следующее отнесение пиков:
| Ион [M-X] | |||
| Пик (m/Z) | y | Масса X | Возможные формулы Х |
| СН3 | |||
| С3Н6, СН2СО | |||
| С3Н7, СН3СО | |||
| С2Н4О, С2Н6N |
Ион [М-44] представляет собой фрагмент [M-C2H6N]+. Альтернативный осколочный ион [M-C2H4О]+. образуется в результате перегруппировки Мак-Лафферти алифатических альдегидов R(CH2)3CHO (R≥CH3) или изомерной им α– окисей, но они должны были бы иметь четную массу, большую 87 и крайне слабые пики молекулярных ионов.
В то же время пик [M-43] образуется только при отщеплении частиц, не содержащих азота (С3Н7 или СН3СО), так же как и пик [M-42] (С3Н6 или СН2СО). Сопоставляя состав фрагментов с массой 44 и 43, теряемых молекулярными ионами скорее всего в результате параллельных процессов фрагментации, можно оставить для дальнейшего рассмотрения лишь две возможные брутто формулы:
|
|
С2Н6N+ С3Н7= С5Н13N
С2Н6N+ С2Н3О= С4Н9NO
Алифатические амины характеризуются главным образом осколочными ионами только серии 2, тогда как в данном спектре наряду с пиками серии 2 (m/Z 30, 44, 72) наблюдаются интенсивные пики серии 3 (m/Z 45) и 1 (m/Z 43). Поэтому неизвестному веществу может быть приписана только формула С4Н9NO (ФН=1). Такую формулу имеют, например, амиды кислот, оксимы и их эфиры и соединения других классов, но, как в спектре присутствуют типичные для ацетильных производных пики [M-CH3CO]+ и [M-CH2CO]+, можно утверждать, что вещество является амидом уксусной кислоты с одной из двух альтернативных формул CH3CONHC2H5 или CH3CON(CH3)2.
Ответ:
При наличии группы NHC2H5 преобладал бы β-распад с последующими отщеплением ионами [M-CH3]+ с m/Z 72 частиц CH2CO, приводящий к пикам ионов [M-CH3- CH2CO]+ с m/Z 30, которые должны были бы быть интенсивными. В данном же случае эти пики имеют меньшую интенсивность по сравнению с пиками ионов [M-CH3CO]+ и [M-CH2CO]+, что позволяет однозначно приписать соединению структуру диметиацетамида.
Практическое занятие №3
Использование ИК-спектров для идентификации органических соединений.
Практическое занятие №4
Практическое занятие №5
Использования спектров ЯМР13С для идентификации органических веществ
1. ЯМР13С-спектр полученный с полным подавлением спин-спинового взаимодействия.
Задание:
Определить строение углеводорода по спектру ЯМР13С с полным подавлением спин-спинового взаимодействия (рис. 10).

Рис. 10. ЯМР13С –спектр вещества
Решение:
Визуально на спектре можно отметить 7 линий, однако, как видно из значений химических сдвигов, отпечатанных на спектрограмме, спектр состоит из 8 линий. Сигналы 3 и 4 имеют близкие значения химических сдвигов и при данном масштабе записи почти неразличимы. Первые шесть линий, находящиеся в сильном поле (δс<35 м.д.), на основании химического сдвига следует отнести к углеродным атомам в алифатической цепи или в алицикле с боковым радикалом. Поскольку интенсивности сигналов близки и в спектре нет сигналов с δс от 35 до 60 м.д., можно заключить, что углеродный скелет молекулы неразветвлен (точнее: в молекуле нет такого углеродного атома, по соседству с которым находился бы третичный или четвертичный атом углерода).
|
|
В слабом поле имеются два сигнала, которые на основании химических сдвигов могут принадлежать углеродным атомам, образующим несимметрично замещенную двойную связь. При этом сигнал с δс114,1 м.д. по химическому сдвигу соответствует СН2-группе. Сигнал в слабом поле при δс 139 м.д., имеющий в 1,5 раза меньшую интенсивность, можно отнести к группировке =СН-. Таким образом, в углеводороде имеется однозамещенная двойная связь нормальными алкильным радикалом из 6 атомов углерода.
Ответ:
Следовательно искомый углерод – 1-октен.
Для подтверждения этого вывода вычислим химические сдвиги атомов углерода в 1-октене по ПXI. Химические сдвиги в алкильном радикале вычисляем по ПXII для гексана с учетом влияния двойной связи на α-, β- и γ-углеродные атомы по ПXIII. Химические сдвиги олефиновых углеродных атомов вычисляем также по ПXIII. Результаты вычислений приведены ниже (м.д.):







 .
.
В скобках даны экспериментальные значения химических сдвигов углеродных атомов. Хорошее соответствие рассчитанных и опытных величин подтверждает правильность отнесения сигналов и установления строения углеводорода.
2. ЯМР13С -спектр для соединения известного состава (с установленной брутто-формулой).
Задание: Каково строение соединения С6Н13N, спектр ЯМР13С которого представлен на рис. 11.

Рис. 11. ЯМР13С – спектр вещества
Решение:
Поскольку соединение имеет формальную непредельность, равную 1, в спектре нет сигналов в области δс>100 м.д., характерной для атомов углерода связей С=С и С=N, то делаем вывод о циклической структуре молекулы. Спектр содержит шесть сигналов, следовательно, все углеродные атомы в молекуле химически эквивалентны. Из мультиплетности сигналов заключаем, что соединение содержит одну метильную, одну метиновую и четыре метиленовые группы. Учитывая брутто-формулу, приходим к выводу, что в молекуле присутствует также группировка NH (соединения является вторичным амином). Наличие одной метильной группы указывает на то, что цикл имеет одно ответвление, представляющее собой нормальную цепь. При этом группировка NH может находиться только в составе цикла, поскольку в молекуле нет химически эквивалентных атомов углерода. Следовательно, искомое соединение – гетероцикл с одной боковой н-алкильной группой.
|
|
Сигналы в слабом поле (триплет при δс 47,3 м.д. и дублет при δс 52,4 м.д.) следует отнести непосредственным соседям группировки NH, что указывает на наличие фрагмента
 .
.
Таким образом, боковая алкильная группа находится при α-углеродном атоме гетероцикла. Остается выяснить размер гетероцикла и боковой цепи. С этой целью обсудим химические сдвиги остальных атомов. Поскольку они не находятся в непосредственном соседстве с атомом азота, то влияние последнего на них невелико. Поэтому химические сдвиги их обусловлены только особенностями углеродного скелета. Учитывая, что различие в химических сдвигах атомов С метиленовых или метильных групп в основном определяется типом атома С их непосредственных соседей (с. 140), приходим к выводу, что одна метиленовая группа, имеющая слабопольный химический сдвиг (δс 34,9 м.д.), соседствует с СН2- и СН-группами, а две другие с близкими химическими сдвигами (δс 25,0 и 26,3 м.д.) в качестве соседей могут иметь либо только СН2- группы, либо СН и СН3-группы. Этим выводам не отвечают структуры (I) и (II), но удовлетворяют структуры (III) и (IV):
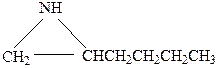
| 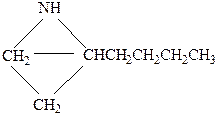
|
| I | II |

| 
|
| III | IV |
Ответ:
Выбор в пользу структуры IV можно сделать по химическому сдвигу атома С метильной группы (δс 23,1 м.д.). Близость его к химическим сдвигам метиленовых групп можно объяснить допущением, что метильная группа находится у метиленового атома С, что и имеет место в структуре (IV).
3. ЯМР13С-спектр для соединений с известной молекулярной массой
Задание:
Определить строение кислородсодержащего соединения с молекулярной массой около 145 на основании спектров ЯМР13С, представленных на рис. 12.
|
|
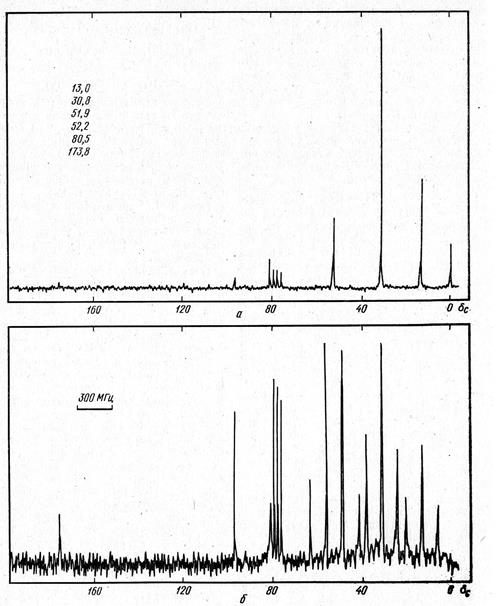
Рис. 12. ЯМР13С-спектр вещества (спектр вещества в СCl4 в CDCl3)
Решение:
На основании молекулярной массы находим, что общее число атомов С и О в молекуле равно 10 (145:14≈10). В спектре, полученном при подавлении спин-спинового взаимодействия с протонами (рис. 12, а) наблюдаем помимо сигналов растворителей (дейтерохлороформа и четыреххлористого углерода) шесть сигналов, указывающих число разновидностей атомов в молекуле. Сигнал при δс 173,8 м.д. на основании его малой интенсивности и величины химического сдвига следует отнести атому углерода фрагмента О-С=0. Поскольку остальные сигналы располагаются в области δс <100 м.д., то можно утверждать отсутствие в молекуле олефиновых и ароматических связей С=С.
Обратимся к спектру, полученному без подавления спин-спинового взаимодействия с протонами (рис. 12, б). Анализируя химические сдвиги, мультиплетность и относительную интенсивность пяти сильнопольных сигналов можно сделать следующие заключения:
1) синглет при δс 80,5 м.д. отвечает одному четвертичному атому углерода, связанному с атомом кислорода;
2) квартеты при δс 51,9 и 52,2 м.д. соответствуют неэквивалентным метильным группам, каждая из которых связана с атомом О;
3) триплеты при δс 13,0 и 30,8 м.д. соответствует метиленовым группам.
При этом, поскольку интенсивность слабопольного сигнала примерно вдвое выше интенсивности сильнопольного сигнала, то можно принять, что более интенсивный сигнал отвечает двум эквивалентным СН2-группам. Таким образом, в молекуле присутствует 7 атомов углерода и, следовательно (поскольку общее число атомов С и О равно 10), 3 атома кислорода. При этом очевидно, что все атомы О вовлечены в два фрагмента:
 и
и  .
.
Теперь можно установить молекулы:
СО2СН3+СОН3+3СН2=С7Н12О3.
Состав согласуется с молекулярной массой. Поскольку в соединении обнаружена только одна кратная связь С=О, а формальная непредельность брутто-формулы равна 2, то заключаем наличие в молекуле кольца.
Ответ: Только две структуры удовлетворяют сделанным выводам о строении молекулы, а именно:

| 
|
| I | II |
Выбор между ними можно сделать на основании констант спин-спинового взаимодействия JСН, выявляемых из анализа триплетных сигналов метиленовых групп. Наблюдаемые константы JСН, примерно одинаковы (~140 Гц) и соответствуют циклобутановым СН2-группам, что согласуется только со структурой I. Структура II предполагает для циклопропановых метиленовых групп большие константы JСН (~150 Гц), а для СН2группы боковой цепи – обычное значение JСН (~125 Гц). Кроме того, химический сдвиг двух эквивалентынх СН2-групп (30,8 м.д.) никак не согласуется со структурой II, поскольку циклопропановые атомы С характеризуются меньшими значениями химических сдвигов (см. ПХ).
|
|
Практическое занятие №6
Использования спектров ПМР для определения строения веществ
Практическое занятие №7-9
ИК-спектр
1. Установите, каким веществам принадлежат ИК-спектры, изображенные на рис. 24, если известно, что молекулярная масса соединения а не превышает 100, а соединения б имеет молекулярную массу около 60.
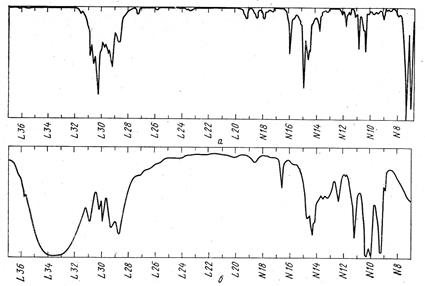
Рис. 24.
2. Укажите к каким классам могут принадлежать углеводород а и кислородное соединение б, спектры которых приведены на рис. 25.

3. Что можно сказать по ИК-спектру (рис. 26) о структуре вещества, содержащего 54,53 % углерода и 9,15 % водорода.

Рис. 26.
УФ-спектр
1. Установите строение кетона с молекулярной массой около 120, УФ-спектр которого этаноле представлен на рис. 27.

Рис. 27.
2. Какие выводы можно сделать о структуре карбоновой кислоты с молекулярной массой 138 при рассмотрении ее УФ-спектра (в этаноле) (рис. 28).

Рис. 28.
ПМР-спектр
1. Определите структуру двух изомерных нитросоединений С3H7NO2 по их спектрам (рис. 29).

Рис. 29.
2. Каково строение имеет производное карбоновой кислоты состава С6H13NO2, спектр ПМР которого показан на рис. 30? Соотношение интенсивностей сигналов в спектре равно 2:2:6:3.
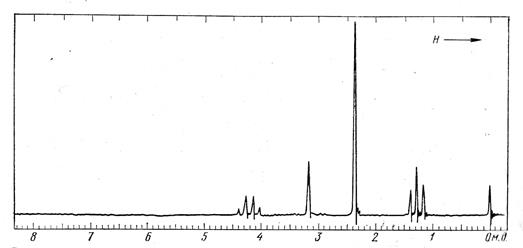
Рис. 30.
ЯМР-спектр
1. Какова структура углеводорода с т. кип. 60 ºС, имеющего спектра ЯМР13С:
19,5 (100), 34,0 (38).
2. Какова структура спектра спирта, имеющего следующий спектр ЯМР13С:
14,1 (65)к; 22,7 (81)т; 23,4 (100)к; 25,9 (98)т; 29,5 (80)т; 32,0 (75)т; 39,4 (86)т; 67,8 (86) д.
Масс-спектр
1. Сделайте заключение о строении двух содержащихся в нефти соединений, учитывая сравнительные относительные интенсивности пиков их спектров:
а) 107(3); 106(33); 105(6); 103(3); 92(8); 91(100); 89(2); 79(4); 78(7); 77(8); 65(8); 63(4); 52(4); 51(11); 50(4); 39(8);
б) 107(5); 106(63); 105(28); 104(3); 103(6); 92(8); 91(100); 89(2); 79(7); 78(7); 77(14); 65(7); 63(6); 62(2); 52(7); 51(14); 50(5); 39(14)
2. Что можно сказать о строении вещества, масс-спектр которого изображен на рис. 31?

Рис. 31.
3. Определите строение органических соединений, имеющих приведенные ниже спектры:
а) 61(3); 60(75); 45(98); 44(5); 43(100); 42(13); 41(4); 40(4); 31(3); 29(11);
б) 88(2,5); 87(1,5); 74(4); 73(31); 70(2); 61(5); 60(100); 55(9); 45(17); 44(4); 43(20); 42(22); 41(23); 40(2); 39(13); 38(3); 29(14).
Ответы
1. ИК-спектр: 1 – этилацетат;
2 – а) толуол; б) аллиловый спирт;
3 – а) н-октан; б) диизопропиловый эфир.
2. УФ-спектр: 1 – ацетофенон;
2 – 2,4,6-октатриеновая кислота.
3. ПМР-спектр: 1 – 1- и 2-нитропропаны;
2 – этиловый эфир N,N-диметиламиноуксусной кислоты.
4. ЯМР-спектр: 1 – 2,3-диметилбутан;
2 – 2-октанол.
5. Масс-спектр: 1 – а) этилбензол; б) ксилол;
2 – диметилэтиламин;
3 – а) уксусная кислота; б) масляная кислота.
6. Совместное использование: 1 – н-пропиловый спирт;
2 – метилбутират;
3 – н-бутилацетат;
4 – циклогенсен;
5 – изопрен.
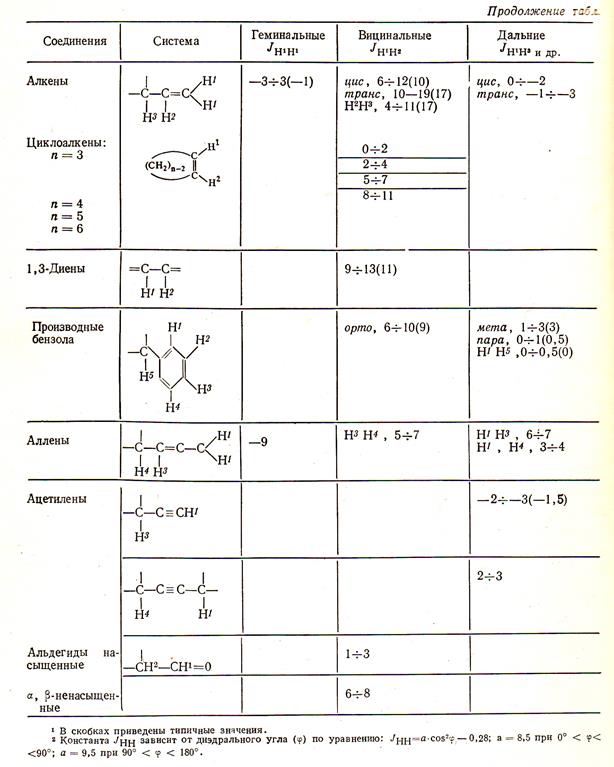
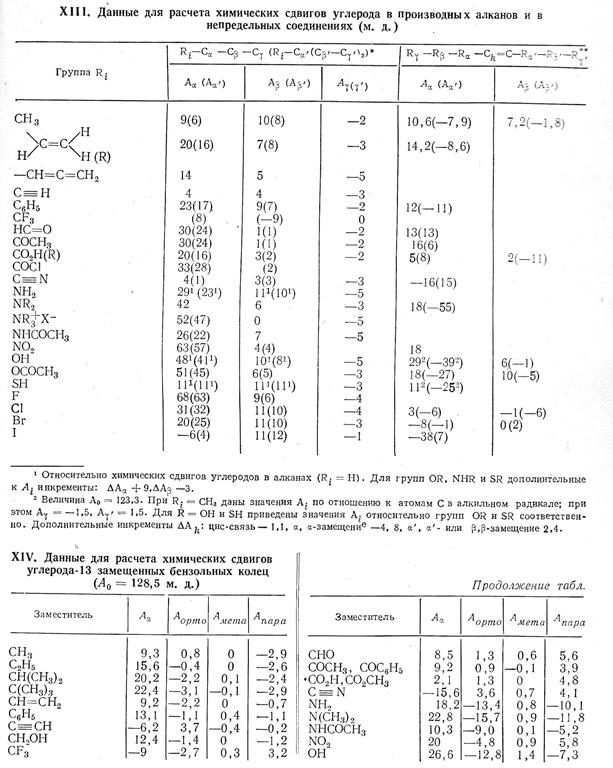
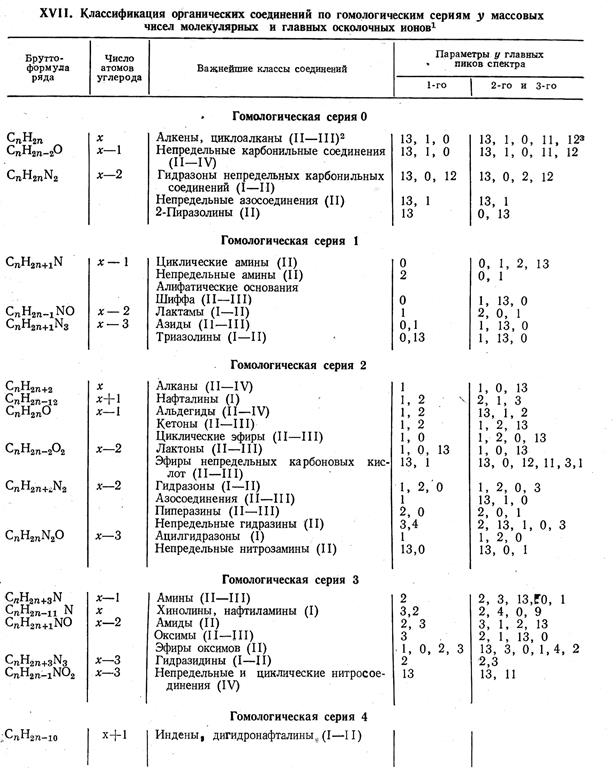
Вспомогательные материалы на практических занятиях:
Таблица 1
Справочные таблицы















Практические занятия
по дисциплине:
«Современные методы идентификации органических соединений»
Составитель:
К.т.н. Ногачева Э.Р.
Практическое занятие №1.
Использование УФ-спектров для идентификации органических соединений
1. УФ-спектр для соединения известного состава (с установленной брутто-формулой).
Задание:
Высказать соображение о строении соединения С9Н10О на основании УФ спектра (рис.1).

Рис. 1. Спектр вещества в этаноле
Решение:
УФ-спектр соединения включает три полосы поглощения: сильную полосу в коротковолновой части спектра, проявляющуюся в виде перегиба на концевом поглощении (концевым поглощением называют постепенное увеличение интенсивности поглощения с уменьшением длины волны у коротковолнового конца спектра) (υ~48 000см-1, λ 208 нм, lgε~3,9), полосу средней интенсивности с тонкой структурой (υ~39 000см-1, λ 256 нм, lgε~2,35) и самую слабую полосу в длинноволновой части спектра (υ~35 000см-1, λ 286 нм, lgε~2,15). Характеристики первых двух полос позволяют отнести их соответственно к Е- и В- полосам бензольного хромоформа. Предположение о присутствии бензольного ядра (ФН=4) согласуется с брутто-формулой соединения (ФН=5). Параметры длинноволновой полосы позволяет связывать ее происхождение с n→π*-переходом (R-полоса) в изолированном карбольнильном хромофоре и тем самым обнаружить присутствие в молекуле альдегидной и кетонной функции, с которой в свою очередь, может быть соотнесен пятый элемент ФН молекулы. Завышенную интенсивность этой полосы (ε 175) по сравнению со стандартным значением (ε 20) отчасти можно объяснить эффектом наложения R-полосы на более интенсивную В-полосу. Таким образом, установлено присутствие двух изолированных хромофоров – бензольного и карбонильного. Гипотеза их сопряженного расположения несостоятельна не только потому, что она не находит подтверждения в характеристиках наблюдаемых В- и R-полос, но прежде всего из-за отсутствия интенсивной (lgε>4) К-полосы в области 240 нм, характерной для бензальдегида или ацетофенона. Идентифицированные структурные элементы могут быть связаны в молекуле С9Н10О шестью способами (метилбензилкетон, три изормерных толилацетальдегида, α- и β-фенилпропионовые альдегиды), выбор между которыми не может быть надежным на основании только УФ-спектра. Любая дополнительная информация-ИКС, ПМР- позволила бы однозначно определить строение.
Ответ: Приведенный спектр соответствует метилбензилкетону.
2. УФ-спектр для соединения со сведениями о происхождении, синтезе или превращениях соединений
Задание
Высказать соображения о строении углеводорода С10Н12, УФ-спектр которого представлен на рис. 2, если известно также, что он легко гидрируется на палладиевом катализаторе с поглощением эквимолекулярного количества водорода.
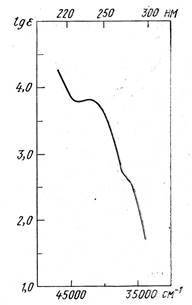
Рис. 2. Спектр вещества
Решение
Брутто-формула свидетельствует о высокой непредельности углеводорода (ФН=5). Поскольку соединения поглощает только один эквивалент водорода, то в нем присутствует лишь одна двойная связь, а остальная формальная непредельность приходится на систему кратных связей и (или) циклов, относительно инертную к гидрировании. Отметим, что такой системой может быть бензольное ядро (ФН=4). Обратимся теперь к анализу спектра, включающего интенсивное концевое поглощение (λ 215 нм, lgε=4,3), полосу при υ~42 000см-1, λ 238 нм (lgε~3,8) и плечо при υ~36 000см-1, λ 278 нм (lgε~2,65). Концевое поглощение и плечо вполне могут быть отнесены соответственно к Е- и В-полосам бензольного хромоформа. Относительная интенсивная полоса при 238 нм свидетельствует о наличии сопряженного хромофора, каковым при сделанных допущениях может быть только стирольный хромофор. Между тем К-полоса самого стирола (см. ПIIIB) и более длинноволновая и более интенсивная. Стало быть искомая структура должна иметь такое алкильное замещение (две метильные или одна этильная группы) при стирольном хромофоре, которое бы приводило к нарушению его копланарности и, следовательно, к уменьшению λ и εК-полосы. Из простых соображений стереохимии этим требованиям отвечают следующие четыре структуры, которые следует рассматривать как альтернативные для сообщаемых условий:

|

|
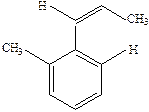
|

|
| I | II | III | IV |
Ответ: УФ-спектр, изображенный на рис. 2, отвечает 2,6 –диметистиролу (I).
Практическое занятие №2
|
|
|

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!