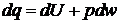 (1.10)
(1.10)
Если dq сообщить рабочему телу при постоянном объеме, то:
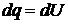
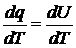
 (1.11)
(1.11)
Пологая, что уравнение подчиняется уравнению Клайперона, обычно одновременно пренебрегают зависимостью теплоемкостей  и
и 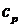 от температуры и считают их постоянными величинами. Если при этом положить, что T=0 и U=0, то получим формулу:
от температуры и считают их постоянными величинами. Если при этом положить, что T=0 и U=0, то получим формулу:
 (1.12)
(1.12)
Если теплота сообщается рабочему телу при постоянном давлении:

т.к. газ считается идеальным:


 (1.13)
(1.13)
 (1.13.а)
(1.13.а)
Отношение теплоемкостей
 (1.14)
(1.14)
Для идеального газа  .
.
Величина  для любого газа можно определить априорно.
для любого газа можно определить априорно.
 для однородного газа определяется числом атомов в молекуле.
для однородного газа определяется числом атомов в молекуле.
- для одноатомного газа 
- для двухатомного газа 
- для трех и более атомных газов 
Из (1.14) и (1.13) получим формулы, определения  и
и 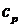
 (1.15)
(1.15)
 (1.15.а)
(1.15.а)
Из формул (1.15), (1.15.а) и (1.12) получаем
 (1.16)
(1.16)
 (1.17)
(1.17)
Если рабочим телом является смесь идеальных газов, то
 (1.18)
(1.18)
В термодинамике даются общие зависимости, позволяющие при известном термодинамическом уравнении состояния получить аналитические выражения для удельных теплоемкостей ( и
и 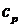 ), удельной энтальпии.
), удельной энтальпии.
Приведем без вывода зависимости, определяющие удельную внутреннюю энергию и дельную энтальпию для газа Ван-Дер Вальса:
 (1.19)
(1.19)
Теплоемкость, виды теплоемкости
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяемая отношением бесконечно малого количества теплоты δ Q, полученного телом, к соответствующему приращению его температуры δ T [1]:
{\displaystyle C={\delta Q \over \delta T}.}
Удельная, объёмная и молярная теплоёмкости[править | править вики-текст]
Удельной теплоёмкостью называется теплоёмкость, отнесённая к единичному количеству вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоёмкость, различают массовую, объёмную и молярную теплоёмкость.
Массовая удельная теплоёмкость (С), также называемая просто удельной теплоёмкостью — это количество теплоты, которое необходимо подвести к единице массы вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на килограмм на кельвин (Дж·кг−1·К−1).
Объёмная теплоёмкость (С′) — это количество теплоты, которое необходимо подвести к единице объёма вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на кубический метр на кельвин (Дж·м−3·К−1).
Молярная теплоёмкость (С μ) — это количество теплоты, которое необходимо подвести к 1 молю вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на моль на кельвин (Дж/(моль·К)).
Теплоёмкость для различных процессов и состояний вещества[править | править вики-текст]
Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов), так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоёмкости электронного газа).
Для примера, в молекулярно-кинетической теории газов показывается, что молярная теплоёмкость идеального газа с i степенями свободы при постоянном объёме (для одного моля идеального газа) равна:
{\displaystyle c_{v}={\frac {i}{2}}R,}
где {\displaystyle R} ≈ 8,31 Дж/(моль·К) — универсальная газовая постоянная.
А при постоянном давлении
{\displaystyle c_{p}=c_{v}+R={\frac {i+2}{2}}R.}
Переход вещества из одного агрегатного состояния в другое сопровождается скачкообразным изменением теплоёмкости в конкретной для каждого вещества температурной точке превращения — температура плавления (переход твёрдого тела в жидкость), температура кипения (переход жидкости в газ) и, соответственно, температуры обратных превращений: замерзания и конденсации.
Удельные теплоёмкости многих веществ приведены в справочниках обычно для процесса при постоянном давлении. К примеру, удельная теплоёмкость жидкой воды при нормальных условиях — 4200 Дж/(кг·К); льда — 2100 Дж/(кг·К).
Теория теплоёмкости[править | править вики-текст]




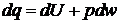 (1.10)
(1.10)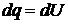
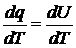
 (1.11)
(1.11) и
и 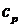 от температуры и считают их постоянными величинами. Если при этом положить, что T=0 и U=0, то получим формулу:
от температуры и считают их постоянными величинами. Если при этом положить, что T=0 и U=0, то получим формулу: (1.12)
(1.12)


 (1.13)
(1.13) (1.13.а)
(1.13.а) (1.14)
(1.14) .
. для любого газа можно определить априорно.
для любого газа можно определить априорно.


 (1.15)
(1.15) (1.15.а)
(1.15.а) (1.16)
(1.16) (1.17)
(1.17) (1.18)
(1.18) (1.19)
(1.19)



