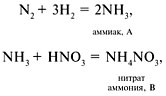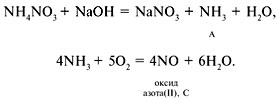Тест по теме «Химические свойства металлов» 9 класс
Необходимо выбрать один верный ответ в заданиях 1-11, в задании 12 – установить соответствие
| 1. И литий, и цинк при комнатной температуре реагируют с
|
|
| 1)
| гидроксидом натрия
| |
| 2)
| водой
| |
| 3)
| серой
| |
| 4)
| соляной кислотой
| |
| 2. Кальций вступает в реакцию с каждым из двух веществ:
|
| | 1)
| магний и соляная кислота
| | | 2)
| вода и гидроксид калия
| | | 3)
| гидроксид натрия и соляная кислота
| | | 4)
| соляная кислота и хлор
| |
| 3. Осадок гидроксида магния растворится при взаимодействии с раствором
|
| | 1)
| хлорида кальция
| | | 2)
| соляной кислоты
| | | 3)
| фосфата натрия
| | | 4)
| гидроксида калия
| |
| 4. И магний, и натрий при комнатной температуре энергично реагируют с
|
| | 1)
| водой
| | | 2)
| соляной кислотой
| | | 3)
| гидроксидом бария
| | | 4)
| карбонатом кальция
| |
| 5. И с цинком, и с медью реагирует
|
| | 1)
| хлор
| | | 2)
| оксид углерода(II)
| | | 3)
| гидроксид натрия
| | | 4)
| соляная кислота
| 6. Алюминий не реагирует с раствором
| | | 1)
| серной кислоты
| | | 2)
| сульфата магния
| | | 3)
| гидроксида натрия
| | | 4)
| нитрата меди(II)
| |
| |
| 7. Для растворения гидроксида железа(II) можно использовать раствор
|
| | 1)
| гидроксида натрия
| | | 2)
| серной кислоты
| | | 3)
| нитрата натрия
| | | 4)
| хлорида бария
| |
| 8. Какое(-ие) из перечисленных веществ: Cu, CuO, Cu(OH)2, CuCl2, реагирует(-ют) с раствором соляной кислоты?
| |
| 1)
| только CuO
| |
| 2)
| только Cu(OH)2
| |
| 3)
| CuO и Cu(OH)2
| |
| 4)
| Сu, Cu(OН)2 и CuCl2
| |
|
|
|
| 9. И железо, и цинк при комнатной температуре реагируют с
|
|
| 1)
| гидроксидом магния
| |
| 2)
| оксидом углерода(II)
| |
| 3)
| cульфатом меди(II)
| |
| 4)
| водой
| |
| 10. Железо вступает в реакцию с каждым из двух веществ:
|
|
| 1)
| Na2S и Hg(NO3)2
| |
| 2)
| Al(OH)3 и S
| |
| 3)
| MgCl2 и H2O
| |
| 4)
| CuSO4 и O2
| |
11. С каждым из перечисленных веществ – Fe, NaOH, Na2S –
| реагирует
|
|
| 1)
| Ca(NO3)2
|
| 2)
| KCl
|
| 3)
| Cu(NO3)2
|
| 4)
| MgSiO3
| |
| 12. Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
|
|
| | НАЗВАНИЕ ВЕЩЕСТВА
|
| РЕАГЕНТЫ
| | А)
| гидроксид бария
| | Б)
| оксид алюминия
| | В)
| хлорид меди(II)
| |
| | 1)
| KOH, AgNO3(р-р)
| | 2)
| Na2SO4, H2S
| | 3)
| MgO, Cl2
| | 4)
| HCl(р-р), NaOH(р-р)
| | |
Ответы:
Тест по теме «Кислород»
Необходимо выбрать один верный ответ
1. Кислород открыли и впервые получили два великих химика:
а) А. Лавуазье;
б) Дж. Пристли;
в) Г. Кавендиш;
г) Г. Дэви.
Укажите свойства кислорода.
а) легче воздуха;
б) имеет температуру кипения +5500С
в) в жидком состоянии – светло-голубого цвета;
г) 98% объема воздуха – кислород
3. Кислород является родоначальником группы:
а) 7, галогенов
б) 6, халькогенов
в) 1, неметаллов
г) 6, галогенов
4. При взаимодействии кислорода с натрием образуется:
а) пероксид
б) солеобразующий оксид
в) амфотерный оксид
г) щелочь
5. Сумма коэффициентов в уравнении разложения перманганата калия (получение кислорода в лаборатории):
а) 7
б) 9
в) 4
г) 5
Определите ряд, где находятся формулы только оксидов.
а) K2O, KOH, NaNО3, H3 PO4, CO2
б) Mn2O7, MgO, P2O5, Nа2О, Fe2O3
в) H2SO4, NaOH, SiO2, HClO4, P2O5
г) H2CO3, HNO3, H2O, Cl2O7, MgO
Какое из уравнений реакций отражает процесс окисления кислорода?
а) S+O2=…
б) Al + O2 =…
в) F2+H2O=…
г) Nа + O2 =…
8. Озон, в отличие от кислорода:
а) имеет более высокую химическую активность
б) не может быть в твердом виде
в) является сложным веществом
г) имеет меньшую величину относительной молекулярной массы
Укажите признаки, по которым различаются реакции горения и медленного окисления.
а) горение протекает быстро, выделяется свет, при медленном окислении процесс идет замедленно, свет обычно не выделяется
б) при горении выделяется кислота
в) при горении образуется только углекислый газ
г) горение протекает медленно, выделяется свет, при медленном окислении процесс идет быстро, свет обычно не выделяется
10. В промышленности кислород получают:
а) разложение пероксида водорода в присутствии катализатора
б) разложением перманганата калия
в) разложением пероксида водорода без катализатора
г) фракционный перегонкой жидкого воздуха
Ключи к тесту по теме «Кислород»
Ответы
ЕГЭ-2017 ЗАДАНИе 15. ХАРАКТЕРНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДСОДЕРЖАЩИХ СОЕДИНЕНИЙ
1. Из предложенного перечня выберите два вещества, с которыми реагирует формальдегид.
1) Cu
2) N2
3) H2
4) Ag2O (NH3 р-р)
5) CH3OCH3
Запишите в поле ответа номера выбранных веществ.
Из предложенного перечня выберите два вещества, с которыми реагирует уксусный альдегид.
1) аммиачный раствор оксид серебра (I)
2) оксид кальция
3) кислород
4) гидроксид натрия
5) серебро
Запишите в поле ответа номера выбранных веществ.
3. Из предложенного перечня выберите два вещества, с которыми реагирует этанол.
1) гидроксид меди (II)
2) гидроксид бария
3) натрий
4) соляная кислота
5) циклобутан
Запишите в поле ответа номера выбранных веществ.
Из предложенного перечня выберите два вещества, которые взаимодействуют и с формальдегидом, и с муравьиной кислотой и превращают их в углекислый газ.
1) O2
2) Ag2O (NH3)
3) H2
4) NaOH
5) NaHCO3
Запишите в поле ответа номера выбранных веществ.
X Y
CO2--------- Na2CO3 ---------- CaCO3
Определенной группе.
| ФОРМУЛА СОЛИ
| ГРУППА СОЛЕЙ
|
| А) ZnSО4
Б) Сu2(OH)2CO3
В) KAl(SO4)2
Г) NaHSO4
| 1) кислая
2) средняя
3) основная
4) двойная
5) комплексная
|
Соединений.
| ФОРМУЛА ВЕЩЕСТВА
| КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
|
| А) H3AsO4
Б) BeO
В) Ca(OH)Cl
Г) SO3
| 1) кислота
2) основание
3) основной оксид
4) амфотерный оксид
5) кислотный оксид
6) соль
|
Общая формула алкенов
1) СnH2n–6 2) CnH2n–2 3) CnH2n 4) CnH2n+2
Вариант 1
А 1. Щелочные металлы – это:
а) р-элементы б) f-элементы в) s-элементы
А 2. В ряду от лития к францию атомный радиус:
а) увеличивается б) уменьшается в) не изменяется
А 3. При сгорании лития пламя окрашивается в:
а) красный цвет б) желтый цвет в) фиолетовый цвет
А 4. Оксид калия обладает свойствами:
а) основными б) кислотными в) амфотерными
А 5. На внешнем энергетическом уровне атомы щелочных металлов имеют:
а) 1 электрон б) 2 электрона в) 3 электрона
А 6. В реакциях с неметаллами щелочные металлы являются:
а) окислителями б) восстановителями
А 7. Натрий получают способом:
а) пирометаллургическим б) гидрометаллургическим в) электролизом
А 8. При взаимодействии натрия с кислородом образуется:
а) оксид натрия б) гидроксид натрия в) пероксид натрия
А 9. Пищевая сода имеет формулу:
а) Na2SO4 б) Na2CO3 в) NaHCO3 г) NaCl
А 10. Гидроксид натрия реагирует с каждым из двух веществ:
а) CO2, KNO3 б) Al(OH)3, CuCl2
в) Cu(NO3)2, K2SO4 г) CaO, H2SO4
Вариант 2
А 1. На внешнем энергетическом уровне щелочные металлы содержат
а) 1 электрон б) 2 электрона в) 3 электрона
А 2. В ряду от лития к францию восстановительные свойства:
а) увеличивается б) уменьшается в) не изменяется
А 3. При сгорании натрия пламя окрашивается в:
а) красный цвет б) желтый цвет в) фиолетовый цвет
А 4. Оксид натрия обладает свойствами:
а) основными б) кислотными в) амфотерными
А 5. Вид химической связи в молекуле хлорида натрия:
а) ковалентная полярная б) ковалентная неполярная
в) ионная г) металлическая
А 6. Верны ли суждения:
1) Соли щелочных металлов твердые кристаллические вещества ионного строения.
2) Гидроксиды щелочных металлов – твердые белые вещества, очень гигроскопичны.
а) верны оба суждения б) верно только 1 в) верно только 2
А 7. Калий получают способом:
а) пирометаллургическим б) гидрометаллургическим в) электролизом
А 8. При взаимодействии калия с кислородом образуется:
а) оксид калия б) гидроксид калия в) надпероксид калия
А 9. Кислая соль имеет формулу:
а) Na2SO4 б) Na2CO3 в) NaHCO3 г) NaCl
А 10. Оксид натрия реагирует с каждым из двух веществ:
а) CO2, KNO3 б) Al(OH)3, CuCl2
в) Cu(NO3)2, K2SO4 г) CO2, H2SO4
Ответы:
1 вариант.
А1. в)
А2. а)
А3. а)
А4. а)
А5. а)
А6. б)
А7. в)
А8. в)
А9. в)
А10. б)
2 вариант.
А1. а)
А2. а)
А3. б)
А4. а)
А5. в)
А6. а)
А7. в)
А8. в)
А9. в)
А10. г)
Часть 2
1. Оксид кремния вступает в реакцию с:
1) водой
2) гидроксидом натрия
3) оксидом фосфора(V)
4) соляной кислотой
5) карбонатом кальция
Ответ________
2. Оксид углерода(IV) реагирует с:
1) гидроксидом кальция
2) хлоридом меди(II)
3) оксидом серы (VI)
4) углеродом
5) азотной кислотой
Ответ_______
3. Установите соответствие между схемой превращения и изменением степени окисления восстановителя в ней:
| Схема превращений
| Изменение степени окисления восстановителя
|
| tº
А) Ca3(PO4)2 + C + SiO2 → P + CO + CaSiO3
| 1) Э+2 → Э+4
|
| tº
Б) Cr2O3 + CO → Cr + CO2
| 2) Э+2 → Э+6
|
| tº
В) Si + NaOH + H2O → Na2SiO3 + H2
| 3) Э0 → Э+4
|
| | 4) Э+1→ Э0
|
| | 5) Э0 → Э+2
|
Ответ:
4. Установите соответствие между схемой превращения и изменением степени окисления окислителя в ней:
| Схема превращений
| Изменение степени окисления окислителя
|
| А) C+ H2SO4 → CO2 + SO2 + H2O
| 1) Э+5 → Э+4
|
| tº
Б) SiO2 + Al → Si + Al2O3
| 2) Э0 → Э+4
|
| В) С +HNO3 → CO2 + NO2 + H2O
| 3) Э+6 → Э+4
|
| | 4) Э+4 → Э0
|
| | 5) Э0 → Э+3
|
Ответ:
5. Установите соответствие между веществом и реагентами, с которыми оно может вступать в реакцию:
| Вещество
| Реагенты
|
| А) силикат натрия
| 1) NaOH, Ca
|
| Б) оксид углерода(II)
| 2) HNO3, BaCl2
|
| В) кремний
| 3) ZnO, O2
|
| Ответ:
| 4) HCl, CaCO3
|
Ответы:
Часть 1
Часть 2
|
|
|
|
|
|
| 2,5
| 1,4
| А-5,
Б-1,
В-3
| А-3,
Б-4,
В-1
| А-2,
Б-3,
В-1
|
Ключи ответов
Ответы
1 – г;
2 – а;
3 – г;
4 – в;
5 – а;
6 – а, г;
7 – в, г;

9. А – NH3, B – NH4NO3, C – NO,
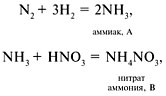
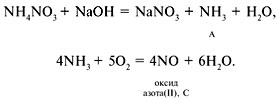
10.
А. Ag + 2HNO3(конц) = AgNO3 +N02 +H2O
Ag0 - 1e → Ag+1 1 восстановитель окисляется
N+5 + 1e → N+4 1 окислитель восстанавливается
Тематический тест по теме «Электролиз» (задание 22 ЕГЭ)
1. Установите соответствие между формулой соли и продуктами, образующимися при электролизе её водного раствора на графитовых электродах.
| Формула соли
| Продукты электролиза
|
| А) NiSO4
| 1) Ni, H2, O2
|
| Б) NaClO4
| 2) H2, Cl2
|
| В) LiCl
| 3) H2, O2
|
| Г) AgNO3
| 4) Ag, NO2
|
|
| 5) Ag, O2
|
2. Установите соответствие между формулой соли и продуктами, образующимися при электролизе её водного раствора на графитовых электродах.
| Формула соли
| Продукты электролиза
|
| А) Rb2SO4
| 1) H2, O2
|
| Б) CH3COOK
| 2) H2, C2H6, CO2
|
| В) SrBr2
| 3) Cu, O2
|
| Г) CuSO4
| 4) Cu, SO2
|
|
| 5) Sn, Br2
|
|
| 6) H2, Br2
|
3. Установите соответствие между металлом и способом его электролитического получения в промышленности.
| Металл
| Способ электролиза
|
| А) натрий
| 1) водного раствора солей
|
| Б) алюминий
| 2) водного раствора гидроксида
|
| В) серебро
| 3) расплава поваренной соли
|
| Г) медь
| 4) расплавленного оксида
|
|
| 5) раствора оксида в расплавленном криолите
|
4. Установите соответствие между формулой соли и продуктами, образующимися при электролизе её водного раствора на графитовых электродах.
| Формула соли
| Продукты электролиза
|
| А) Al2(SO4)3
| 1) водород, кислород
|
| Б) Ca(NO3)2
| 2) металл, галоген
|
| В) LiBr
| 3) оксид серы (IV), водород
|
| Г) KCl
| 4) галоген, водород
|
|
| 5) азот, металл
|
5. Установите соответствие между формулой соли и уравнением процесса, протекающего на графитовом аноде при электролизе её водного раствора.
| Формула соли
| Уравнение анодного процесса
|
| А) Fe(NO3)3
| 1) 2H2O - 4ē = O2 + 4H+
|
| Б) ZnF2
| 2) 2H2O + 2ē = H2 + 2OH-
|
| В) AlBr3
| 3) 2Br- - 2ē = Br20
|
| Г) Cu(NO3)2
| 4) 2F- - 2ē = F20
|
|
| 5) Br- +3H2O - 6ē = BO3- + 6H+
|
|
| 6) 2NO3- - 2ē = N2 + 3O2
|
6. Установите соответствие между формулой соли и продуктами, образующимися при электролизе её водного раствора на графитовых электродах.
| Формула соли
| Продукты электролиза
|
| А) CuSO4
| 1) водород, кислорода
|
| Б) AgNO3
| 2) водород, галоген
|
| В) Na2S
| 3) металл, кислород
|
| Г) KBr
| 4) металл, галоген
|
|
| 5) водород, сера
|
7. Установите соответствие между формулой соли и продуктами, образующимися при электролизе её водного раствора на графитовых электродах.
| Формула соли
| Продукты на электродах
|
| А) Cu(NO3)2
| 1) Cu, O2
|
| Б) Na2S
| 2) Cu, NO2
|
| В) AlCl3
| 3) H2, S
|
| Г) ZnSO4
| 4) H2, Cl2
|
|
| 5) Zn, H2, O2
|
|
| 6) Zn, H2, S
|
8. Установите соответствие между металлом и способом его электролитического получения в промышленности.
| Металл
| Способ электролиза
|
| А) никель
| 1) расплавленного нитрата
|
| Б) золото
| 2) водного раствора гидроксида
|
| В) цинк
| 3) расплава хлорида
|
| Г) кальций
| 4) расплавленного оксида
|
|
| 5) водного раствора солей
|
|
| 6) раствора оксида в расплавленном криолите
|
9. Установите соответствие между формулой соли и уравнением процесса, протекающего на графитовом аноде при электролизе её водного раствора.
| Формула соли
| Уравнение анодного процесса
|
| А) Al(NO3)3
| 1) 2H2O - 4ē = O2 + 4H+
|
| Б) CuCl2
| 2) 2H2O + 2ē = H2 + 2OH-
|
| В) SbCl3
| 3) 2Cl- - 2ē = Cl20
|
| Г) Cu(NO3)2
| 4) Sb3+ + 3ē = Sb0
|
|
| 5) Cl- +4H2O - 8ē = ClO4- + 8H+
|
|
| 6) 4NO3- - 4ē = 2N2O + 5O2
|
10. Установите соответствие между формулой вещества и продуктами, которые образуются на инертных электродах в результате электролиза его водного раствора.
| Формула вещества
| Продукты электролиза
|
| А) NiSO4
| 1) Cl2, Ni, H2
|
| Б) NiCl2
| 2) O2, Ni, H2
|
| В) KOH
| 3) H2, O2
|
| Г) Na2S
| 4) S, H2
|
|
| 5) SO3, H2
|
|
| 6) H2S, Ni
|
Ответы
| № задания
| Ответы
| № задания
| Ответы
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тест по теме «Химические свойства металлов» 9 класс
Необходимо выбрать один верный ответ в заданиях 1-11, в задании 12 – установить соответствие
| 1. И литий, и цинк при комнатной температуре реагируют с
|
|
| 1)
| гидроксидом натрия
| |
| 2)
| водой
| |
| 3)
| серой
| |
| 4)
| соляной кислотой
| |
| 2. Кальций вступает в реакцию с каждым из двух веществ:
|
| | 1)
| магний и соляная кислота
| | | 2)
| вода и гидроксид калия
| | | 3)
| гидроксид натрия и соляная кислота
| | | 4)
| соляная кислота и хлор
| |
| 3. Осадок гидроксида магния растворится при взаимодействии с раствором
|
| | 1)
| хлорида кальция
| | | 2)
| соляной кислоты
| | | 3)
| фосфата натрия
| | | 4)
| гидроксида калия
| |
| 4. И магний, и натрий при комнатной температуре энергично реагируют с
|
| | 1)
| водой
| | | 2)
| соляной кислотой
| | | 3)
| гидроксидом бария
| | | 4)
| карбонатом кальция
| |
| 5. И с цинком, и с медью реагирует
|
| | 1)
| хлор
| | | 2)
| оксид углерода(II)
| | | 3)
| гидроксид натрия
| | | 4)
| соляная кислота
| 6. Алюминий не реагирует с раствором
| | | 1)
| серной кислоты
| | | 2)
| сульфата магния
| | | 3)
| гидроксида натрия
| | | 4)
| нитрата меди(II)
| |
| |
| 7. Для растворения гидроксида железа(II) можно использовать раствор
|
| | 1)
| гидроксида натрия
| | | 2)
| серной кислоты
| | | 3)
| нитрата натрия
| | | 4)
| хлорида бария
| |
| 8. Какое(-ие) из перечисленных веществ: Cu, CuO, Cu(OH)2, CuCl2, реагирует(-ют) с раствором соляной кислоты?
| |
| 1)
| только CuO
| |
| 2)
| только Cu(OH)2
| |
| 3)
| CuO и Cu(OH)2
| |
| 4)
| Сu, Cu(OН)2 и CuCl2
| |
|
|
|
| 9. И железо, и цинк при комнатной температуре реагируют с
|
|
| 1)
| гидроксидом магния
| |
| 2)
| оксидом углерода(II)
| |
| 3)
| cульфатом меди(II)
| |
| 4)
| водой
| |
| 10. Железо вступает в реакцию с каждым из двух веществ:
|
|
| 1)
| Na2S и Hg(NO3)2
| |
| 2)
| Al(OH)3 и S
| |
| 3)
| MgCl2 и H2O
| |
| 4)
| CuSO4 и O2
| |
11. С каждым из перечисленных веществ – Fe, NaOH, Na2S –
| реагирует
|
|
| 1)
| Ca(NO3)2
|
| 2)
| KCl
|
| 3)
| Cu(NO3)2
|
| 4)
| MgSiO3
| |
| 12. Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
|
|
| | НАЗВАНИЕ ВЕЩЕСТВА
|
| РЕАГЕНТЫ
| | А)
| гидроксид бария
| | Б)
| оксид алюминия
| | В)
| хлорид меди(II)
| |
| | 1)
| KOH, AgNO3(р-р)
| | 2)
| Na2SO4, H2S
| | 3)
| MgO, Cl2
| | 4)
| HCl(р-р), NaOH(р-р)
| | |
Ответы:
Тест по теме «Кислород»
Необходимо выбрать один верный ответ
1. Кислород открыли и впервые получили два великих химика:
а) А. Лавуазье;
б) Дж. Пристли;
в) Г. Кавендиш;
г) Г. Дэви.
Укажите свойства кислорода.
а) легче воздуха;
б) имеет температуру кипения +5500С
в) в жидком состоянии – светло-голубого цвета;
г) 98% объема воздуха – кислород
3. Кислород является родоначальником группы:
а) 7, галогенов
б) 6, халькогенов
в) 1, неметаллов
г) 6, галогенов
4. При взаимодействии кислорода с натрием образуется:
а) пероксид
б) солеобразующий оксид
в) амфотерный оксид
г) щелочь
5. Сумма коэффициентов в уравнении разложения перманганата калия (получение кислорода в лаборатории):
а) 7
б) 9
в) 4
г) 5