Для того, чтобы произошла химическая реакция, молекулы взаимодействующих веществ должны столкнуться. Однако не всякое столкновение молекул является эффективным, т. е. таким, чтобы произошло ослабление или разрыв связей между атомами во взаимодействующих молекулах и перегруппировка этих атомов в новые молекулы. Это происходит только в том случае, если энергия взаимодействующих молекул превышает некоторую пороговую энергию. Эта энергия получила название энергии активации: молекулы, обладающие энергией активации, называются активными молекулами. Только взаимодействие активных молекул приводит к протеканию химической реакции и образованию молекул нового вещества.
Любая химическая реакция начинается с разрыва или ослабления связей между атомами в молекулах исходных веществ, при этом реагирующие между собой вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние называется активированным комплексом. Именно для его образования и необходима энергия активации. Активированный комплекс существует очень короткое время и распадается с образованием продуктов реакции, энергия при этом выделяется.
В простейшем случае активированный комплекс представляет собой конфигурацию атомов, в которой ослаблены старые связи и образованы слабые новые связи.
Активированный комплекс возникает как промежуточное состояние, как для прямой, так и для обратной реакций. Энергетически он отличается от исходных веществ на величину энергии активации прямой реакции, от конечных веществ − на величину энергии активации обратной реакции.
Закон действующих масс
Скорость химической реакции зависит, прежде всего, от природы реагирующих веществ, а также от условий протекания реакции: концентрации, температуры, давления (для газовых реакций), от облучения и наличия катализаторов.
Молекулярностьреакции определяется числом молекул, одновременным взаимодействиемкоторых осуществляется элементарный акт химического превращения.
Различают моно-, би- и тримолекулярные реакции.
Рассмотрим реакцию, протекающей по уравнению
aA + bB → продукты реакции. (32)
Чтобы осуществилось данное взаимодействие, молекулы веществ А и В должны столкнуться, при этом их суммарная энергия должна превышать среднюю энергию всех молекул на величину энергии активации. Доля таких молекул будет пропорциональна вероятности их столкновения. Но эта вероятность, как вероятность сложного события, пропорциональна произведению вероятностей двух событий А и В, то есть что молекулы А и В одновременно окажутся в данной точке реакционного пространства Р(АВ) = Р(А)Р(В)1.
С другой стороны, вероятности Р(А) и Р(В) пропорциональны числу молекул А и В, то есть пропорциональны их концентрации. Следовательно, вероятность одновременного присутствия молекул А и В в одной и той же точке будет пропорциональна произведению их концентраций.
Таким образом, скорость химической реакции пропорциональна произведению концентраций реагирующих веществ − закон действующих масс ( основной закон химической кинетики ).
Для реакции типа (32) этот закон примет следующий вид:
 (33)
(33)
где сА и сВ − концентрации реагирующих веществ А и В соответственно;
а и b − стехиометрические коэффициенты веществ А и В;
k − константа скорости реакции, численно равная скорости химической реакции, когда концентрации реагирующих веществ равны одному молю на литр. Константа скорости не зависит от концентрации реагирующих веществ, но зависит от температуры.
Уравнение (33) называется кинетическим уравнением реакции. Показатели а и b называются порядками реакции по веществам А и В соответственно. Их сумма (а + b) называется общим или суммарным порядком реакции.
Правило Вант-Гоффа1
При увеличении температуры на каждые 10 градусов скорость большинства реакции возрастает в 2−4 раза:
 (34)
(34)
где  − скорости реакции при температурах Т1 и Т2, соответственно;
− скорости реакции при температурах Т1 и Т2, соответственно;
γ − температурный коэффициент скорости реакции, который показывает во сколько раз возрастает скорость реакции с увеличением температуры на 10 градусов.
С ростом температуры число активных молекул возрастает, и следовательно, увеличивается скорость реакции.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Когда при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакцию считают необратимой, протекающей до конца.
К необратимым принято относить взаимодействия между веществами, в результате которых образуются осадки, газы и малодиссоциирующие вещества.
Множество химических реакций протекает обратимо. Их особенность состоит в том, что они не идут до конца, в системе всегда остается каждое из исходных веществ.
Реакцию, протекающую вправо, называют прямой, а влево − обратной. Если в системе скорость прямой реакции  равна скорости обратной реакции
равна скорости обратной реакции  , состояние системы называется химическим равновесием. Таким образом, кинетически условием химического равновесия является равенство:
, состояние системы называется химическим равновесием. Таким образом, кинетически условием химического равновесия является равенство:
 . (35)
. (35)
Если равенство (35) является кинетическим условием равновесия, то равенство: ∆Gр,T = 0 является термодинамическим условием химического равновесия.
Если ∆Gр,T = 0,то скорость прямой реакции  при данных р и Т равна скорости обратной реакции
при данных р и Т равна скорости обратной реакции  .
.
Неравенству ∆Gр,T < 0 отвечает неравенство  >
>  . При этом самопроизвольно идёт прямая реакция и в системе накапливаются продукты реакции. Наоборот, когда ∆ Gp,T > 0 скорость обратной реакции больше, чем прямой:
. При этом самопроизвольно идёт прямая реакция и в системе накапливаются продукты реакции. Наоборот, когда ∆ Gp,T > 0 скорость обратной реакции больше, чем прямой:  <
<  . Самопроизвольно при этом идёт обратный процесс, и концентрация продуктов реакции в системе понижается.
. Самопроизвольно при этом идёт обратный процесс, и концентрация продуктов реакции в системе понижается.
Химическое равновесие характеризуется постоянным и вполне определённым для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии.
Величина, равная отношению произведения равновесных концентраций продуктов реакций к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия химической реакции и обозначается Кс.
Для обратимой реакции, протекающей в гомогенной системе (где все вещества жидкости или газы),
aA + bB  mM + nN
mM + nN
константа равновесия имеет вид:
 . (36)
. (36)
Выражение (36) является записью закона действующих масс для обратимых реакций. Его можно вывести исходя из кинетических представлений:
 (37)
(37)
или
 .
.
С учётом уравнения (36) получим:
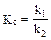
 Скорость реакции Скорость реакции
|
Время
При заданной температуре константа равновесия химической реакции равна отношению констант скоростей прямого и обратного процессов.
Константа равновесия так же, как и константы скоростей k1 и k2, зависит от природы реагентов и температуры, но не зависит от концентраций исходных веществ в системе.
Концентрации газообразных веществ в выражении (36) могут быть сменены равновесными парциальными давлениями этих веществ:
 (39)
(39)
Если обратимая реакция протекает в гетерогенной системе, то константа равновесия Кр равна отношению равновесных парциальных давлений газообразных веществ и не зависит от абсолютного и относительного количества веществ, находящихся в конденсированном (жидком или твёрдом) состоянии.
Принцип Ле Шателье [32]
Химическое равновесие, отвечающее равенству скоростей прямой и обратной реакций ( =
=  ) и минимальному значению энергии Гиббса (∆ G°T= 0), является наиболее устойчивым состоянием системы при заданных условиях и остаётся неизменным до тех пор, пока сохраняются постоянными параметры, при которых равновесие установилось. При изменении условий равновесие нарушается и смещается влево или вправо. Через некоторое время система вновь становится равновесной, то есть она переходит из одного состояния в другое. Новое равновесие характеризуется новым равенством скоростей прямой и обратной реакций и новыми равновесными концентрациями всех веществ в системе.
) и минимальному значению энергии Гиббса (∆ G°T= 0), является наиболее устойчивым состоянием системы при заданных условиях и остаётся неизменным до тех пор, пока сохраняются постоянными параметры, при которых равновесие установилось. При изменении условий равновесие нарушается и смещается влево или вправо. Через некоторое время система вновь становится равновесной, то есть она переходит из одного состояния в другое. Новое равновесие характеризуется новым равенством скоростей прямой и обратной реакций и новыми равновесными концентрациями всех веществ в системе.
Химическое равновесие является подвижным (динамическим). Оно смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорости прямой и обратной реакций, тем самым нарушая равенство скоростей. Если при изменении внешних условий химическое равновесие нарушается так, что скорость прямой реакции становится больше скорости обратной реакции ( >
>  ), то равновесие смещается вправо. Если же равновесие нарушается так, что скорость прямой реакции становится меньше, чем скорость обратной реакции (
), то равновесие смещается вправо. Если же равновесие нарушается так, что скорость прямой реакции становится меньше, чем скорость обратной реакции ( <
<  ), то равновесие смещается влево. Направление смещения равновесия в общем случае определяется принципом Ле Шателье1.
), то равновесие смещается влево. Направление смещения равновесия в общем случае определяется принципом Ле Шателье1.
Если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Смещение равновесия может быть вызвано изменением температуры, концентрации одного из реагентов, давления.
Температура − тот параметр, от которого зависит величина константы равновесия химической реакции. При повышении температуры уменьшается константа равновесия экзотермического процесса ( < 0 или
< 0 или  < 0), при понижении температуры − увеличивается. Это значит, что при повышении температуры равновесие экзотермического процесса смещается влево, поскольку прямая реакция идёт с выделением теплоты.
< 0), при понижении температуры − увеличивается. Это значит, что при повышении температуры равновесие экзотермического процесса смещается влево, поскольку прямая реакция идёт с выделением теплоты.
Скорость как экзотермической, так и эндотермической реакции при повышении температуры растёт, а при понижении уменьшается. Однако изменение скоростей  и
и  при повышении (или понижении) температуры не одинаково, поэтому варьируя температуру, можно смещать равновесие в заданном направлении.
при повышении (или понижении) температуры не одинаково, поэтому варьируя температуру, можно смещать равновесие в заданном направлении.
Смещение равновесия может быть вызвано изменением концентрации одного из компонентов: добавлением вещества в равновесную систему или выводом его из системы. По принципу Ле Шателье, при изменении концентрации одного из участников реакции равновесие смещается в сторону, компенсирующую изменение, то есть при повышении концентрации одного из исходных веществ − вправо, а при повышении концентрации одного из продуктов реакции − влево.
Действительно, при увеличении концентрации исходного вещества А (или В) в равновесной системе А + В  M + N равенство скоростей
M + N равенство скоростей  =
=  нарушается, так как возрастает скорость прямой реакции
нарушается, так как возрастает скорость прямой реакции  =
=  cAcВ; равновесие смещается вправо (
cAcВ; равновесие смещается вправо (  >
>  ). Если же увеличить концентрацию продукта реакции M (или N), то возрасёт скорость обратной реакции
). Если же увеличить концентрацию продукта реакции M (или N), то возрасёт скорость обратной реакции  =
=  cM cN, равновесие смещается влево
cM cN, равновесие смещается влево
 <
<  .
.
Если в обратимой реакции участвует хотя бы одно газообразное вещество, смещение равновесия может быть вызвано изменением давления. Повышение давления при Т = const равносильно сжатию газа, то есть увеличению его концентрации. При увеличении концентрации газообразного компонента скорость реакции в соответствии с законом действующих масс растёт, что приводит к смещению равновесия в направлении уменьшения концентрации газообразного компонента. При понижении давления при Т = const газ расширяется, и его концентрация в системе падает. Это вызывает понижение скорости реакции; равновесие смещается в направлении увеличения давления газа.
Если в реакции участвуют несколько газообразных веществ, то при изменении давления одновременно и одинаково изменяются все их концентрации. Однако смещение равновесия может при этом не произойти.
Итак, в соответствии с принципом Ле Шателье при повышении давления равновесие смещается в сторону образования меньшего количества молей газообразных веществ в газообразной смеси и, соответственно, в сторону уменьшения давления в системе. Наоборот, при внешнем воздействии, вызывающем понижение давления, равновесие смещается в сторону образования большего количества молей газа, что и противодействует внешнему воздействию и вызывает увеличение давления в системе.
На основе принципа Ле Шателье можно подобрать такие условия осуществления химического равновесия, которые обеспечивают наибольший выход продуктов реакции. Принцип Ле Шателье справедлив не только для химических равновесий; он приложим и к процессам фазовых превращений: к испарению, конденсации и др.
ФАЗОВОЕ РАВНОВЕСИЕ
Гетерогенные равновесия, связанные с переходом веществ из одной фазы в другую без изменения химического состава, называются фазовыми. К их числу можно отнести равновесия в процессах испарения, плавления, конденсации и т. п. Фазовые равновесия, так же, как и химические, характеризуются минимальным значением энергии Гиббса системы и равенством скоростей прямого и обратного процессов.
Для фазовых равновесий справедлив принцип Ле Шателье. В системе лёд − вода равновесие можно сместить вправо (в сторону плавления льда), повышая температуру, так как переход Н2О (к) → Н2О (ж) сопровождается поглощением энергии (∆Н > 0).
При анализе гетерогенных равновесий необходима оценка возможного числа равновесно сосуществующих фаз и числа параметров системы, которые можно произвольно изменять, не нарушая равновесия в ней.
Число параметров состояний, способных произвольно меняться без нарушения фазового равновесия, называется числом степеней свободы или вариантностью системы.
Гиббс (1876 г.) вывел закон, определяющий вариантность гетерогенной системы.
Пусть система состоит из k компонентов и содержит r фаз. Состояние системы полностью определено, если известны Т, р и состав каждой фазы (концентрации всех компонентов). Для k -компонентной
r -фазной системы вариантность или число её степеней свободы f равно:
f = k – r + 2. (40)
Эта закономерность является основным законом фазового равновесия. Из него следует, что число степеней свободы увеличивается с увеличением числа компонентов и уменьшается при увеличении числа фаз.
Значения f < 0 не имеют физического смысла, следовательно,
r < k + 2, то есть число фаз, сосуществующих в равновесии, не может превосходить числа независимых компонентов более чем на 2.
Формула (40) является математическим выражением правила фаз.
Цифра «2» в уравнениях Гиббса появилась вследствие принятого допущения о том, что на состояние системы оказывают влияние только два параметра Т и р. Для многих конденсированных систем давление меняется слабо, а, значит, не оказывает влияния на процессы и превращения в системе. В этом случае правило фаз записывается следующим образом:
f = k – r + 1. (41)
Диаграммой фазового равновесия или диаграммой состояния, или фазовой диаграммой называется геометрическое изображение равновесных состояний термодинамической системы при различных значениях параметров состояний.
Каждая точка на диаграмме состояния, именуемая фигуративной точкой, определяет численные значения параметров, характеризующих данное состояние системы.
С помощью диаграмм состояний можно оценить, сколько фаз и какие конкретно фазы образуют систему при данных значениях параметров состояния.
Можно представить существование трёх двухфазных и одного трёхфазного равновесия для однокомпонентной системы:
S  V; L
V; L  V; S
V; S  L; S
L; S  L
L  V. (42)
V. (42)
Равновесия (42) можно представить в виде диаграммы состояния, которая представляет собой геометрический образ, выраженный линиями, отделяющими одну фазовую область от другой и называемыми линиями фазовых равновесии.

Кривые аа1, аа2 и аа3 делят диаграмму состояния на три поля: S, L, V. Все фигуративные точки, принадлежащие одному полю, отвечают однофазному состоянию и имеют, согласно правилу фаз, две степени свободы: f = 1−1 + 2 = 2. Это означает, что в пределах данного фазового поля одновременное изменение двух параметров состояния не вызывает нарушения фазового равновесия.
Линия аа3 соответствует двухфазному равновесию между жидкостью и паром, характеризующееся одной степенью свободы. Это означает, что можно произвольно изменять только один из параметров состояния − р или Т. Из диаграммы также следует, что линия аа3 характеризует зависимость давления насыщенного пара данного вещества от температуры и её можно трактовать как зависимость температуры кипения вещества от внешнего давления. В этой связи кривая аа3 получила название кривой кипения или кривой испарения.
Линия аа2 соответствует двухфазному равновесию между жидкостью и кристаллом. Её называют кривой плавления, так как она изображает зависимость температуры плавления от внешнего давления.
Линия aa1 характеризует равновесие кристалл − пар и называется кривой возгонки или сублимации. Она показывает влияние внешнего давления на температуру возгонки вещества. Вместе с тем она характеризует температурную зависимость давления насыщенного пара над твёрдым веществом.
Линии равновесии аа3, аа1 и аа2 сходятся в тройной точке а, где сосуществуют все три фазы (S, L, V). Согласно правилу фаз для трёхфазного равновесия в однокомпонентной системе число степеней свободы равно 0. Это означает, что три фазы могут находиться в равновесии друг с другом сколь угодно долго, но при строго определённых значениях параметров состояния.
КАТАЛИЗ
Вещества, увеличивающие скорость химической реакции, называются катализаторами. Явление возрастания скорости химической реакции под действием таких веществ, называется катализом (от греч. katalysis − разрушение). Реакции, протекающие под действием катализаторов, называются каталитическими.

В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции. В присутствии катализатора для образования активированного комплекса требуется меньше энергии, чем без него. Таким образом, энергия активации реакции уменьшается; молекулы, энергия которых была недостаточна для активных столкновений, теперь становятся активными, что приводит к увеличению концентрации активных молекул.
Катализатор понижает энергию активации прямой и обратной реакции на одну и ту же величину. Следовательно, катализатор в одно и то же число раз ускоряет прямую и обратную реакции.
Различают гомогенный и гетерогенный катализ. В случае гомогенного катализа катализатор и реагирующие вещества образуют одну фазу (газ или раствор). В случае гетерогенного катализа катализатор образует в системе отдельную фазу.
При гетерогенном катализе реакция протекает на поверхности катализатора, где имеются активные центры, на которых, главным образом, и протекают каталитические реакции. Реагирующие вещества адсорбируются на этих центрах, в результате чего увеличивается концентрация реагентов на поверхности катализатора. Это отчасти приводит к ускорению реакции. Но главной причиной роста скорости химической реакции является значительное увеличение химической активности адсорбированных молекул: под действием катализатора у них ослабляются связи между атомами в молекулах, и последние становятся более реакционноспособными. И в случае гетерогенного катализа реакция ускоряется благодаря уменьшению энергии активации (в том числе за счёт образования поверхностных промежуточных соединений).
Катализаторы, уменьшающие скорость химической реакции, называются ингибиторами, а катализ в этом случае называется ингибированием.
ОБЩИЕ СВОЙСТВА РАСТВОРОВ.
РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ
ДИСПЕРСНЫЕ СИСТЕМЫ
Если в каком-либо веществе (среде) распределено в виде очень мелких частиц другое вещество, то такая система называется дисперсной. В зависимости от агрегатного состояния распределяемого вещества и среды возможны следующие 9 типов дисперсных систем (Г – газообразное состояние, Ж – жидкое, Т – твёрдое; первая буква относится к распределяемому веществу, вторая – к среде):
1) Г + Г; 4) Г + Ж 7) Г + Т
2) Ж + Г; 5) Ж + Ж 8) Ж + Т
3) Т + Г; 6) Т + Ж 9) Т + Т
Наибольшее значение для химии имеют дисперсные системы, в которых средой является жидкость.



 (33)
(33) (34)
(34) − скорости реакции при температурах Т1 и Т2, соответственно;
− скорости реакции при температурах Т1 и Т2, соответственно; равна скорости обратной реакции
равна скорости обратной реакции  , состояние системы называется химическим равновесием. Таким образом, кинетически условием химического равновесия является равенство:
, состояние системы называется химическим равновесием. Таким образом, кинетически условием химического равновесия является равенство: . (35)
. (35) при данных р и Т равна скорости обратной реакции
при данных р и Т равна скорости обратной реакции  .
. mM + nN
mM + nN . (36)
. (36) (37)
(37) .
.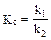
 Скорость реакции
Скорость реакции
 (39)
(39) < 0 или
< 0 или  < 0), при понижении температуры − увеличивается. Это значит, что при повышении температуры равновесие экзотермического процесса смещается влево, поскольку прямая реакция идёт с выделением теплоты.
< 0), при понижении температуры − увеличивается. Это значит, что при повышении температуры равновесие экзотермического процесса смещается влево, поскольку прямая реакция идёт с выделением теплоты. cAcВ; равновесие смещается вправо (
cAcВ; равновесие смещается вправо (  cM cN, равновесие смещается влево
cM cN, равновесие смещается влево



