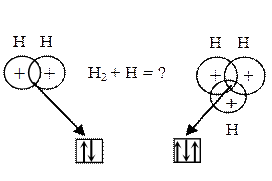Насыщаемость. Если два атома водорода образовали ковалентную связь посредством объединения своих неспаренных электронов, то присоединение третьего атома водорода уже невозможно. В случае соединения трёх атомов водорода в области связывания окажутся три электрона, а так как область связывания (перекрывания) принадлежит каждой из трёх орбиталей атомов водорода, то окажется, что на каждой орбитали будет находиться три электрона, что противоречит принципу Паули (никакие два электрона в одном атоме не могут иметь четыре одинаковых квантовых числа, т. е. не могут находиться в одинаковом квантовом состоянии).
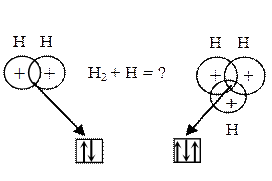
В области связывания трёх электроотрицательных атомов водорода может находиться только два электрона с противоположными спинами. Если удалить один электрон, то образуется реально существующий ион Н3+, в котором в области перекрывания будет два электрона с противоположными спинами.
Принцип Паули запрещает использование одной и той же АО дважды в образовании химических связей. Если же у атома имеется несколько орбиталей с неспаренными электронами, то возможно образование таких молекул, как О3, S8, Р4 и др.
Например, образование тетраэдрической молекулы Р4 происходит за счёт перекрывания трёх р -орбиталей каждого из четырёх атомов фосфора по обменному механизму с р -орбиталями трёх других атомов фосфора, каждая из которых содержит по одному неспаренному электрону:


Таким образом, взаимодействие двух атомов, приводящее к образованию ковалентных связей, своей насыщаемостью отличается от взаимодействия электрических зарядов и больших масс (силы тяготения), которые не являются насыщаемыми. Если положительный заряд притягивается к одному отрицательному заряду, то это не мешает ему притягиваться и к другим отрицательным зарядам. Вследствие насыщаемости ковалентной связи молекулы имеют определённый химический состав.
Направленность обусловленаперекрыванием атомных орбиталей вдоль прямой линии, проведённой через ядра взаимодействующих атомов.
Направленные ковалентные связи называются одинарными или сигма-связями (σ-связь). Между двумя атомами в молекуле возможна только одна σ-связь. Все σ-связи обладают осевой симметрией относительно межъядерной оси, и фрагменты молекулы могут вращаться вокруг этой оси без нарушения степени перекрывания орбиталей, т. е. без деформации σ-связи. Так как σ-связи строго ориентированы в пространстве, то в зависимости от состава молекулы они могут находиться под определённым углом друг к другу (валентный угол). Например, в молекуле Н2S две σ-связи S–Н, образованные по обменному механизму перекрыванием s -орбиталей атомов водорода и р -орбиталейатома серы, находятся под углом 92°. Совокупность направленных, строго ориентированных в пространстве σ-связей создаёт пространствен-ную структуру молекулы.
σ-связь может быть образована перекрыванием двух s -орбиталей (σ s-s -связь), двух р -орбиталей ( σ р-р -связь), одной s - и одной р -орбиталями(σ s-p -связь); возможно также образование σ s-d -, σ p-d – и σ d-d связей.
Целочисленность. Если два атома имеют по нескольку неспаренных электронов и ковалентная связь между ними осуществляется более чем одной парой электронов, то между этими атомами образуются кратные (двойные, тройные) связи. Кратные связи могут образовывать атомы С, N, О. Например, в молекуле N2 атомы азота с электронной конфигурацией 2s22р3 образуют одну σ-связь и две π-связи. Образование π-связей происходит при перекрывании атомных орбиталей, расположенных перпендикулярно или под иными углами к σ-связи и параллельно друг к другу.
С появлением π-связи, не имеющей осевой симметрии, свободное вращение фрагментов молекулы вокруг σ-связи прекращается. Любой поворот одного из связанных π-связью атомов вокруг межъядерной оси (вокруг σ-связи) приведёт к разрыву π-связи.
Если электроны, образующие π-связь, имеют равную нулю вероятность нахождения в плоскости молекулы, то такую плоскость называют узловой.
Перекрывание орбиталей в случае π-связей меньше, чем в случае σ-связей. Поэтому π-связи, как правило, слабее σ-связей. Электроны π-связи легче вырываются из молекулы и, следовательно, придают ей бόльшую реакционную способность.
Примеры соединений с двойными и тройными связями: диоксид углерода СО2 (О=С=О), монооксид углерода СО (:С≡О:), азот N2 (:N≡N:) и др.
Кратность связи (или порядок связи ω) определяется числом пар электронов между атомами, участвующими в её образовании. В молекулах этана H3C:CH3, этена H2C::СH2 и этина НС::СН значение ω соответственно равно 1, 2, 3. Увеличение кратности связи приводит к усилению ковалентной связи и уменьшению её длины.