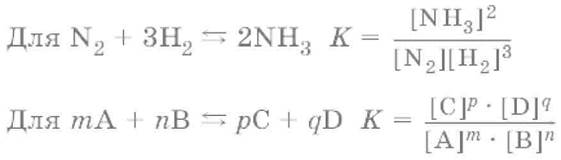Термохимия
Энергия (Е) – способность производить работу. Механическая работа (А) совершается, например, газом при его расширении: А = р • ΔV.
Реакции, которые идут с поглощением энергии, – эндотермические.
Реакции, которые идут с выделением энергии, – экзотермические.
Виды энергии: теплота, свет, электрическая, химическая, ядерная энергия и др.
Типы энергии: кинетическая и потенциальная.
Кинетическая энергия – энергия движущегося тела, это работа, которую может совершить тело до достижения им покоя.
Теплота (Q) – вид кинетической энергии – связана с движением атомов и молекул. При сообщении телу массой (m) и удельной теплоемкостью (с) теплоты ΔQ его температура повышается на величину Δ t: ΔQ = m • с • Δt, откуда Δ t = ΔQ/(c • т).
Потенциальная энергия – энергия, приобретенная телом в результате изменения им или его составными частями положения в пространстве. Энергия химических связей – вид потенциальной энергии.
Первый закон термодинамики: энергия может переходить из одного вида в другой, но не может исчезать или возникать.
Внутренняя энергия (U) – сумма кинетической и потенциальной энергий частиц, составляющих тело. Поглощаемая в реакции теплота равна разности внутренней энергии продуктов реакции и реагентов (Q = ΔU = U2 – U1), при условии, что система не совершила работы над окружающей средой. Если реакция идет при постоянном давлении, то выделяющиеся газы совершают работу против сил внешнего давления, и поглощаемая в ходе реакции теплота равна сумме изменений внутренней энергии ΔU и работы А = р • ΔV. Эту поглощаемую при постоянном давлении теплоту называют изменением энтальпии: Δ Н = ΔU + р • ΔV, определяя энтальпию как Н = U + pV. Реакции жидких и твердых веществ протекают без существенного изменения объема (ΔV = 0), так что для этих реакций Δ Н близка к ΔU (ΔН = ΔU). Для реакций с изменением объема имеем ΔН > ΔU, если идет расширение, и ΔН < ΔU, если идет сжатие.
Изменение энтальпии обычно относят для стандартного состояния вещества: т. е. для чистого вещества в определенном (твердом, жидком или газообразном) состоянии, при давлении 1 атм = 101 325 Па, температуре 298 К и концентрации веществ 1 моль/л.
Стандартная энтальпия образования ΔНобр – теплота, выделяемая или поглощаемая при образовании 1 моль вещества из простых веществ, его составляющих, при стандартных условиях. Так, например, ΔНобр (NaCl) = ‑411 кДж/моль. Это означает, что в реакции Na(тв) + ½Cl2(г) = NaCl(тв) при образовании 1 моль NaCl выделяется 411 кДж энергии.
Стандартная энтальпия реакции ΔН – изменение энтальпии в ходе химической реакции, определяется по формуле: ΔН = ΔНобр (продуктов) – ΔНобр (реагентов).
Так для реакции NH3(г) + HCl(г) = NH4Cl(тв), зная ΔHo6p(NH3)=‑46 кДж/моль, ΔHo6p(HCl) = ‑92 кДж/моль и ΔHo6p(NH4Cl) = ‑315 кДж/моль имеем:
ΔH = ΔHo6p(NH4Cl) – ΔHo6p(NH3) – ΔHo6p(HCl) = ‑315 – (‑46) – (‑92) = ‑177 кДж.
Если Δ Н < 0, то реакция экзотермическая. Если Δ Н > 0, то реакция эндотермическая.
Закон Гесса: стандартная энтальпия реакции зависит от стандартных энтальпий реагентов и продуктов и не зависит от пути протекания реакции.
Самопроизвольно идущие процессы могут быть не только экзотермическими, т. е. процессами с уменьшением энергии ( Δ Н < 0), но могут быть и эндотермическими процессами, т. е. процессами с увеличением энергии ( Δ Н > 0). Во всех этих процессах «беспорядок» системы увеличивается.
Энтропия S – физическая величина, характеризующая степень беспорядка системы. S – стандартная энтропия, ΔS – изменение стандартной энтропии. Если ΔS > 0, беспорядок растет, если AS < 0, то беспорядок системы уменьшается. Для процессов в которых растет число частиц, ΔS > 0. Для процессов, в которых число частиц уменьшается, ΔS < 0. Например, энтропия меняется в ходе реакций:
СаО(тв) + Н2O(ж) = Са(OH)2(тв), ΔS < 0;
CaCO3(тв) = СаО(тв) + CO2(г), ΔS > 0.
Самопроизвольно идут процессы с выделением энергии, т. е. для которых Δ Н < 0, и с увеличением энтропии, т. е. для которых ΔS > 0. Учет обоих факторов приводит к выражению для энергии Гиббса: G = Н – TS или Δ G = ΔН – Т • ΔS. Реакции, в которых энергия Гиббса уменьшается, т. е. ΔG < 0, могут идти самопроизвольно. Реакции, в ходе которых энергия Гиббса увеличивается, т. е. ΔG > 0, самопроизвольно не идут. Условие ΔG = 0 значит, что между продуктами и реагентами установилось равновесие.
При низкой температуре, когда величина Т близка к нулю, идут лишь экзотермические реакции, так как TΔS – мало и ΔG = Δ Н < 0. При высоких температурах значения TΔS велико, и, пренебрегая величиной Δ Н, имеем ΔG = – TΔS, т. е. самопроизвольно будут идти процессы с увеличением энтропии, для которых ΔS > 0, a ΔG < 0. При этом чем больше по абсолютной величине значение ΔG, тем более полно проходит данный процесс.
Величина AG для той или иной реакции может быть определена по формуле:
ΔG = ΔСобр(продуктов) – ΔGoбp(реагентов).
При этом величины ΔGoбр, а также Δ Нобр и ΔSoбр для большого числа веществ приведены в специальных таблицах.
Химическая кинетика
Скорость химической реакции (v) определяется изменением молярной концентрации реагирующих веществ в единицу времени:

где v – скорость реакции, с – молярная концентрация реагента, t – время.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции (температуры, концентрации, присутствия катализатора и т. д.)
Влияние концентрации. В случае простых реакций скорость реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
Для реакции

где 1 и 2 соответственно направление прямой и обратной реакции:
v1 = k1× [А]m × [В]nи
v2 = k2 × [C]p × [D]q
где v – скорость реакции, k – константа скорости, [А] – молярная концентрация вещества А.
Молекулярность реакции – число молекул, участвующих в элементарном акте реакции. Для простых реакций, например: mA + nB → рС + qD, молекулярность равна сумме коэффициентов (m + n). Реакции могут быть одномолекулярными, двумолекулярными и редко трехмолекулярными. Реакции более высокой молекулярности не встречаются.
Порядок реакции равен сумме показателей степеней концентрации в экспериментальном выражении скорости химической реакции. Так, для сложной реакции
mA + nB → рС + qD экспериментальное выражение скорости реакции имеет вид
v1 = k1× [А]α× [В]βи порядок реакции равен (α + β). При этом α и β находятся экспериментально и могут не совпадать с m и n соответственно, поскольку уравнение сложной реакции представляет собой итог нескольких простых реакций.
Влияние температуры. Скорость реакции зависит от числа эффективных столкновений молекул. Увеличение температуры увеличивает число активных молекул, сообщая им необходимую для протекания реакции энергию активации Еакт и увеличивает скорость химической реакции.
Правило Вант‑Гоффа. При увеличении температуры на 10° скорость реакции увеличивается в 2–4 раза. Математически это записывается в виде:
v2 = v1× γ (t2 – t1)/10
где v1 и v2 – скорости реакции при начальной (t1) и конечной (t2) температурах, γ – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции при увеличении температуры на 10°.
Более точно зависимость скорости реакции от температуры выражается уравнением Аррениуса:
k = A × e – E/(RT),
где k – константа скорости, А – постоянная, не зависящая от температуры, е = 2,71828, Е – энергия активации, R = 8,314 Дж/(К × моль) – газовая постоянная; Т – температура (К). Видно, что константа скорости увеличивается с увеличением температуры и уменьшением энергии активации.
Химическое равновесие
Система находится в равновесии, если ее состояние не изменяется во времени. Равенство скоростей прямой и обратной реакции – условие сохранения равновесия системы.
Примером обратимой реакции является реакция
N2 + 3H2 ↔ 2NH3.
Закон действия масс: отношение произведения концентраций продуктов реакции к произведению концентраций исходных веществ (все концентрации указывают в степенях, равных их стехиометрическим коэффициентам) есть постоянная, называемая константой равновесия.
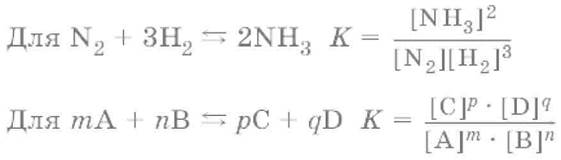
Константа равновесия – это мера протекания прямой реакции.
К = О – прямая реакция не идет;
К = ∞ – прямая реакция идет до конца;
К > 1 – равновесие сдвинуто вправо;
К < 1 – равновесие сдвинуто влево.
Константа равновесия реакции К связана с величиной изменения стандартной энергии Гиббса ΔG для этой же реакции:
ΔG = – RT ln K, или ΔG = ‑2,3RT lg K, или К= 10‑0,435ΔG/RT
Если К > 1, то lg K > 0 и ΔG < 0, т. е. если равновесие сдвинуто вправо, то реакция – переход от исходного состояния к равновесному – идет самопроизвольно.
Если К < 1, то lg K < 0 и ΔG > 0, т. е. если равновесие сдвинуто влево, то реакция самопроизвольно вправо не идет.
Закон смещения равновесия: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, в системе возникает процесс, который противодействует внешнему воздействию.
5. Окислительно‑восстановительные реакции
Окислительно‑восстановите льные реакции – реакции, которые идут с изменением степеней окисления элементов.
Окисление – процесс отдачи электронов.
Восстановление – процесс присоединения электронов.
Окислитель – атом, молекула или ион, который принимает электроны.
Восстановитель – атом, молекула или ион, который отдает электроны.
Окислители, принимая электроны, переходят в восстановленную форму:
F2 [ок. ] + 2ē → 2F¯ [восст.].
Восстановители, отдавая электроны, переходят в окисленную форму:
Na0[восст. ] – 1ē → Na+[ок.].
Равновесие между окисленной и восстановленной формами характеризуется с помощью уравнения Нернста для окислительно‑восстановительного потенциала:

где Е0 – стандартное значение окислительно‑восстановительного потенциала; n – число переданных электронов; [восст. ] и [ок. ] – молярные концентрации соединения в восстановленной и окисленной формах соответственно.
Величины стандартных электродных потенциалов Е0 приведены в таблицах и характеризуют окислительные и восстановительные свойства соединений: чем поло‑жительнее величина Е0, тем сильнее окислительные свойства, и чем отрицательнее значение Е0, тем сильнее восстановительные свойства.
Например, для F2 + 2ē ↔ 2F¯ Е0= 2,87 вольт, а для Na++ 1ē ↔ Na0 Е0= ‑2,71 вольт (процесс всегда записывается для реакций восстановления).
Окислительно‑восстановительная реакция представляет собой совокупность двух полуреакций, окисления и восстановления, и характеризуется электродвижущей силой (э.д.с.) Δ Е0: Δ Е0 = Δ Е0ок – Δ Е0восст, где Е0ок и Δ Е0восст – стандартные потенциалы окислителя и восстановителя для данной реакции.
Э.д.с. реакции Δ Е0 связана с изменением свободной энергии Гиббса ΔG и константой равновесия реакции К:
ΔG = – nF Δ Е0 или Δ Е = (RT/nF) ln K.
Э.д.с. реакции при нестандартных концентрациях Δ Е равна: Δ Е = Δ Е0– (RT/nF) × Ig K или Δ Е = Δ Е0– (0,059/ n)lg K.
В случае равновесия ΔG = 0 и ΔЕ = 0, откуда Δ Е = (0,059/n)lg K и К = 10nΔE/0,059.
Для самопроизвольного протекания реакции должны выполняться соотношения: ΔG < 0 или К >> 1, которым соответствует условие Δ Е0 > 0. Поэтому для определения возможности протекания данной окислительно‑восстановительной реакции необходимо вычислить значение Δ Е0. Если Δ Е0 > 0, реакция идет. Если Δ Е0< 0, реакция не идет.
Химические источники тока
Гальванические элементы – устройства, преобразующие энергию химической реакции в электрическую энергию.
Гальванический элемент Даниэля состоит из цинкового и медного электродов, погруженных в растворы ZnSO4 и CuSO4 соответственно. Растворы электролитов сообщаются через пористую перегородку. При этом на цинковом электроде идет окисление: Zn → Zn2++ 2ē, а на медном электроде – восстановление: Cu2++ 2ē → Cu. В целом идет реакция: Zn + CuSO4 = ZnSO4 + Cu.
Анод – электрод, на котором идет окисление. Катод – электрод, на котором идет восстановление. В гальванических элементах анод заряжен отрицательно, а катод – положительно. На схемах элементов металл и раствор отделены вертикальной чертой, а два раствора – двойной вертикальной чертой.
Так, для реакции Zn + CuSO4 = ZnSO4 + Cu схемой гальванического элемента является запись: (‑)Zn | ZnSO4 || CuSO4 | Cu(+).
Электродвижущая сила (э.д.с.) реакции равна Δ Е0= Е0ок – Е0восст = Е0 (Cu2+/Cu) – Е0 (Zn2+/Zn) = 0,34 – (‑0,76) = 1,10 В. Из‑за потерь напряжение, создаваемое элементом, будет несколько меньше, чем Δ Е0. Если концентрации растворов отличаются от стандартных, равных 1 моль/л, то Е0ок и Е0восст вычисляются по уравнению Нернста, а затем вычисляется э.д.с. соответствующего гальванического элемента.
Сухой элемент состоит их цинкового корпуса, пасты NH4Cl с крахмалом или мукой, смеси MnO2 с графитом и графитового электрода. В ходе его работы идет реакция: Zn + 2NH4Cl + 2MnO2 = [Zn(NH3)2]Cl + 2MnOOH.
Схема элемента: (‑)Zn | NH4Cl | MnO2, C(+). Э.д.с. элемента – 1,5 В.
Аккумуляторы. Свинцовый аккумулятор представляет собой две свинцовые пластины, погруженные в 30%‑ный раствор серной кислоты и покрытые слоем нерастворимого PbSO4. При заряде аккумулятора на электродах идут процессы:
PbSO4(тв) + 2ē → Рb(тв) + SO42‑
PbSO4(тв) + 2H2O → РbO2(тв) + 4H++ SO42‑+ 2ē
При разряде аккумулятора на электродах идут процессы:
РЬ(тв) + SO42‑ → PbSO4(тв) + 2ē
РbO2(тв) + 4H++ SO42‑+ 2ē → PbSO4(тв) + 2Н2O
Суммарную реакцию можно записать в виде:

Для работы аккумулятор нуждается в регулярной зарядке и контроле концентрации серной кислоты, которая может несколько уменьшаться при работе аккумулятора.
Растворы
Концентрация растворов
Массовая доля вещества в растворе w равна отношению массы растворенного вещества к массе раствора: w = mв‑ва/mр‑ра или w = mв‑вa/(V × ρ), так как mр‑ра = Vp‑pa × ρ р‑ра.
Молярная концентрация с равна отношению числа молей растворенного вещества к объему раствора: с = n (моль)/ V (л) или с = m/(М × V( л )).
Молярная концентрация эквивалентов (нормальная или эквивалентная концентрация) сэ равна отношению числа эквивалентов растворенного вещества к объему раствора: сэ = n (моль экв.)/ V (л) или сэ = m/(Мэ × V(л)).