

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Теория сварочных процессов
1 Приведите определения терминов «сварка», «наплавка», «пайка», «склеивание» и изложите основные физико-химические процессы, протекающие при этом
Сварка – процесс получения неразъемного соединения на атомно-молекулярном уровне путем термодинамически необратимого превращения энергии и вещества.
Наплавка – сварка плавлением, в процессе которой на поверхность детали наносится слой металла необходимого состава.
Пайка – процесс соединения материалов с помощью вносимого между ними припоя с температурой плавления более низкой, чем у соединяемых материалов.
Склеивание – образование соединения без введения энергии благодаря силам адгезии (прилипания) между жидким клеем и молекулами твердого вещества.
Схема получения неразъемного соединения

Вид, интенсивность и характер преобразования вводимой энергии – вот главное, что определяет вид процесса сварки.
Введение энергии – необходимое условие сварки, поскольку требуется активация соединяемых поверхностей.
Введение вещества необходимо только при некоторых видах сварки плавлением и пайки, причем энергия в этих случаях может вводиться также с расплавленным металлом.
Характер движения (переноса) вещества в зоне образования неразъемного соединения сильно зависит от вида процесса.
При сварки плавлением, особенно при СПЭ, движение велико, при сварке давлением с нагревом оно незначительно (за счет диффузии), а при холодной сварке движение вещества практически отсутствует (есть только дислокации кристаллической решетки).
По виду введенной энергии процессы сварки делятся на: термические (Т), термомеханические (ТМ), механические (М).
|
|
По состоянию вещества процессы сварки делятся на: сварку плавлением (в жидкой фазе) и сварку давлением (в твердой фазе).
Перечислите виды химических связей и их участие в процессах сварки, пайки, склеивания
Соединение атомов в твердом или жидком теле происходит в результате действия двух видов сил:
1) электростатических;
2) обменных, связанных с волновой природой электронов.
Химическая связь, природа которой электромагнитна, возникает в результате взаимодействия электронной волны с электромагнитным полем ядра атома или иона. Расстояние действия химических сил – несколько ангстрем.
Металлическая связь
Особенности свойств металлов и сплавов обусловлены:
1) положительные ионы расположены в узлах кристаллической решетки;
2) все валентные электроны обобщены и имеют одинаковый для всех средний уровень энергии.

|
При определении сил энергетического взаимодействия допускают:
1) ионы приближаются к точечным зарядам;
2) влияние соседних ионов отсутствует;
3) энергия притяжения «-», отталкивания «+»;
4) энергия связи U1(r) – энергия, необходимая для разъединения кристалла на изолированные атомы.
Существуют две составляющие энергии связи:
1) энергия электростатического взаимодействия «+» ионов и «-» электронов электронного газа.
2) составляющая U2(r) – кинетическая энергия электронного газа, приходящаяся на один атом. Эта энергия уравновешивает энергию электростатического взаимодействия и тело остается твердым.
Результирующая энергия связи характеризуется «потенциальной ямой», определяющей размер кристаллической решетки d.

где U∑ - энергия, необходимая для расплавления твердого тела (заштрихованная область).
Металлическая связь (взаимодействие «+» ионов и электронов газа) придает металлам и сплавам следующие свойства:
а) высокую электропроводность и теплопроводность;
б) высокую пластичность (электронный газ допускает большее смещение).
Ковалентная связь
|
|
Этот вид связи получается при образовании одной или нескольких электронных пар. Каждый электрон пары принадлежит обоим соединенным атомам, образуя электронные оболочки вокруг двух ядер.

Вещества, образующие ковалентную связь имеют:
а) высокую прочность и температуру плавления;
б) низкую тепло- и электропроводность (нет свободных электронов);
в) низкий уровень упругих деформаций и низкую пластичность;
Ковалентную связь может образовать типичный металл с металлом, (если один не растворяется в кристаллической решетки другого) в результате образуется интерметаллид, обладающий рядом особых свойств.
Например: интерметаллид TiB2 не окисляется до 15000С и жаропрочен до 25000С, но имеет низкую пластичность.
Ковалентные связи образуются при соединении Ме с металлоидами, в частности с окислами, интерметаллид, карбидами, силицидами.
Исследования условий образования и существования ковалентных связей весьма важны, поскольку именно окислы, интерметаллиды, карбиды, силициды составляют основу жаростойких, износостойких, антифрикционных покрытий деталей, выполненных из металла или сплава.
Прочность соединений металлов с керамикой, получаемых с помощью пайки, обеспечивается образованиям также ковалентных связей.
Ионная связь
Характерна для кристаллов, образованных из ионов разного знака (Na+ и Cl-). Ионная связь возникает тогда, когда один из атомов отбирает один или несколько электронов у другого. Получившиеся ионы разных знаков испытывают электростатические силы притяжения и образуют кристаллическую решетку. Полностью им соединиться мешают силы отталкивания положительно заряженных.
Ионную связь образуют кристаллы окислов металлов, карбиды, силициды, соли разных кислот.
Характерные свойства ионных кристаллов:
а) высокая температура плавления;
б) малая тепло- и электропроводность;
в) большая твердость;
г) низкая пластичность.
Вещества с ионной связью широко используются в качестве основы жаростойких, износостойких, антифрикционных покрытий.
Молекулярная связь (силы Ван-дер-Ваальса)
Возникает вследствие возникновения согласованных изменений (корреляции) частоты вращения внешних электронов сближающихся атомов.
При повышении частоты образуется область «-» заряда, а при понижении частоты у внешнего электрона сближающегося атома образуется область «+» заряда. В результате оба атома электростатически притягиваются друг к другу. Никакого обмена электронами не происходит.
|
|

Силы Ван-дер-Ваальса существенно (≈103 раз) меньше сил остальных видов химических связей. В сварке они играют роль в процессах на поверхностях твердых и жидких тел, обуславливая явления физической адсорбции.
Рассмотренные виды химических связей могут наблюдаться не только в разных телах, но и в разных зонах одного тела. Возможно, например образование цепочек или слоев атомов, связанных ковалентными связями, и соединение цепочек или слоев молекулярными связями, причем прочность тех и других связей может быть весьма различной.
Поэтому иное твердое тело легко делится на волокна, пластинки и т. п.
3. Опишите механизм образования монолитных соединений твердых тел.
Теоретически образование монолитных соединений 2-х одинаковых монокристаллов с идеальными и чистыми поверхностями возможны при любой температуре и без приложения внешней энергии, лишь бы сблизить поверхность и совместить кристаллические решетки.
 В действительности даже в идеальном случае для соединения поверхности требуется затраты энергии. На свободной поверхности кристалла атом не уравновешен, что вызывает повышение энергии поверхностного слоя кристалла. wп>w0, где w0-энергия перемещения атома внутри тела. Поэтому для соединения 2-х монокристаллов в один требуется деформационная, или тепловая, энергия извне превышающую граничную энергию wг. Внешняя энергия превышающая граничную ведет к возникновению квантовых процессов, взаимодействия электронных оболочек атомов. После этого общая энергия системы начинает снижаться до уровня w0 и выделится энергия равная избыточной энергии поверхностных атомов кристаллов до их соединения, т.е. энергии активации. Получение монолитных соединений осложняется:
В действительности даже в идеальном случае для соединения поверхности требуется затраты энергии. На свободной поверхности кристалла атом не уравновешен, что вызывает повышение энергии поверхностного слоя кристалла. wп>w0, где w0-энергия перемещения атома внутри тела. Поэтому для соединения 2-х монокристаллов в один требуется деформационная, или тепловая, энергия извне превышающую граничную энергию wг. Внешняя энергия превышающая граничную ведет к возникновению квантовых процессов, взаимодействия электронных оболочек атомов. После этого общая энергия системы начинает снижаться до уровня w0 и выделится энергия равная избыточной энергии поверхностных атомов кристаллов до их соединения, т.е. энергии активации. Получение монолитных соединений осложняется:
а) наличием микронеровностей;
б) наличие загрязнений и окислов.
4. Опишите строение поверхности твердого тела и механизм образования окисной пленки.
Структура поверхности характеризуется:
1) шероховатостью поверхности (от предыдущей обработки);
|
|
2) повышенной плотностью дислокаций (порядка 1011 1/см2);
3) наличием адсорбированной пленки сложного физико-химического состава.
Избыток энергии приповерхностных атомов приводит к возникновению сил притяжения между поверхностью тела и частицами окружающей фазы, - адсорбции.
Различают:
а) физическую адсорбцию – поглощенные из окружающей фазы частицы не образуют химической связи с поверхностью (силы Ван-дер-Ваальса);
б) химическую адсорбцию (хемосорбцию), когда таковая связь образуется (ковалентная и ионная).
Оба вида адсорбции тесно связаны и могут происходить одновременно. При этом избыток энергии выделяется в виде тепла – для физической (1÷5)·104 Дж/моль; для химической (5÷20)·104 Дж/моль.
Состав, толщина окисной пленки зависит от:
 а) химических свойств сплава;
а) химических свойств сплава;
б) физико-химических свойств окисной пленки;
в) химического состава газовой фазы (O2, H2O, CO2, SO2 и т. д.);
г) времени взаимодействия.
Механизм образования окисла:
1)Образование на чистой поверхности сплава начинается с физической адсорбции молекул О2, Н2О и атомов окружающей среды. В результате на поверхности образуется плотный слой газовых молекул и атомов.
2) Еще до окончания процесса физической адсорбции ранее адсорбированные молекулы дисоциируют с О2, вступают в реакцию с ионами сплава образуя окисел (МеО).
3) После образования одного атомного слоя окисла, уже на поверхности окисла вновь адсорбируется молекулы окружающей газовой фазы. Электроны Ме за счет тоннельного эффекта преодолевая потенциальный барьер и проходя через тонкую пленку окисла является полупроводниковым вступает в реакцию с ионами кислорода и образуют новый атомный слой окисной пленки. Процесс многократно повторяется. Т.о. даже при низкой температуре на поверхности Ме-го сплава всегда присутствует тонкий слой окисной пленки.
4) При нагреве, при взаимодействии сварочного источника тепла, рост скорости пленки ускоряется (в 1000 и 10 000 раз) в связи с активизацией процесса диффузии ионов Ме ч/з окиси, как ч/з полупроводники. 5) Наличие легирующих элементов по разному влияют на скорость окисления. Например легированные элементы уменьшают скорость окисления Fe сплавов, а в Ni сплавах ускоряет.
При сварке
- сварка плавлением:
1) проводит предварительную зачистку кромок от окисных пленок и загрязнений.
2) защита зоны сварки осуществляется: а) с пом-ю расплавленного шлака б) с пом-ю инертных и активных защитных газов в) с помощью пониженного давления ОС
3) обеспечение физического контакта осуществляется при сборке соединения под сварку и использования присадки.
4) передача свариваемым пов-тям энергии активации, осуществляемой за счет подвода тепла от источника нагрева, сближения атомов свариваемых материалов, за счет смачивания пов-тей жидким металлом.
|
|
- сварка давлением:
1) проводит предварительну. зачистку кромок от окисных пленок и загрязнений; окончательное удаление окисных пленок осуществляется за счет разрушения их в процессе пластической деформации и выноса обломков из зоны соединения
2) спец. Меры для защиты свариваемых пов-тей в процессе сварки давлением не проводят, но в случае необходимости применяют газовую защиту
3) образование физич контакта осуществляется за счет приложенного давления
4) передача энергии активации осущ-ся за счет деформации свариваемых пов-тей, а иногда и допол-м подводом тепла.
2. При пайке:
Для очистки поверхности металла применяются два взаимодополняющих способа: механический (металлическая проволочная щетка, стальная шлифовальная шерсть или мелкая шкурка) и химический (травление кислотой или применение многокомпонентного флюса, который обладает в том числе, свойством очищать металл)
После удаления загрязнения следует нагрев соединяемых деталей до температуры ниже температуры плавления паяемых деталей. Далее - введение в зазор между паяемыми деталями припоя. Взаимодействие между паяемыми деталями и припоем. Кристаллизация жидкой формы припоя, находящейся между соединяемыми деталями.
КПД сварочных процессов.
Каждая ступень передачи энергии от источника к изделию имеет свой коэффициент полезного действия
Эффективный КПД
 ;
;
термический КПД
 ;
;
термодинамический или КПД плавления
 .
.
Катодная область
Анодная область
Образование анодной области с падением напряжения от 0 до 30 В (обычно 2,5  0,5В), протяженностью в направлении оси дуги около 10-2-10-3мм. Обусловлено отрицательным объемным зарядом. Электроны, поступающие из столба, ускоряются в направлении к аноду, где их кинетическая (2кТ) и потенциальная (
0,5В), протяженностью в направлении оси дуги около 10-2-10-3мм. Обусловлено отрицательным объемным зарядом. Электроны, поступающие из столба, ускоряются в направлении к аноду, где их кинетическая (2кТ) и потенциальная ( ) энергии преобразуются в теплоту.
) энергии преобразуются в теплоту.
Анод не является поставщиком ионов в столб дуги. Они образуются вследствие термической ионизации в пранодной области и затем ускоряются в направлении к катоду.
Уравнение Саха.
Для термической плазмы, то есть находящуюся в термическом равновесии каковой является плазма столба дуги можно рассматривать термическую ионизацию как обратимую химическую реакцию газов:
А0+(работа ионизации) 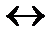 А++
А++ 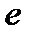 -
-
Обозначим через æ степень ионизации
æ = 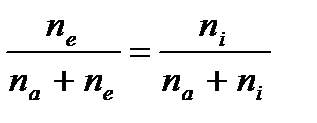 - отношение числа заряженных частиц одного знака к суммарной концентрации.
- отношение числа заряженных частиц одного знака к суммарной концентрации.
Степень ионизации термической плазмы определяется уравнением Саха:
 , где
, где
р- давление среды, в которой горит дуга, Па;
а- квантовый коэффициент (для аргона а2=4);
Т- температура плазмы, К;
Ui- потенциал ионизации газа, в котором горит дуга, В;
(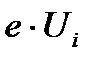 )- энергия ионизации, эВ.
)- энергия ионизации, эВ.

Однако надо иметь ввиду, что уравнение Саха дает результаты близкие к экспериментальным только при малых степенях ионизации, что вполне приемлемо для сварочных дуг.
Теория сварочных процессов
1 Приведите определения терминов «сварка», «наплавка», «пайка», «склеивание» и изложите основные физико-химические процессы, протекающие при этом
Сварка – процесс получения неразъемного соединения на атомно-молекулярном уровне путем термодинамически необратимого превращения энергии и вещества.
Наплавка – сварка плавлением, в процессе которой на поверхность детали наносится слой металла необходимого состава.
Пайка – процесс соединения материалов с помощью вносимого между ними припоя с температурой плавления более низкой, чем у соединяемых материалов.
Склеивание – образование соединения без введения энергии благодаря силам адгезии (прилипания) между жидким клеем и молекулами твердого вещества.
Схема получения неразъемного соединения

Вид, интенсивность и характер преобразования вводимой энергии – вот главное, что определяет вид процесса сварки.
Введение энергии – необходимое условие сварки, поскольку требуется активация соединяемых поверхностей.
Введение вещества необходимо только при некоторых видах сварки плавлением и пайки, причем энергия в этих случаях может вводиться также с расплавленным металлом.
Характер движения (переноса) вещества в зоне образования неразъемного соединения сильно зависит от вида процесса.
При сварки плавлением, особенно при СПЭ, движение велико, при сварке давлением с нагревом оно незначительно (за счет диффузии), а при холодной сварке движение вещества практически отсутствует (есть только дислокации кристаллической решетки).
По виду введенной энергии процессы сварки делятся на: термические (Т), термомеханические (ТМ), механические (М).
По состоянию вещества процессы сварки делятся на: сварку плавлением (в жидкой фазе) и сварку давлением (в твердой фазе).
Перечислите виды химических связей и их участие в процессах сварки, пайки, склеивания
Соединение атомов в твердом или жидком теле происходит в результате действия двух видов сил:
1) электростатических;
2) обменных, связанных с волновой природой электронов.
Химическая связь, природа которой электромагнитна, возникает в результате взаимодействия электронной волны с электромагнитным полем ядра атома или иона. Расстояние действия химических сил – несколько ангстрем.
Металлическая связь
Особенности свойств металлов и сплавов обусловлены:
1) положительные ионы расположены в узлах кристаллической решетки;
2) все валентные электроны обобщены и имеют одинаковый для всех средний уровень энергии.

|
При определении сил энергетического взаимодействия допускают:
1) ионы приближаются к точечным зарядам;
2) влияние соседних ионов отсутствует;
3) энергия притяжения «-», отталкивания «+»;
4) энергия связи U1(r) – энергия, необходимая для разъединения кристалла на изолированные атомы.
Существуют две составляющие энергии связи:
1) энергия электростатического взаимодействия «+» ионов и «-» электронов электронного газа.
2) составляющая U2(r) – кинетическая энергия электронного газа, приходящаяся на один атом. Эта энергия уравновешивает энергию электростатического взаимодействия и тело остается твердым.
Результирующая энергия связи характеризуется «потенциальной ямой», определяющей размер кристаллической решетки d.

где U∑ - энергия, необходимая для расплавления твердого тела (заштрихованная область).
Металлическая связь (взаимодействие «+» ионов и электронов газа) придает металлам и сплавам следующие свойства:
а) высокую электропроводность и теплопроводность;
б) высокую пластичность (электронный газ допускает большее смещение).
Ковалентная связь
Этот вид связи получается при образовании одной или нескольких электронных пар. Каждый электрон пары принадлежит обоим соединенным атомам, образуя электронные оболочки вокруг двух ядер.

Вещества, образующие ковалентную связь имеют:
а) высокую прочность и температуру плавления;
б) низкую тепло- и электропроводность (нет свободных электронов);
в) низкий уровень упругих деформаций и низкую пластичность;
Ковалентную связь может образовать типичный металл с металлом, (если один не растворяется в кристаллической решетки другого) в результате образуется интерметаллид, обладающий рядом особых свойств.
Например: интерметаллид TiB2 не окисляется до 15000С и жаропрочен до 25000С, но имеет низкую пластичность.
Ковалентные связи образуются при соединении Ме с металлоидами, в частности с окислами, интерметаллид, карбидами, силицидами.
Исследования условий образования и существования ковалентных связей весьма важны, поскольку именно окислы, интерметаллиды, карбиды, силициды составляют основу жаростойких, износостойких, антифрикционных покрытий деталей, выполненных из металла или сплава.
Прочность соединений металлов с керамикой, получаемых с помощью пайки, обеспечивается образованиям также ковалентных связей.
Ионная связь
Характерна для кристаллов, образованных из ионов разного знака (Na+ и Cl-). Ионная связь возникает тогда, когда один из атомов отбирает один или несколько электронов у другого. Получившиеся ионы разных знаков испытывают электростатические силы притяжения и образуют кристаллическую решетку. Полностью им соединиться мешают силы отталкивания положительно заряженных.
Ионную связь образуют кристаллы окислов металлов, карбиды, силициды, соли разных кислот.
Характерные свойства ионных кристаллов:
а) высокая температура плавления;
б) малая тепло- и электропроводность;
в) большая твердость;
г) низкая пластичность.
Вещества с ионной связью широко используются в качестве основы жаростойких, износостойких, антифрикционных покрытий.
Молекулярная связь (силы Ван-дер-Ваальса)
Возникает вследствие возникновения согласованных изменений (корреляции) частоты вращения внешних электронов сближающихся атомов.
При повышении частоты образуется область «-» заряда, а при понижении частоты у внешнего электрона сближающегося атома образуется область «+» заряда. В результате оба атома электростатически притягиваются друг к другу. Никакого обмена электронами не происходит.

Силы Ван-дер-Ваальса существенно (≈103 раз) меньше сил остальных видов химических связей. В сварке они играют роль в процессах на поверхностях твердых и жидких тел, обуславливая явления физической адсорбции.
Рассмотренные виды химических связей могут наблюдаться не только в разных телах, но и в разных зонах одного тела. Возможно, например образование цепочек или слоев атомов, связанных ковалентными связями, и соединение цепочек или слоев молекулярными связями, причем прочность тех и других связей может быть весьма различной.
Поэтому иное твердое тело легко делится на волокна, пластинки и т. п.
3. Опишите механизм образования монолитных соединений твердых тел.
Теоретически образование монолитных соединений 2-х одинаковых монокристаллов с идеальными и чистыми поверхностями возможны при любой температуре и без приложения внешней энергии, лишь бы сблизить поверхность и совместить кристаллические решетки.
 В действительности даже в идеальном случае для соединения поверхности требуется затраты энергии. На свободной поверхности кристалла атом не уравновешен, что вызывает повышение энергии поверхностного слоя кристалла. wп>w0, где w0-энергия перемещения атома внутри тела. Поэтому для соединения 2-х монокристаллов в один требуется деформационная, или тепловая, энергия извне превышающую граничную энергию wг. Внешняя энергия превышающая граничную ведет к возникновению квантовых процессов, взаимодействия электронных оболочек атомов. После этого общая энергия системы начинает снижаться до уровня w0 и выделится энергия равная избыточной энергии поверхностных атомов кристаллов до их соединения, т.е. энергии активации. Получение монолитных соединений осложняется:
В действительности даже в идеальном случае для соединения поверхности требуется затраты энергии. На свободной поверхности кристалла атом не уравновешен, что вызывает повышение энергии поверхностного слоя кристалла. wп>w0, где w0-энергия перемещения атома внутри тела. Поэтому для соединения 2-х монокристаллов в один требуется деформационная, или тепловая, энергия извне превышающую граничную энергию wг. Внешняя энергия превышающая граничную ведет к возникновению квантовых процессов, взаимодействия электронных оболочек атомов. После этого общая энергия системы начинает снижаться до уровня w0 и выделится энергия равная избыточной энергии поверхностных атомов кристаллов до их соединения, т.е. энергии активации. Получение монолитных соединений осложняется:
а) наличием микронеровностей;
б) наличие загрязнений и окислов.
4. Опишите строение поверхности твердого тела и механизм образования окисной пленки.
Структура поверхности характеризуется:
1) шероховатостью поверхности (от предыдущей обработки);
2) повышенной плотностью дислокаций (порядка 1011 1/см2);
3) наличием адсорбированной пленки сложного физико-химического состава.
Избыток энергии приповерхностных атомов приводит к возникновению сил притяжения между поверхностью тела и частицами окружающей фазы, - адсорбции.
Различают:
а) физическую адсорбцию – поглощенные из окружающей фазы частицы не образуют химической связи с поверхностью (силы Ван-дер-Ваальса);
б) химическую адсорбцию (хемосорбцию), когда таковая связь образуется (ковалентная и ионная).
Оба вида адсорбции тесно связаны и могут происходить одновременно. При этом избыток энергии выделяется в виде тепла – для физической (1÷5)·104 Дж/моль; для химической (5÷20)·104 Дж/моль.
Состав, толщина окисной пленки зависит от:
 а) химических свойств сплава;
а) химических свойств сплава;
б) физико-химических свойств окисной пленки;
в) химического состава газовой фазы (O2, H2O, CO2, SO2 и т. д.);
г) времени взаимодействия.
Механизм образования окисла:
1)Образование на чистой поверхности сплава начинается с физической адсорбции молекул О2, Н2О и атомов окружающей среды. В результате на поверхности образуется плотный слой газовых молекул и атомов.
2) Еще до окончания процесса физической адсорбции ранее адсорбированные молекулы дисоциируют с О2, вступают в реакцию с ионами сплава образуя окисел (МеО).
3) После образования одного атомного слоя окисла, уже на поверхности окисла вновь адсорбируется молекулы окружающей газовой фазы. Электроны Ме за счет тоннельного эффекта преодолевая потенциальный барьер и проходя через тонкую пленку окисла является полупроводниковым вступает в реакцию с ионами кислорода и образуют новый атомный слой окисной пленки. Процесс многократно повторяется. Т.о. даже при низкой температуре на поверхности Ме-го сплава всегда присутствует тонкий слой окисной пленки.
4) При нагреве, при взаимодействии сварочного источника тепла, рост скорости пленки ускоряется (в 1000 и 10 000 раз) в связи с активизацией процесса диффузии ионов Ме ч/з окиси, как ч/з полупроводники. 5) Наличие легирующих элементов по разному влияют на скорость окисления. Например легированные элементы уменьшают скорость окисления Fe сплавов, а в Ni сплавах ускоряет.
|
|
|

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!