При малых содержаниях в растворах кислоты или соды лучшие результаты по сравнению с классическим титриметрическим методом дает метод потенциометрического титрования с определением точки эквивалентности расчетным способом. При определении, например, соды возможны ошибки из-за СО2 присутствующего в воде и образующего угольную кислоту. При концентрации сильной кислоты более 5 ∙ 10-5 моль/л (pH ≈ 4,3) диссоциация Н2CO3 практически подавлена, что приводит к уменьшению ошибки определения.
Титруют разбавленным раствором соляной кислоты из микробюретки. Проводят холостое титрование, определяя эквивалентный объем НСl, расходуемый на реакцию с растворенным в воде СО2.
1 Приборы, посуда, реактивы:
1) рН-метр;
2) стеклянный и каломельный электроды;
3) микробюретка вместимостью 1-2 мл;
4) 2 мерные колбы вместимостью 100 мл;
5) стаканы для титрования вместимостью 150 мл;
6) рабочий титрованный раствор соляной кислоты 0,1моль/л (0,1 н).
2 Выполнение работы:
1) подготовить прибор к работе в соответствии с инструкцией к прибору;
2) из 0,1н раствора HCl приготовить 100 мл 0,01н раствора НСl;
3) заполнить микробюретку 0,01 н раствором НСl;
4) отмерить мерной колбой 100 мл дистиллированной воды и поместить в стакан для титрования, опустить электроды;
5) титровать воду раствором соляной кислоты до рН = 4,3, записав объем НСl, израсходованный для этого и точное значение рН (pH1 и V1);
6) прилить еще 1 мл раствора НСl, перемешать и записать результаты измерения (pH2 и V2 = V1 + 1);
7) еще раз оттитровать 100 мл воды и записать значения рН и V (HС1); Запись можно вести в виде таблицы.
| Титруемый раствор
| рН1
| V1, мл
| рН2
| V2, мл
| ΔрН
| Vэкв.
|
|
Вода
|
|
|
|
|
|
| Vэкв.1
| среднее
Vэкв.
|
|
|
|
|
|
|
| Vэкв.2
|
| Сода
|
|
|
|
|
| V'экв.
|
8) в чистую мерную колбу объемом 100 мл получить контрольный раствор соды, долить до метки дистиллированной водой из той же склянки, из которой брали для холостого титрования, перемешать, перелить в стакан для титрования. Титровать как в п.п. 5,6, записать результаты в таблицу;
9) вычисления. По результатам титрований вычислить эквивалентные объемы соляной кислоты Vэкв1 и Vэкв2 пошедшие на 1-е и 2-е титрование воды и средний эквивалентный объем V0экв.

 ,
,
а также V/экв. эквивалентный объем, пошедший на титрование раствора соды.
Расчет Vэкв. в каждом титровании проводить по формуле:
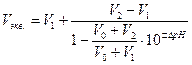 ,
,
где V0 - объем титруемого раствора, равный 100 мл;
ΔрН = рН1 - pH2 - вычисляется для каждого титрования.
Вычислите:
а) количество вещества эквивалентов соды в контрольном растворе:
 ;
;
б) массу соды, мг.
Лабораторная работа
Определение железа методом потенциометрического титрования
Раствором бихромата калия
Определение железа в растворах основано на предварительном восстановлении Fe3+ до Fe2+ избытком хлорида олова (II) с последующим титрованием двух восстановителей (Fe2+ и Sn2+) раствором бихромата калия. При титровании в растворе протекают реакции окисления сначала ионов Sn2+, а затем Fe2+:
3Sn2+ + Cr2O72- +14Н+ → 3Sn4+ + 2Сг3+ + 7Н2O
6Fe2+ + Cr2O72- +14Н+ → 6Fe3+ + 2Сг3+ +7Н2O
Потенциал индикаторного электрода зависит от соотношения концентраций окисленных и восстановленных форм олова и железа, которое изменяется в ходе титрования. Кривая титрования будет иметь два скачка: первый соответствует окислению олова, второй - железа.
1 Приборы, посуда, реактивы:
1) потенциометр (рН-метр);
2) электроды - платиновый в качестве индикаторного и хлорсеребряный (электрод сравнения);
3) электроплитка;
4) стакан вместимостью 200-250 мл;
5) 2 пипетки вместимостью 10 мл;
6) бюретка вместимостью 25 мл;
7) мерный цилиндр вместимостью 25 мл;
8) часовое стекло;
9) Реактивы: растворы хлорида железа (III), хлорида олова (II), соляной кислоты (1:1), бихромат калия С(1/6 К2Сг2О7) = 0,1000моль/л.
2 Выполнение работы:
1) включить прибор и подготовить его к работе как указано в инструкции к нему;
2) в стакан пипеткой отмерить 10,0 мл раствора хлорного железа, добавить 5 мл соляной кислоты (1:1), отмеривая её цилиндром, нагреть до кипения, закрыв стакан часовым стеклом;
3) в кипящий раствор из пипетки прибавить раствор хлорида олова (II) до полного обесцвечивания (признак восстановления Fe3+ до Fe2+)и еще 10 капель. Прилить соляной кислоты 25 мл и нагреть до 60-65 °С;
4) опустить электроды в горячий раствор и быстро титровать по 0,5 мл раствором бихромата калия (не допуская охлаждения). Титровать до получения двух скачков потенциала. Исчезновение зеленого оттенка раствора и появление желто-оранжевого может служить признаком конца титрования;
5) при титровании записывать показания прибора, соответствующие каждой порции добавленного титранта;
| V мл, К2Сг2О7
| 0,5
| 1,0
| 1,5
| 2,0
| и т.д.
|
| Е, мВ
|
|
|
|
|
|
6)получить контрольный раствор, подготовить и оттитровать его как стандартный (см. п.п. 2-4), записать результаты титрования как в п. 5;
7)построить графики по результатам титрования стандартного и контрольного растворов в координатах "Е - V (титранта)" и "ΔЕ /ΔV - V (титранта)". Найти объемы раствора бихромата калия, эквивалентные объемам стандартного и контрольного раствора хлорида железа, вычислить объем контрольного раствора FeCl3 в мл;
8)зная концентрацию бихромата калия вычислить содержание в контрольном растворе:
а) ммоль FeCl3;
б) мг FeCl3;
в) мг Fe3+.




 ,
,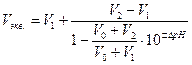 ,
, ;
;

