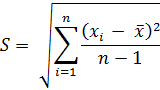Испытуемый образец помещают непосредственно в питательную среду. При этом объем продукта должен составлять не более 10% объема среды, если не предписано иное. Инокулированную среду инкубируют в течение не менее 14 дней. Состояние культур оценивают несколько раз в течение инкубационного периода.
Время от времени в течение периода инкубации, а также по его завершении оценивают наличие макроскопических признаков микробного роста в средах. Если признаков микробного роста не обнаруживается, то продукт признают выдерживающим испытание на стерильность. Если обнаруживается рост, то продукт не выдерживает испытание на стерильность.
Если внесение испытуемого материала приводит к помутнению питательной среды, вследствие чего наличие или отсутствие микробного роста не может быть легко определено визуально, следует через 14 дней после начала инкубации перенести порции среды (каждая объемом не менее 1 мл) в другие сосуды, содержащие свежую аналогичную среду и инкубировать исходные сосуды и сосуды с перенесенными порциями в течение 4 дней. Если признаков микробного роста не обнаруживается, то продукт признают выдерживающим испытание на стерильность.
Однородность дозированных единиц
Данный показатель определяется как степень однородности распределения действующего вещества в дозированных единицах.
Метод прямого определения. Метод основывается на количественном определении индивидуального содержания действующих веществ в испытуемых дозированных единицах, с целью выяснения, находится ли это содержание внутри установленных пределов. Отбирают не менее 30 единиц лекарственного средства и проводят количественное определение действующего вещества, как указано для данной дозированной формы. В каждой из 10 отобранных единиц определяют количественное содержание активного вещества, используя подходящий аналитический метод. Рассчитывают приемлемое значение (AV):
AV = |M − X| + kS,
где M - контрольное значение;
X - среднее значение выборки;
k - константа приемлемости;
S - стандартное отклонение в выборке.
Стандартное отклонение в выборке (S) рассчитывается по формуле:
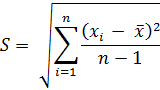
Далее рассчитывают относительное стандартное отклонение (RSD):

Требование выполнено, если содержание действующего вещества в каждой из 10 единиц лекарственного средства находится в пределах от 85%до 115% (L1=15%) от среднего содержания действующего вещества, а относительное стандартное отклонение не превышает 6%.
Если хотя бы в одной единице дозированного лекарственного средства содержание действующего вещества выходит за пределы от 85% до 115%, но во всех единицах находится в пределах от 75% до 125% (L2=25%) от его содержании, тест дополнительно проводят на 20 единицах.
Требование считается выполненным, если не более чем в 1 единице из 30 (10+20) содержание действующего вещества выходит за предел от 85% до 115% и ни в одной не выходит за предел от 75% до 125%, а относительное стандартное отклонение для 20 единиц не превышает 7,8%.
Бактериальные эндотоксины
Испытание на бактериальные эндотоксины проводят для определения наличия или количества эндотоксинов, источником которых являются грамотрицательные бактерии, с использованием лизата амебоцитов мечехвоста Limulus polyphemus или Tachypleus tridentatus. Существует три принципа проведения данного испытания: принцип гель-тромба, основанный на образовании геля; турбидиметрический принцип, основанный на помутнении в результате расщепления эндогенного субстрата; хромогенный принцип, основанный на появлении окраски после расщепления синтетического пептидно-хромогенного комплекса. В настоящем разделе описаны шесть методов:
Метод А. Гель-тромб-метод: предельное испытание.
Метод В. Гель-тромб-метод: полуколичественное испытание.
Метод С. Турбидиметрический кинетический метод.
Метод D. Хромогенный кинетический метод.
Метод Е. Хромогенный метод конечной точки.
Метод F. Турбидиметрический метод конечной точки.
Испытание выполняют любым из этих шести методов. В сомнительных и спорных случаях окончательное решение принимают, основываясь на методе А, если иное не предписано в частной статье. Испытание выполняют в условиях, не допускающих загрязнения посторонними эндотоксинами.
Принцип гель-тромба (Метод А): гель-тромб-методы позволяют определять наличие и количество эндотоксинов и основываются на эффекте свертывания лизата в присутствии эндотоксинов. Концентрация эндотоксинов, требующаяся для свертывания лизата в стандартных условиях, представляет собой указанную на этикетке чувствительность лизата.
Готовят стандартные растворы не менее, чем четырех концентраций, эквивалентных 2λ, λ, 0,5λ и 0,25 λ, путем разбавления исходного стандартного раствора эндотоксина водой для ИБЭ. В каждой из пробирок смешивают раствор лизата с равным объемом одного из стандартных растворов (например, по 0,1 мл каждого). Реакционную смесь инкубируют в течение определенного периода, в соответствии с рекомендациями производителя лизата (обычно 37±10С в течение 60±2 минут), избегая вибрации. Исследуют целостность геля: при использовании пробирок каждую из них по очереди извлекают из инкубатора и переворачивают одним плавным движением приблизительно на 180°. Если образуется твердый гель, остающийся на своем месте после переворачивании, результат записывают как положительный. Результат отрицательный, если неповрежденного геля не образуется. Результаты испытания считают достоверными, если низшая концентрация стандартных растворов во всех повторностях дает отрицательный результат. За конечную точку принимают последний положительный результат в нисходящем ряду концентраций эндотоксина.
Пирогенность
Пирогены - высокомолекулярные вещества от 50 до 1 мкм липополисахариды отсорбированные белковым носителем, содержат углеводы, азот, фосфор, зольные вещества.
Различные вещества, вызывающие при внутрисосудистом введении лихорадочные состояния.
Свойства: растворимы в воде, нерастворимы в спирте и ацетоне, устойчивы к высокой температуре, изменение рН раствора не влияет на устойчивость.
Делятся на:
Ø Эндогенные (клеточнотканевые, образуются в определенных условиях);
Ø Экзогенные (содержатся в микроорганизмах и выделяются ими в процессе жизнедеятельности).
Источники:
Ø микроорганизмы (грамм и грамм бактерии, грибы и вирусы);
Ø некоторые химические вещества (продукты термоокислительной деструкции пластмасс и фторопластов).
Существует три степени тяжести пирогенных реакции:
Ø Легкая степень (незначительное повышение температуры 370С)
Ø Средняя степень(озноб, головная боль, повышение температуры до 390С, проходит в течении нескольких часов)
Ø Тяжелая степень (сильный озноб, боли в пояснице, рвота, отдышка, повышение температуры до 400С, возможен смертельный исход, улучшение наступает через сутки)
Методы контроля на апирогенность
Ø Биологическое испытание
Ø LAL-тест (высоко чувствительный и специфичный)
Биологическое испытание
Испытание состоит в измерении роста температуры тела, вызванного у кроликов внутривенном введением стерильного раствора испытуемого образца.
Ø Используют здоровых взрослых кроликов обоего пола массой не менее 1,5 кг, получавших полноценное сбалансированное питание, не включающее антибиотиков, масса тела которых не снижалась в течение недели, предшествующей испытанию.
Ø Помещение для животных. Кроликов содержат индивидуально в тихом помещении при однородной подходящей температуре. Испытание проводят в тихом помещении, где могут возбудить животных, и в котором температура поддерживается на уровне не более чем на 3°С, отличающимся от температуры поддерживаемое в месте постоянного содержания кроликов. Животные помещаются в клетки не менее чем за 1 час до первого измерения температуры и остаются там в течение всего испытания.
Ø Используют термометр или электрическое устройство, показывающее температуру с точностью до 0.1°С, вводя его в прямую кишку кролика на глубину около 5 см. Глубина введения постоянна для каждого из кроликов в течение каждого из испытаний.
Предварительное испытание:
Ø вводят внутривенно апирогенный раствор 9 г/л натрия хлорида Р. Нагретый до температуры 38,5 0С в количестве 10 мл на килограмм массы тела. Записывается температура животных, начиная не менее чем за 90 минут до введения и продолжая в течение 3 часов после введения раствора. Животные, температура которых колеблется в пределах более чем 0,60С, не используются в основном испытании.
Основное испытание:
Ø Проводят с использованием группы из трех кроликов.
Ø Испытуемый раствор медленно вводят в крайнюю вену уха каждого из кроликов в течение не более 4 минут.
Ø После проведения испытания на группе из 3 кроликов его при необходимости повторяют на других группах из 3 кроликов (суммарно до 4-х групп, в зависимости от полученных результатов).
Ø Если суммированный результат, полученный в первой группе, не превышает значение, данное во второй колонке таблицы 5 считают, что продукт выдерживает испытание.
Ø Если суммированный результат превышает значение, данное во второй колонке таблицы 5, но не превышает значение, данное в третьей колонке таблицы, испытание повторяют как указано выше.
Ø Если суммированный результат превышает значение, данное в третьей колонке таблицы, считают, что продукт не выдерживаетиспытание.
Таблица 5: Значения для биологического испытания на пирогенность
| Количество кроликов
| Продукт выдерживает испытание, если суммированный результат не превышает
| Продукт не выдерживает испытание, если суммированный результат превышает
|
|
| 1,150С
| 2,650С
|
|
| 2,800С
| 4,300С
|
|
| 4,450С
| 5,950С
|
|
| 6,600С
| 6,600С
|
Ø Кролики, которые использовались в испытании на пирогенность, в случае если повышение температуры составило 1,2°С, исключаются из дальнейших испытаний.
Ø Недостаток: относительная длительность проведения эксперимента, различная чувствительность к пирогенам у кролика и человека, нельзя провести количественное определение.
LAL-тест:
Ø В основе лежит физико-химическое взаимодействие лизата клеток мечехвостиков с эндотоксином.
Ø В результате образуется гель различной плотности.
Ø Можно установить наличие эндотоксина и провести количественное определение.
Ø Время выполнения 1 час.
Ø Испытание на бактериальный токсин проводят для определения его присутствия или количества(источник эндотоксина Гр- бактерии).
Существует 3 принципа проведения испытания:
1. Принцип гель тромба (основан на образовании геля);
2. Турбидиметрический метод (основан на помутнении в результате расщепления эндогенного субстрата);
3. Хромогенный(основан на появлении окраски после расщепления синтетического пептидно-хромогенного комплекса)
В ГФ РБ имеется 6 методов проведения LAL- теста:
1. Гельтромб метод (предельное испытание на наличие бактериальных эндотоксинов);
2. Гельтромб метод (полуколичественное определение);
3. Турбидиметрический кинетический метод;
4. Хромогенный кинетический метод;
5. Хромогенный метод конечной точки;
6. Турбидиметрический метод конечной точки.
Аномальная токсичность
Проводят на здоровых белых мышах обоего пола массой от 19 до 21 г.
За 24 часа до испытания и во время его проведения животные должны находиться в помещении с постоянной температурой. За 2 часа до взвешивания и отбора животных для проведения испытания у них отбирается корм и вода.
Общее испытание проводят следующим образом: каждой из пяти здоровых мышей вводят внутривенно предписанное в частной статье количество субстанции, растворенное в 0,5 мл воды для инъекций или стерильного раствора хлорида натрия концентрацией 9 г/л. Если не предписано иное, раствор вводят в течение 15-30 секунд. Мышь фиксируется на станке, в котором свободным остается только хвостик. Инъекция производится в хвостовую вену мыши. Если в частной статье предусмотрен иной путь введения препарата мышам, объем раствора, вводимого в брюшную полость, под кожу или в желудок, может быть увеличен до 1 мл. Введение в желудок производят шприцем посредством инъекционной иглы, на конце которой имеется наплавленная олива, или при помощи другого приспособления, обеспечивающего поступление раствора или взвеси препарата в желудок.
Считают, что субстанция и другие препараты выдерживают испытание, если ни одна из мышей не погибает в течение 24 часов или времени, указанного в частной статье. Если погибает более одного животного, считают, что субстанция не выдерживает испытание. Если погибает одно животное, испытание повторяют. Считают, что препарат выдерживает испытание, если ни одна из мышей второй группы не погибает в течение указанного промежутка времени.
В случае гибели одной мыши опыт повторяют на 5 мышах; в случае гибели при первоначальном испытании двух мышей повторное испытание проводят на 15 животных. Если при повторном испытании ни одна мышь не погибнет, т.е. суммарная гибель животных в двух опытах не превысит 10%, препарат считается выдержавшим испытание. В противном случае препарат бракуют.