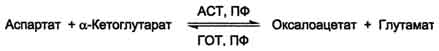Динамическое состояние белков в организме.Катепсины.
С обменом белков и аминокислот неразрывно связано понятие азотистого баланса (АБ), под которым понимают разницу между количеством азота, введенного в организм с пищей (Nввед) и количеством азота, выведенного из организма (Nвывед) в виде конечных продуктов азотистого обмена.
Динамическое состояние белка в организме - изменение белкового состава без нарушения функции.Оно мб:
1)Равновесное(равновесный АБ)- скорость катаболизма=скорость анаболизма
2)Положительное-скорость анаболизма больше(у детей и во время восстановления организма после заболевания)
3)Отрицательное-скорость катаболизма больше(у пожилых людей, при голодании, при онкологических заболеваниях)
КАТЕПСИНЫ(от греч. kathepso — перевариваю), протеолитич. ферменты из группы эндопептидаз. Локализованы в лизосомах клеток животных. Осуществляют внутриклеточное переваривание белков. По строению активного участка катепсины разделяют на цистеиновые, сериновые и аспартатные протеазы. Наиболее многочисленны катепсины, содержащие в своём активном сайте цистеин: это катепсины B, C, H, F, L, K, O, S, V/L2, X, W. К сериновым протеазам относятся катепсины A и G, к аспартатным — D и E.
Оптимальный pH для действия катепсинов =3.8. Их активность растёт в опухолевых клетках. Катепсины группы В — трипсиноподобные; группы D — действуют подобно пепсину, активируют другие катепсины. Катепсин группы G наиболее активен в полиморфноядерных лейкоцитах, действует подобно химотрипсину.
Пищевые белки как источник АК. Переваривание белков.
Нам надо кушать 100-120 г белка в день при трате 12000 кДж + по 10 г на каждые 1200 кДж. А детишкам 55-72 г\день
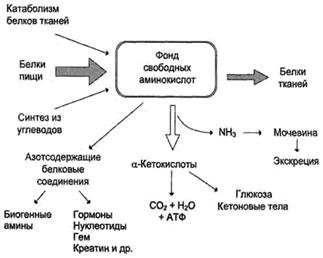
Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот в крови в среднем равно 35-65 мг/дл. Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека нормального телосложения составляет примерно 15 кг.
В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируются только углеродная часть молекулы большинства аминокислот, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи.
95-97% белков пищи всасываются в виде АК.Пептидазы ЖКТ поэтапно расщепляют пептидные связи белковой молекулы до конечного продукта гидролиза белков- АК,При гидролизе происходит разрыв СО-NН связи.
Особая роль глутамата в р-ях трансаминирования
Схема A
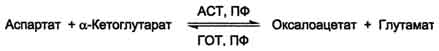
Схема Б
18. Определения трансаминаз в сыворотке крови, принцип, диагностическое значение
В клинической практике широко используют определение активности ACT и АЛТ в сыворотке крови для диагностики некоторых заболеваний. В норме в крови активность этих ферментов очень мала и составляет 5-40 Е/л. При повреждении клеток соответствующего органа ферменты выходят в кровь, где активность их резко повышается. Поскольку ACT и АЛТ наиболее активны в клетках печени, сердца и, в меньшей степени, скелетных мышц, их используют для диагностики болезней этих органов (см. раздел 2). В клетках сердечной мышцы количество ACT значительно превышает количество АЛТ, а в печени - наоборот. Поэтому особенно информативно одновременное измерение активности обоих ферментов в сыворотке крови. Соотношение активностей ACT/АЛТ называют "коэффициент де Ритиса". В норме этот коэффициент равен 1,33±0,42. При инфаркте миокарда активность ACT в крови увеличивается в 8-10 раз, а АЛТ - в 1,5-2,0 раза. Наиболее резко активность ACT увеличивается при некрозе ткани, так как выходит в кровь и цитоплазматическая и митохондриальная формы фермента. При инфаркте миокарда значение коэффициента де Ритиса резко возрастает. При гепатитах активность АЛТ в сыворотке крови увеличивается в ∼8-10 раз по сравнению с нормой, a ACT - в 2-4 раза. Коэффициент де Ритиса снижается до 0,6. Однако при циррозе печени этот коэффициент увеличивается, что свидетельствует о некрозе клеток, при котором в кровь выходят обе формы ACT.
Оксидаза L-аминокислот
В печени и почках обнаружен фермент оксидаза L-аминокислот, способный дезаминировать некоторые L-аминокислоты.
Коферментом в данной реакции выступает FMN. Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (рН 10,0). В клетках, где рН среды близок к нейтральному, активность фермента очень низка.
Оксидаза D-аминокислот также обнаружена в почках и печени. Это FAD-зависимый фермент. Оптимум рН этой оксидазы лежит в нейтральной среде, поэтому фермент более активен, чем оксидаза L-аминокислот. Роль оксидазы D-аминокислот невелика, так как количество D-изомеров в организме крайне мало, потому что в белки пищи и белки тканей человека и животных входят только природные L-аминокислоты. Вероятно, оксидаза D-аминокислот способствует их превращению в соответствующие L-изомеры
20)Окислительное дезаминирование глутаминовой кислоты.Глутаматдегидрогенеза
Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, коферментом глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование а-иминоглутарата, затем - неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется а-кетоглутарат (см. схему ниже).
Оксидаза L-аминокислот
Рис. 9-8. Биологическая роль оксидазы D-аминокислот.

Рис. 9-9. Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогена-зы, в результате чего получаются а-кетоглутарат и аммиак; Б - при необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты.
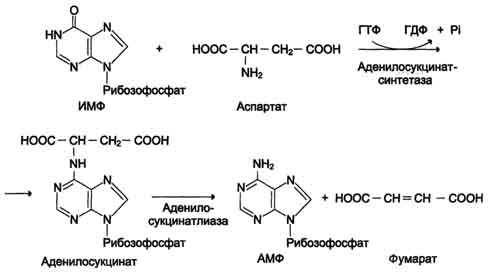
Схема А

Схема Б.
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
22)Декарбоксилирование аминокислот. Процесс отщепления карбоксильной группы ак в виде СО2 и приводит к образованию биогенных аминов, которые оказывают фармакологическое действие на физиологические функции человека.

Серотонин обладает сосудосуживающим действием, участвует в регуляции артериального давления, t тела, дыхания, медиатор нервных процессов.
Дофамин- предшественник катехоламинов.

гистидин гистамин
Гистамин обладает сосудорасширяющим действием. Он образуется в области воспаления, участвует в развитии аллергических реакций.
НООС-(СН2)2-СН-СООH →СН2-СН2-СН2-СООН
| |
глутамат NH2 NH2 γ аминомасляная кислота (ГАМК)
ГАМК является тормозным медиатором. В лечебной практике используется при лечении эпилепсии (резкое сокращение частоты припадков).
Орнитин декарбоксилируясь дает диамин – путресцин, а лизин – кадаверин.
СН2-СН2-СН2-СН-СООН →СН2-СН2-СН2-СН2-NH2;
| | |
NH2 NH2 NH2
CH2-CH2-CH2-CH2-CH-COOH → СН2-СН2-СН2-СН2-CH2-NH2
| | |
NH2 NH2 NH2
Схема А
- участвует в формировании воспалительной реакции - вызывает расширение сосудов, покраснение кожи, отёчность ткани;
- вызывает аллергическую реакцию;
- выполняет роль нейромедиатора;
- является медиатором боли.
Серотонин - нейромедиатор проводящих путей. Образуется в надпочечниках и ЦНС из аминокислоты 5-гидрокситриптофана в результате действия декарбоксилазы ароматических аминокислот. Этот фермент обладает широкой специфичностью и способен также декарбоксилировать триптофан и ДОФА, образующийся из тирозина. 5-Гидрокситриптофан синтезируется из триптофана под действием фенилаланингидроксилазы с коферментом Н4БП (этот фермент обладает специфичностью к ароматическим аминокислотам и гидроксидирует также фенилаланин) (см. схему ниже).
Серотонин может превращаться в гормон мелатонин, регулирующий суточные и сезонные изменения метаболизма организма и участвующий в регуляции репродуктивной функции.
Серотонин - биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует АД, температуру тела, дыхание, обладает антидепрессантным действием. По некоторым данным он может принимать участие в аллергических реакциях, поскольку в небольших количествах синтезируется в тучных клетках.
Вопрос № 25
Образование катехоламинов и ГАМК, функции аминов.
В мозговом веществе надпочечников и нервной ткани тирозин является предшественником катехоламинов(дофамина, норадреналина, адреналина).
При образовании катехоламинов и меланина (в меланоцитах) промежуточным продуктом служит диоксифенилаланин (ДОФА). Однако гидроксилирование тирозина в клетках различных типов катализируется различными ферментами:
- Тиразиназа (Cu-зависимый фермент)
- Тирозингидроксилаза (1)
- ДОФА – декарбоксилаза (2)
- дофамингидроксилаза (3)
- фенилэтаноламин-N-метилтрансфераза (4)
дофамин и норадреналин служат медиаторами в синаптической передаче нервных импульсов, а адреналин – гормон широкого спектра действия, регулирующий энергетический обмен. Одна из функций катехоламинов – регуляция деятельности ССС.

В нервных клетках декарбоксилирование глутамата (отщепление а-карбоксильной группы) приводит к образованию γ-Аминомасляной кислоты(ГАМК), которая служит основным тормозным медиатором высших отделов мозга. Содержание ГАМК в головном мозге в десятки раз выше других нейромедиаторов. Она увеличивает проницаемость постсинаптическизх мембран для ионов К+, что вызывает торможение нервного импульса, повышает дыхательную активность нервной ткани, улучшает кровоснабжение головного мозга.

Функции аминов:
Амины, образовавшиеся при декарбоксилировании аминокислот, часто являются биологически активными веществами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.).
Вопрос № 26
Вопрос № 27
Реакция активация метионина
Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина. Аденозин образуется при гидролизе АТФ (см. схему А).
Эту реакцию катализирует фермент метионин аденозилтрансфераза, присутствующий во всех типах клеток. Структура (-S+-CH3) в SAM - нестабильная группировка, определяющая высокую активность метильной группы (отсюда термин "активный метионин"). Эта реакция уникальна для биологических систем, так как, по-видимому, является единственной известной реакцией, в результате которой освобождаются все три фосфатных остатка АТФ.
Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAГ). 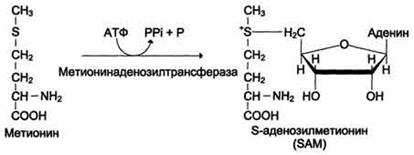
Вопрос № 28
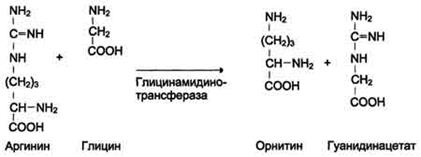
Синтез креатина
Креатин необходим для образования в мышцах высокоэнергетического соединения - кре-атинфосфата. Синтез креатина идёт в 2 стадии с участием 3 аминокислот: аргинина, глицина и метионина. В почках образуется гуанидинацетат при действии глицинамидинотрансферазы
Затем гуанидинацетат транспортируется в печень, где происходит реакция его метилирования
Креатин с кровотоком переносится в мышцы и клетки мозга, где из него образуется высокоэнергетическое соединение - креатинфосфат.
Эта реакция легко обратима и катализируется ферментом креатинкиназой. Фермент локализован в цитозоле и митохондриях клеток, обладает органоспецифичностью. В норме активность его в крови очень мала. Обнаружено три изоферментные формы креатинкиназы (см. раздел 2).
Креатинфосфат играет важную роль в обеспечении энергией работающей мышцы в начальный период. В результате неферментативного дефосфорилирования, главным образом в мышцах, креатинфосфат превращается в креатинин, выводимый с мочой. Суточное выделение кре-атинина у каждого индивидуума постоянно и пропорционально общей мышечной массе

Вопрос № 29 (ребят..ну эээ….ну в общем как-то так, если вдруг на меня снизойдет озарение, то количество инфы возрастет)
Вопрос № 30
Роль серина и глицина в образовании одноуглеродных групп.
Образование и использование
одноуглеродных фрагментов
Особое значение реакций катаболизма серина и глицина заключается в том, что они сопровождаются образованием одноуглеродного метиленового фрагмента (-СН2-). Метиленовая группа в молекуле метилен- Н4-фолата может превращаться в другие одноуглеродные группы (фрагменты): метенильную (-СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (-CH=NH) (рис. 9-25).
Ещё один источник формального и форми-мино-фрагментов - гистидин. Катаболизм гистидина происходит только в печени (очень небольшой процент в коже) в результате следующих реакций (см. схему на с. 498).
Конечными продуктами катаболизма гистидина являются глутамат, NH3 и одноуглеродные фрагменты - формимино-Н4-фолат и формил-Н4-фолат.
Все образующиеся производные Н4-фолата играют роль промежуточных переносчиков и служат донорами одноуглеродных фрагментов при синтезе некоторых соединений: пуриновых оснований и тимидиловой кислоты (необходимых для синтеза ДНК и РНК), регенерации метионина, синтезе различных формиминопроизводных (формиминоглицина и т.д.)
Перенос одноуглеродных фрагментов к акцептору необходим не только для синтеза ряда соединений, но и для регенерации свободного Н4-фолата в печени.
31. Тетрагидрофолиевая кислота, роль в синтезе и использовании одноуглеродных радикалов. Метилирование гомоцистеина
Ферменты, коферментами которых служат производные фолиевой кислоты играют большую роль в превращениях серина и глицина. Фолиевая кислота – это витамин В9.
- Фолиевая кислота

Коферментную функцию выполняет восстановленная форма фолата – тгфк(или Н4-фолат):
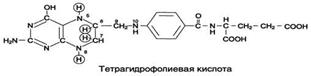
Фолиевая кислота в печени превращается в Н4-фолат в несколько стадий с участием ферментов фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит NADPH.
Особое значение реакций катаболизма серина и глицина заключается в том, что они сопровождаются образованием одноуглеродного метиленового фрагмента (-СН2-), переносчиком которого и является тгфк.
(реакции чисто для наглядности):


Метиленовая группа в молекуле метилен- Н4-фолата может превращаться в другие одноуглеродные группы (фрагменты): метенильную (-СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (-CH=NH)
Таким образом главная роль тгфк - перенос одноуглеродных фрагментов. Они также могут использоваться в дальнейшем для синтеза некоторых соединений: пуриновых оснований и тимидиловой кислоты (необходимых для синтеза ДНК и РНК).
Собственно куда именно присоединяется:

Реакции метилирования играют важную роль в организме и протекают очень интенсивно. Это вызывает большой расход метионина, так как он является незаменимой аминокислотой (в клетках метионин синтезироваться не может). Метионин - незаменимая аминокислота. Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина.

Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT).
S-аденозилгомоцистеин при действии гидролазы расщепляется на аденозин и гомоцистеин.
S-аденозилгомоцистеин + Н2О → Аденозин + Гомоцистеин
Гомоцистеин может снова превращаться в метионин под действием гомоцистеинметилтранс феразы. Донором метильной группы в этом слу чае служит N5-метил-Н4-фолат.
Метилирование гомоцистеина:
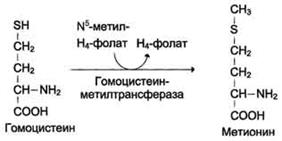
Метионин - незаменимая аминокислота, однако может регенерироваться из гомоцистеина. Следовательно, незаменим именно гомоцистеин, но единственным его источником в организме служит метионин. В пище гомоцистеина крайне мало, поэтому потребности человека в метиони-не и гомоцистеине обеспечиваются только метионином пищи.
Вопрос 32 Недостаточность фолиевой кислоты и витамина В12. Антивитамины фолиевой кислоты. Механизм действия сульфаниламидных препаратов.
Гиповитаминоз фолиевой кислоты приводит к нарушению обмена одноуглеродных фрагментов.
Первое проявление дефицита фолиевой кислоты - мегалобластная (макроцитарная) анемия. Она характеризуется уменьшением количества эритроцитов, снижением содержания в них гемоглобина, что вызывает увеличение размера эритроцитов. Причина этих симптомов - нарушение синтеза ДНК и РНК из-за недостатка их предшественников - тимидиловой кислоты и пуриновых нуклеотидов вследствие дефицита производных Н4-фолата. Клетки кроветворной ткани быстро делятся, поэтому они в первую очередь реагируют на нарушение синтеза нуклеиновых кислот снижением скорости эритропоэза.
Мегалобластная анемия возникает чаще всего в результате недостаточности фолиевой кислоты и/или витамина В12.
Антивитамины фолиевой кислоты:

Фолиевая кислота является витамином для человека и животных. Однако многие патогенные бактерии способны синтезировать это соединение, используя парааминобензойную кислоту (ПАБК) - одну из составных частей фолата. ПАБК поступает в бактериальные клетки из внешней среды. Сульфаниламидные лекарственные препараты - производные сульфаниламида (белого стрептоцида), похожи по строению на парааминобензойную кислоту. Отличаются они только радикалами.
Эти препараты подавляют синтез фолиевой кислоты у бактерий, потому что:
конкурентно ингибируют бактериальные ферменты синтеза фолата, так как являются структурными аналогами парааминобензойной кислоты - одного из субстратов процесса;
могут использоваться как псевдосубстраты из-за относительной субстратной специфичности ферментов, в результате чего синтезируется соединение, похожее на фолиевую кислоту, но не выполняющее её функции.
В обоих случаях в клетках бактерий нарушается обмен одноуглеродных фрагментов и, следовательно, синтез нуклеиновых кислот, что вызывает прекращение размножения бактерий.
В клетках больного сульфаниламидные лекарственные вещества не вызывают подобных изменений, поскольку человек получает с пищей готовую фолиевую кислоту.
Альбинизм
Причина метаболического нарушения - врождённый дефект тирозиназы. Этот фермент катализирует превращение тирозина в ДОФА в меланоцитах. В результате дефекта тирозиназы нарушается синтез пигментов меланинов.
Клиническое проявление альбинизма (от лат. albus - белый) - отсутствие пигментации кожи и волос. У больных часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких больных под открытым солнцем приводит к раку кожи. Частота заболевания 1:20 000.
Нарушение синтеза катехоламинов может вызывать различные нервно-психические заболевания, причём патологические отклонения наблюдаются как при снижении, так и при увеличении их количества.
Образование дигидрооротата
У млекопитающих ключевой, регуляторной реакцией в синтезе пирймидиновых нуклеотидов является синтез карбамоилфосфата из глутамина, СО2 и АТФ, в реакции катализируемой кар-бамоилфосфатсинтетазой II (КФС II), которая протекает в цитозоле клеток (рис. 10-12). В реакции NH2-гpyппa карбамоилфосфата образуется за счёт амидной группы глутамина.
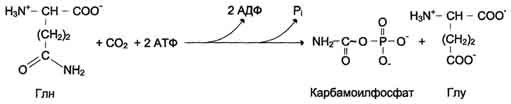
Рис. 10-12. Синтез карбамоилфосфата.
Карбамоилфосфат, использующийся на образование пирймидиновых нуклеотидов, является продуктом полифункционального фермента, который наряду с активностью КФС II содержит каталитические центры аспартаттранскарбамоилазы и дигидрооротазы. Этот фермент назвали "КАД-фермент". Объединение первых трёх ферментов метаболического пути в единый полифункциональный комплекс позволяет использовать почти весь синтезированный в первой реакции карбамоилфос-фат на взаимодействие с аспартатом и образование карбамоиласпартата, от которого отщепляется вода и образуется циклический продукт - дигидрооротат (рис. 10-13).

Рис. 10-13. Биосинтез УМФ de novo.
Отщепляясь от КАД-фермента, дигидрооротат подвергается дегидрированию NAD-зависимой дигидрооротатдегидрогеназой и превращается в свободное пиримидиновое основание - оротовую кислоту, или оротат.
Образование УМФ
В цитозоле оротат становится субстратом бифункционального фермента - УМФ-синтазы, которая обнаруживает оротатфосфорибозилтранс-феразную и ОМФ-декарбоксилазную активности. Первоначально фосфорибозильный остаток от ФРДФ переносится на оротат и образуется нук-леотид - оротидин-5'-монофосфат (ОМФ), декарбоксилирование которого даёт уридин-5-монофосфат (УМФ).
Таким образом, шесть последовательных реакций синтеза пиримидиновых нуклеотидов осуществляются тремя ферментами, которые кодируются в геноме человека тремя различными структурными генами.
Рис. 10-14. Синтез ЦТФ из УТФ.
"Запасные" пути синтеза пиримидиновых нуклеотидов
Использование пиримидиновых оснований и нуклеозидов в реакциях реутилизации препятствует катаболизму этих соединений до конечных продуктов с расщеплением пиримидинового кольца. В ресинтезе пиримидинов участвуют некоторые ферменты катаболизма нуклеотидов. Так, уридинфосфорилаза в обратимой реакции может рибозилироватъ урацил с образованием уридина.
Урацил + Рибозо-1-фосфат → Уридин + Н3РО4.
Превращение нуклеозидов в нуклеотиды катализирует уридин-цитидинкиназа.
Часть ЦМФ может превращаться в УМФ под действием цитидиндезаминазы и пополнять запасы уридиловых нуклеотидов.
ЦМФ + Н2О → УМФ + NH3.
Рис. 10-18. Синтез дТМФ из дУМФ.
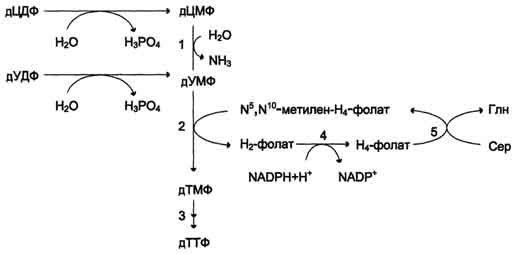
Рис. 10-19. Образование ТТФ из дЦДФ и дУДФ. 1 - дЦМФ дезаминаза; 2 -тимидилатсинтаза; 3 - дНМФ- и дНДФ 4 - дигидрофолатредуктаза; 5 - серингидроксиметилтрансфераза.
Тимидинкиназа катализирует следующую реакцию:
Тимидин + АТФ → дТМФ + АДФ.
Дезоксицитидинкиназа катализирует следующую реакцию:
Дезоксицитидин + АТФ → дЦМФ + АДФ.
54. Применение ингибиторов синтеза дезоксирибонуклеотидов для лечения злокачественных опухолей.(тут я мало что нашел…)
Препараты этой группы являются антагонистами естественных метаболитов. При наличии опухолевых заболеваний используют в основном следующие вещества (см. структуры).
Антагонисты фолиевой кислоты: Метотрексат (аметоптерин).
Антагонисты пурина: Меркаптопурин (леупурин, пуринетол).
Антагонисты пиримидина: Фторурацил (флуороурацил); Фторафур (тегафур); Цитарабин (цитозар).

Рисунок 11.Химические структуры ряда метаболитов и их антиметаболитов.
Химически антиметаболиты лишь похожи на естественные метаболиты, но не идентичны им. В связи с этим они вызывают нарушение синтеза нуклеиновых кислот.
Это отрицательно сказывается на процессе деления опухолевых клеток и приводит их к гибели.
Действуют антиметаболиты на разных этапах синтеза нуклеиновых кислот, ингибируя ферменты их синтеза. Так, механизм антибластомного эффекта метотрексата, очевидно, заключается в том, что он угнетает дигидрофолатредуктазу, а также тимидил-синтетазу. Это нарушает образование пуринов и тимидина, в результате чего угнетается синтез ДНК. Меркаптопурин, по-видимому, препятствует включению пуринов в полинуклеотиды. Полагают, что фторурацил нарушает синтез нуклеотидов или тимидина и их включение в ДНК. Имеются данные о том, что в клетках опухоли фторурацил превращается в 5-фтор-2-дезокси-уридин-5-монофосфат, который является ингибитором фермента тимидил-синтетазы.
Оротацидурия
Это единственное нарушение синтеза пиримидинов de novo. Оно вызвано снижением активности УМФ-синтазы, которая катализирует образование и декарбоксилирование ОМФ. Поскольку в эмбриогенезе от образования пиримидинов de novo зависит обеспечение синтеза ДНК субстратами, то жизнь плода невозможна при полном отсутствии активности этого фермента. Действительно, у всех пациентов с оротацидурией отмечают заметную, хотя и очень низкую активность УМФ-синтазы. Установлено, что содержание оротовои кислоты в моче пациентов (1 г/сут и более) значительно превосходит количество оротата, которое ежедневно синтезируется в норме (около 600 мг/сут). Снижение синтеза пиримидиновых нуклеотидов, наблюдающееся при этой патологии, нарушает регуляцию КАД-фермента по механизму ретроингибирования, из-за чего возникает гиперпродукция оротата.
Клинически наиболее характерное следствие оротацидурии - мегалобластная анемия, вызванная неспособностью организма обеспечить нормальную скорость деления клеток эритроцитарного ряда. Её диагностируют у детей на том основании, что она не поддаётся лечению препаратами фолиевой кислоты.
Недостаточность синтеза пиримидиновых нуклеотидов сказывается на интеллектуальном развитии, двигательной способности и сопровождается нарушениями работы сердца и ЖКТ. Нарушается формирование иммунной системы, и наблюдается повышенная чувствительность к различным инфекциям.
Гиперэкскреция оротовои кислоты сопровождается нарушениями со стороны мочевыводя-щей системы и образованием камней. При отсутствии лечения больные обычно погибают в первые годы жизни. При этом оротовая кислота не оказывает токсического эффекта. Многочисленные нарушения в работе разных систем организма вызваны "пиримидиновым голодом".
Для лечения этой болезни применяют уридин (от 0,5 до 1 г/сут), который по "запасному" пути превращается в УМФ.
Уридин + АТФ → УМФ + АДФ.
Нагрузка уридином устраняет "пиримидиновый голод", а поскольку из УМФ могут синтезироваться все остальные нуклеотиды пиримидинового ряда, то снижается выделение оротовои кислоты из-за восстановления механизма ретроингибирования КАД-фермента. Для больных оротацидурией лечение уридином продолжается в течение всей жизни, и этот нуклеозид становится для них незаменимым пищевым фактором.
Кроме генетически обусловленных причин, оротацидурия может наблюдаться:
- при гипераммониемии, вызванной дефектом любого из ферментов орнитинового цикла,
- за исключением карбамоилфосфат- синтетазы I. В этом случае карбамоилфосфат, синтезированный в митохондриях, выходит в цитозоль клеток и начинает использоваться на образование пиримидиновых нуклеотидов. Концентрация всех метаболитов, в том числе и оротовой кислоты, повышается. Наиболее значительная экскреция оротата отмечается при недостаточности орнитинкарбамоилтрансферазы (второго фермента орнитинового цикла);
- в процессе лечения подагры аллопуринолом, который превращается в оксипуринолмононуклеотид и становится сильным ингибитором УМФ-синтазы. Это приводит к накоплению оротовой кислоты в тканях и крови.
Ксантинурия – наследственная энзимопатия, связанная с дефектом ксантиноксидазы, что приводит к нарушению катаболизма пуринов до мочевой кислоты. В плазме крови и моче может наблюдаться 10-ти кратное снижение уровня мочевой кислоты, но увеличивается в 10 и более раз экскреция ксантина и гипоксантина. Основное клиническое проявление – образование ксантиновых конкрементов, величиной до нескольких миллиметров, коричневого цвета, сравнительно мягкой консистенции. Постепенно может развиться патология почек.
Гиперурикемия подагры
Когда в плазме крови концентрация мочевой кислоты превышает норму, то возникает гиперурикемия. Вследствие гиперурикемии может развиться подагра - заболевание, при котором кристаллы мочевой кислоты и уратов откладываются в суставных хрящах, синовиальной оболочке, подкожной клетчатке с образованием подагрических узлов, или тофусов. К характерным признакам подагры относят повторяющиеся приступы острого воспаления суставов (чаще всего мелких) - так называемого острого подагрического артрита. Заболевание может прогрессировать в хронический подагрический артрит.
Поскольку лейкоциты фагоцитируют кристаллы уратов, то причиной воспаления является разрушение лизосомальных мембран лейкоцитов кристаллами мочевой кислоты. Освободившиеся лизосомальные ферменты выходят в иитозоль и разрушают клетки, а продукты клеточного катаболизма вызывают воспаление.
Общий фонд сывороточных уратов в норме составляет ~ 1,2 г у мужчин и 0,6 г у женщин. При подагре без образования тофусов (т.е. подагрических узлов, в которых накапливаются ураты натрия и мочевая кислота) количество уратов возрастает до 2-4 г, а у пациентов с тяжёлой формой болезни, сопровождающейся ростом тофусов, может достигать 30 г.
Подагра - распространённое заболевание, в разных странах ею страдают от 0,3 до 1,7% населения. А поскольку сывороточный фонд уратов у мужчин в 2 раза больше, чем у женщин, то они и болеют в 20 раз чаще, чем женщины.
Как правило, подагра генетически детерминирована и носит семейный характер. Она вызвана нарушениями в работе ФРДФ синтетазы или ферментов "запасного" пути: гипоксантин-гуанин- или аденинфосфорибозилтрансфераз.
К другим характерным проявлениям подагры относят нефропатию, при которой наблюдают образование уратных камней в мочевыводящих путях.
Полиморфные варианты ФРДФ синтетазы
Активность ФРДФ синтетазы, катализирующей образование ФРДФ, строго контролируется пуриновыми нуклеотидами. Мутации в гене ФРДФ синтетазы привели к появлению полиморфных вариантов фермента, которые характеризуются аномальным ответом на обычные регуляторные факторы: концентрацию рибозо-5-фосфата и пуриннуклеотидов. Как правило, наблюдается суперактивация фермента. Пуриновые нуклеотиды синтезируются со скоростью, почти независимой от нужд клетки. Это вызывает ингибирование запасных "путей спасения", усиление катаболизма избыточного количества нуклеотидов, повышение продукции мочевой кислоты, гиперурикемию и подагру (табл. 10-1).
Примерно у 40% больных одной из форм гликогеноза - болезнью Гирке (недостаточностью глюкозо-6-фосфатазы) сопутствующей патологией является подагра. Снижение способности печени секретировать глюкозу в кровь увеличивает использование глюкозо-6-фосфата в пентозофосфатном пути. Образуются большие количества рибозо-5-фосфата, которые могут стимулировать избыточный синтез, а следовательно, и катаболизм пуриновых нуклеотидов.
57.строение нуклеиновых кислот, связи, формирующие первичную структуру нуклеиновых кислот. Видовая специфичность первичной структуры нуклеиновых кислот.
Строение:
Полимерные формы нуклеиновых кислот называют полинуклеотидами. Цепочки из нуклеотидов соединяются через остаток фосфорной кислоты (фосфодиэфирная связь). Поскольку в нуклеотидах существует только два типа гетероциклических молекул, рибоза и дезоксирибоза, то и имеется лишь два вида нуклеиновых кислот — дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК).
Мономерные формы также встречаются в клетках и играют важную роль в процессах передачи сигналов или запасании энергии. Наиболее известный мономер РНК — АТФ, аденозинтрифосфорная кислота, важнейший аккумулятор энергии в клетке.
Под первичной структурой нуклеиновых кислот понимают порядок, последовательность расположения мононуклеотидов в полинуклеотидной цепи ДНК и РНК. Такая цепь стабилизируется 3',5'-фосфодиэфирными связями. во всех нуклеиновых кислотах (точнее, в одноцепочечной нуклеиновой кислоте) имеется один и тот же тип связи – 3',5'-фосфодиэфирная связь между соседними нуклеотидами. Нуклеиновые кислоты, как и белки, обладают видовой специфичностью, то есть организмам каждого вида присущ свой тип ДНК.
Динамическое состояние белков в организме.Катепсины.
С обменом белков и аминокислот неразрывно связано понятие азотистого баланса (АБ), под которым понимают разницу между количеством азота, введенного в организм с пищей (Nввед) и количеством азота, выведенного из организма (Nвывед) в виде конечных продуктов азотистого обмена.
Динамическое состояние белка в организме - изменение белкового состава без нарушения функции.Оно мб:
1)Равновесное(равновесный АБ)- скорость катаболизма=скорость анаболизма
2)Положительное-скорость анаболизма больше(у детей и во время восстановления организма после заболевания)
3)Отрицательное-скорость катаболизма больше(у пожилых людей, при голодании, при онкологических заболеваниях)
КАТЕПСИНЫ(от греч. kathepso — перевариваю), протеолитич. ферменты из группы эндопептидаз. Локализованы в лизосомах клеток животных. Осуществляют внутриклеточное переваривание белков. По строению активного участка катепсины разделяют на цистеиновые, сериновые и аспартатные протеазы. Наиболее многочисленны катепсины, содержащие в своём активном сайте цистеин: это катепсины B, C, H, F, L, K, O, S, V/L2, X, W. К сериновым протеазам относятся катепсины A и G, к аспартатным — D и E.
Оптимальный pH для действия катепсинов =3.8. Их активность растёт в опухолевых клетках. Катепсины группы В — трипсиноподобные; группы D — действуют подобно п