

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Интересное:
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Дисциплины:
|
из
5.00
|
Заказать работу |
Электролитами называют вещества или системы, содержащие в заметных количествах ионы и обладающие ионной проводимостью. При термодинамическом описании растворов электролитов практически всегда используют метод активностей. Это связано с тем, что в этих растворах наблюдаются более значительные отклонения от идеальности, чем в случае неэлектролитов, за счет электростатических взаимодействий и большего (по сравнению с раствором неэлектролита той же концентрации) числа частиц.
Рассмотрим бинарный электролит, при диссоциации которого образуются ν+ катионов и ν– анионов:
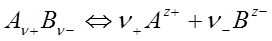 . (28)
. (28)
В соответствии со свойством аддитивности, химический потенциал электролита можно представить в виде суммы химических потенциалов ионов:
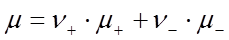 , (29)
, (29)
которые записываются по аналогии с химическим потенциалом компонента раствора как
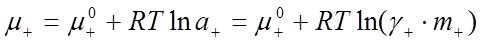 , (30)
, (30)
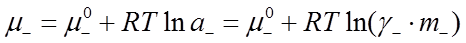 , (31)
, (31)
где 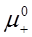 и
и 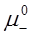 – стандартные химические потенциалы; γ+ и γ- – коэффициенты активности катиона и аниона.
– стандартные химические потенциалы; γ+ и γ- – коэффициенты активности катиона и аниона.
Подставим уравнения (30), (31) в выражение для химического потенциала электролита (29):
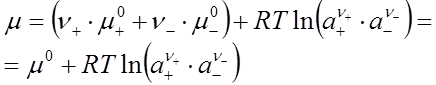 (32)
(32)
Выражение, стоящее в скобках, есть активность электролита в целом, т.е.
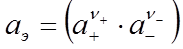 . (33)
. (33)
Вследствие электронейтральности экспериментально определить отдельно активности катиона и аниона невозможно, поэтому вводят понятие средней ионной активности 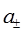 :
:
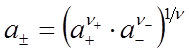 , (34)
, (34)
где 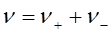 . Аналогично, средний ионный коэффициент активности
. Аналогично, средний ионный коэффициент активности 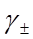 и средняя ионная моляльность
и средняя ионная моляльность 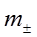 равны
равны
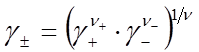 , (35)
, (35)
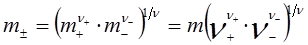 . (36)
. (36)
С учетом этого химический потенциал электролита записывается в виде
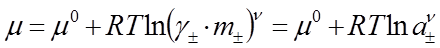 . (37)
. (37)
Активность электролита равна
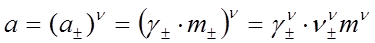 . (38)
. (38)
Для оценки численных значений коэффициентов активности в разбавленных растворах сильных электролитов используют различные приближения теории Дебая-Хюккеля. В основу теории положено представление о существовании ионной атмосферы. Ионная атмосфера – некоторое усредненное распределение ионов, возникающее вокруг каждого иона, называемого центральным, под влиянием двух факторов: электростатических взаимодействий, которые стремятся упорядочить ионы, и теплового движения, стремящегося расположить их хаотически. В отсутствие внешнего электрического поля ионная атмосфера имеет шаровую симметрию, а ее заряд равен по величине и противоположен по знаку заряду центрального иона.

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!