С помощью программы Maple (см. Прил. 6) постройте угловые диаграммы плотности вероятности 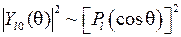 для состояний с квантовыми числами
для состояний с квантовыми числами 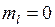 и l, указанным преподавателем.
и l, указанным преподавателем.
Контрольные вопросы
1. Изложите постулаты Бора и сформулируйте модель Бора атома водорода.
2. Выведите значения энергии стационарных состояний из постулатов Бора.
3. По каким траекториям происходит движение электрона в атоме водорода в модели Бора-Зоммерфельда?
4. Перечислите квантовые числа электрона в водородоподобном атоме.
4. Нарисуйте и объясните схему энергетических уровней атома водорода с указанием квантовых чисел n и l. Покажите на схеме образование серий Бальмера, Лаймана и других в спектре атома водорода.
5. Расскажите о волновой функции и ее физическом смысле. Напишите стационарное уравнение Шредингера и объясните смысл входящих в него величин.
6. Расскажите о свойствах решений уравнения Шредингера для атома водорода и волновых функциях, называемых атомными орбиталями.
Лабораторная работа № 6.
Серии в спектре натрия
Цель работы: изучение свойств (структуры спектра и уровней энергии) многоэлектронных атомов с одним внешним электроном на примере атома натрия.
Приборы и принадлежности: универсальный монохроматор УМ-2, дуговая натриевая лампа высокого давления типа ДНаТ-70, люминесцентная ртутная лампа мощностью 11 Вт фирмы R & C, неоновая лампа, фотопластинки со спектрами поглощения атома натрия и излучения атомов натрия и ртути, их электронные или бумажные копии.
Меры предосторожности: Натриевая и ртутная лампа находятся в металлических корпусах с небольшими окошками. Корпуса закреплены на рейтерах, способных свободно перемещаться вдоль оптической скамьи (длинной прямолинейной станины специального сечения) или жестко закрепляться на ней. При перемещении ламп их следует держать только за рейтеры. После установки в нужное положение рейтер с лампой следует закрепить винтом. Для устранения отвлекающего (слегка слепящего) действия прямого излучения натриевой лампы во время измерений рекомендуется пользоваться защитным экраном. Ультрафиолетовое излучение натриевой лампы очень незначительно, практически отсутствует. Применяемая в работе ртутная лампа имеет малую потребляемую мощность, не требует специальной пускорегулирующей аппаратуры, не дает ультрафиолетового излучения, она безопасна, возможности непредусмотренного взрыва из-за высокого давления исключена.
Свойства и спектр натрия
Натрий – легкоплавкий металл с температурой плавления 98°С. Спектр поглощения атомов натрия наблюдается при освещении его паров водородной лампой со сплошным спектром излучения в ультрафиолетовой области. Пример сплошного спектра молекулярного водорода имеется на рис. 5.3. Излучение атомов натрия можно увидеть, внеся крупинки поваренной соли NaCl в слабоокрашенное пламя газовой горелки, спиртовки или таблетки сухого горючего. Интенсивное желтое окрашивание обусловлено излучением характерной желтой спектральной линии с длиной волны  589.3 нм, называемой резонансной линией. В спектроскопии для получения спектра излучения натрия используются дуговые лампы низкого давления ДНас-18 или безэлектродные шариковые лампы высокочастотного разряда.
589.3 нм, называемой резонансной линией. В спектроскопии для получения спектра излучения натрия используются дуговые лампы низкого давления ДНас-18 или безэлектродные шариковые лампы высокочастотного разряда.
В видимой, ближней ультрафиолетовой и инфракрасной областях спектра линии излучения натрия образуют три серии: главную, резкую и диффузную (см. рис. 6.1а). По известным энергиям фотонов
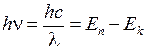 , (6.1)
, (6.1)
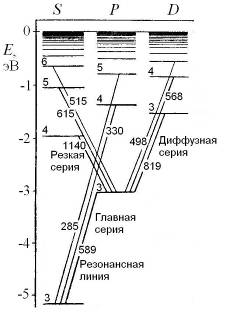
где 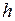 – постоянная Планка, с - скорость света, можно построить схему энергетических уровней атома натрия (см. рис. 6.1б).
– постоянная Планка, с - скорость света, можно построить схему энергетических уровней атома натрия (см. рис. 6.1б).

а б
Рис. 6.1. а) Спектральные серии атома натрия, границы серий показаны штриховкой; б) схема уровней атома натрия и переходы между ними, приводящие к образованию серий; рядом с переходами указаны длины волн излучения в нм
Главная серия спектра натрия расположена в видимой и ближней ультрафиолетовой областях. Она названа главной, потому что наблюдается при поглощении света парами натрия. В ближней инфракрасной и видимой областях расположены еще две перекрывающиеся серии линий, названные резкой и диффузной по виду линий, резкая серия состоит из резких линий, а диффузная – из размытых. Каждая из серий подобна серии Бальмера атома водорода (см. работу 5). В более дальней инфракрасной области имеется еще одна серия, практически совпадающая с серией Пашена атома водорода и поэтому названная фундаментальной.
У атомов натрия и других щелочных элементов (лития, калия, цезия и т.д.) низколежащие возбужденные состояния образуются при увеличении энергии внешнего валентного электрона, например, при поглощении им фотона или после неупругого столкновения с другим электроном при электрическом разряде. При переходах валентного электрона на нижележащие уровни энергии испускаются фотоны, дающие линии спектра излучения. Поэтому валентный электрон называют также оптическим. Остальные электроны вместе с ядром образуют атомный остов. Электронная конфигурация – распределение одиннадцати электронов по состояниям в атоме натрия с учетом принципа Паули имеет вид:
Na 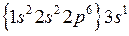 , (6.2)
, (6.2)
где 3s – основное состояние валентного электрона, а в фигурных скобках указана электронная конфигурация атомного остова, совпадающая с электронной конфигурацией соседнего по периодической системе Менделеева атома неона
Ne 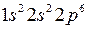 . (6.3)
. (6.3)
При увеличении энергии атома валентный электрон переходит на расположенные выше уровни: 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d, 5f, 5g и т.д. Здесь числа указывают значения главного квантового числа 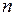 , а латинские буквы – значение азимутального (орбитального) квантового числа
, а латинские буквы – значение азимутального (орбитального) квантового числа 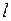 в соответствии с табл. 6.1.
в соответствии с табл. 6.1.
Таблица 6.1
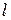
| 0
| 1
| 2
| 3
| 4
| …
|
| Обозначение
| s
| p
| d
| f
| g
| …
|
Четыре первых буквенных обозначения s, p, d, f присвоены по английским названиям серий спектра натрия: резкая – Sharp – s; главная – Principal – p; диффузная – Diffuse – d; фундаментальная – Fundamental – f. Последующие буквы в табл. 2.1 присвоены по алфавиту.
Потенциальная энергия взаимодействия оптического электрона с атомным остовом, имеющим полный электрический заряд 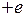 , отличается от простого выражения (5.4) для атома водорода и может быть приближенно записана в виде
, отличается от простого выражения (5.4) для атома водорода и может быть приближенно записана в виде
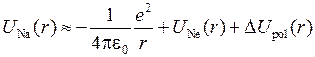 , (6.4)
, (6.4)
где 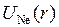 − потенциальная энергия электрона в поле атома неона, а
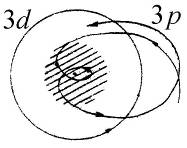
− потенциальная энергия электрона в поле атома неона, а 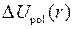 − поправка, учитывающая поляризацию остова под действием электрического поля электрона (см. работу 8). Качественное сравнение атома натрия с атомом водорода можно сделать в модели Бора-Зоммерфельда – из-за различия потенциальных энергий (5.4) и (6.4) электрона различны и его траектории (см. рис. 6.2 и 5.2).
− поправка, учитывающая поляризацию остова под действием электрического поля электрона (см. работу 8). Качественное сравнение атома натрия с атомом водорода можно сделать в модели Бора-Зоммерфельда – из-за различия потенциальных энергий (5.4) и (6.4) электрона различны и его траектории (см. рис. 6.2 и 5.2).
| Рис. 6.2. Качественная картина двух классических траекторий электрона в поле атомного остова натрия (заштрихован)
| 
|
При этом сильнее по сравнению с водородом изменяются проникающие в атомный остов траектории электронов с меньшим моментом импульса (например, соответствующие состоянию 3s, 3р). Для круговых траекторий, проходящих вдали от атомного остова (например, соответствующих состоянию 3d) второе и третье слагаемые в формуле (6.4) малы по сравнению с первым. Поэтому отличие по сравнению с атомом водорода незначительно и исчезает с ростом значений квантовых чисел 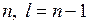 и радиуса орбиты.
и радиуса орбиты.
Квантовые расчеты приводят к зависимости энергии оптического электрона не только от главного квантового числа 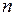 , но еще и от орбитального квантового числа
, но еще и от орбитального квантового числа 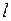 , см. рис. 6.1б. Вырождения уровней, имевшего место для водорода в силу формулы (5.3), уже нет. Это приводит к усложнению схемы энергетических уровней атома по сравнению с атомом водорода (см. рис. 6.1б), к увеличению числа спектральных серий и их перекрыванию (см. рис. 6.1а). Главная серия спектра поглощения натрия образуется при переходе электрона из основного состояния 3s в состояния
, см. рис. 6.1б. Вырождения уровней, имевшего место для водорода в силу формулы (5.3), уже нет. Это приводит к усложнению схемы энергетических уровней атома по сравнению с атомом водорода (см. рис. 6.1б), к увеличению числа спектральных серий и их перекрыванию (см. рис. 6.1а). Главная серия спектра поглощения натрия образуется при переходе электрона из основного состояния 3s в состояния 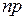 с азимутальным (орбитальным) квантовым числом
с азимутальным (орбитальным) квантовым числом 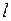 =1 и главными квантовыми числами
=1 и главными квантовыми числами 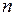 =3,4,… Линии излучения главной серии образуются при обратных переходах. Диффузная серия, состоящая из размытых линий (причина этого объясняется в работе 9), образуется при переходе внешнего электрона из нескольких d-состояний в состояние 3р, см рис. 6.1б. Уровни энергии удаленных от атомного остова d-состояний электрона мало отличаются от соответствующих энергий электрона в атоме водорода
=3,4,… Линии излучения главной серии образуются при обратных переходах. Диффузная серия, состоящая из размытых линий (причина этого объясняется в работе 9), образуется при переходе внешнего электрона из нескольких d-состояний в состояние 3р, см рис. 6.1б. Уровни энергии удаленных от атомного остова d-состояний электрона мало отличаются от соответствующих энергий электрона в атоме водорода
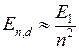 , (6.5)
, (6.5)
где 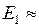 13,6 эВ − модуль энергии основного состояния атома водорода. Энергии квантов диффузной серии образуют набор
13,6 эВ − модуль энергии основного состояния атома водорода. Энергии квантов диффузной серии образуют набор
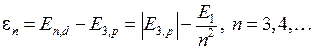 , (6.6)
, (6.6)
отличающийся на постоянное слагаемое 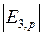 от энергий квантов серии Бальмера (см. работу 5)
от энергий квантов серии Бальмера (см. работу 5)
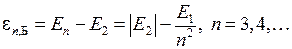 . ,
. , 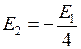 . (6.7)
. (6.7)
Это позволяет отделить линии диффузной серии от линий резкой серии.
Энергии состояний nр представляют в виде, сходном с энергией в атоме водорода
 , (6.8)
, (6.8)
где величина 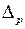 , нарушающая “совершенную” зависимость (5.3), называется ридберговской поправкой (или квантовым дефектом). Энергий состояний ns также представляют в виде, сходном с энергией в атоме водорода
, нарушающая “совершенную” зависимость (5.3), называется ридберговской поправкой (или квантовым дефектом). Энергий состояний ns также представляют в виде, сходном с энергией в атоме водорода
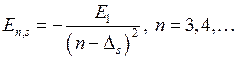 , (6.9)
, (6.9)
с квантовым дефектом 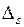 . Таким образом, длины волн линий диффузной серии можно представить в виде
. Таким образом, длины волн линий диффузной серии можно представить в виде
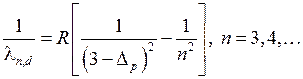 , (6.10)
, (6.10)
а резкой – в виде
 , (6.11)
, (6.11)
где R − постоянная Ридберга
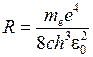 . (6.12)
. (6.12)
Целью данной работы является нахождение значений квантовых дефектов 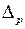 и
и 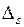 на основе измерений длин волн диффузной и главной серий.
на основе измерений длин волн диффузной и главной серий.



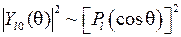 для состояний с квантовыми числами
для состояний с квантовыми числами 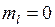 и l, указанным преподавателем.
и l, указанным преподавателем.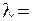 589.3 нм, называемой резонансной линией. В спектроскопии для получения спектра излучения натрия используются дуговые лампы низкого давления ДНас-18 или безэлектродные шариковые лампы высокочастотного разряда.
589.3 нм, называемой резонансной линией. В спектроскопии для получения спектра излучения натрия используются дуговые лампы низкого давления ДНас-18 или безэлектродные шариковые лампы высокочастотного разряда.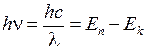 , (6.1)
, (6.1)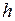 – постоянная Планка, с - скорость света, можно построить схему энергетических уровней атома натрия (см. рис. 6.1б).
– постоянная Планка, с - скорость света, можно построить схему энергетических уровней атома натрия (см. рис. 6.1б).

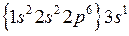 , (6.2)
, (6.2)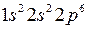 . (6.3)
. (6.3)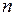 , а латинские буквы – значение азимутального (орбитального) квантового числа
, а латинские буквы – значение азимутального (орбитального) квантового числа 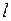 в соответствии с табл. 6.1.
в соответствии с табл. 6.1.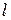
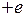 , отличается от простого выражения (5.4) для атома водорода и может быть приближенно записана в виде
, отличается от простого выражения (5.4) для атома водорода и может быть приближенно записана в виде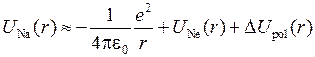 , (6.4)
, (6.4)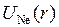 − потенциальная энергия электрона в поле атома неона, а
− потенциальная энергия электрона в поле атома неона, а 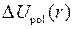 − поправка, учитывающая поляризацию остова под действием электрического поля электрона (см. работу 8). Качественное сравнение атома натрия с атомом водорода можно сделать в модели Бора-Зоммерфельда – из-за различия потенциальных энергий (5.4) и (6.4) электрона различны и его траектории (см. рис. 6.2 и 5.2).
− поправка, учитывающая поляризацию остова под действием электрического поля электрона (см. работу 8). Качественное сравнение атома натрия с атомом водорода можно сделать в модели Бора-Зоммерфельда – из-за различия потенциальных энергий (5.4) и (6.4) электрона различны и его траектории (см. рис. 6.2 и 5.2).
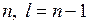 и радиуса орбиты.
и радиуса орбиты.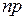 с азимутальным (орбитальным) квантовым числом
с азимутальным (орбитальным) квантовым числом 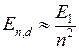 , (6.5)
, (6.5)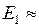 13,6 эВ − модуль энергии основного состояния атома водорода. Энергии квантов диффузной серии образуют набор
13,6 эВ − модуль энергии основного состояния атома водорода. Энергии квантов диффузной серии образуют набор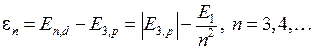 , (6.6)
, (6.6)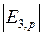 от энергий квантов серии Бальмера (см. работу 5)
от энергий квантов серии Бальмера (см. работу 5)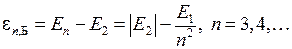 . ,
. , 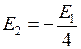 . (6.7)
. (6.7) , (6.8)
, (6.8)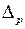 , нарушающая “совершенную” зависимость (5.3), называется ридберговской поправкой (или квантовым дефектом). Энергий состояний ns также представляют в виде, сходном с энергией в атоме водорода
, нарушающая “совершенную” зависимость (5.3), называется ридберговской поправкой (или квантовым дефектом). Энергий состояний ns также представляют в виде, сходном с энергией в атоме водорода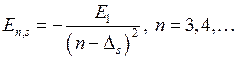 , (6.9)
, (6.9)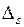 . Таким образом, длины волн линий диффузной серии можно представить в виде
. Таким образом, длины волн линий диффузной серии можно представить в виде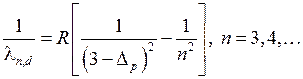 , (6.10)
, (6.10) , (6.11)
, (6.11)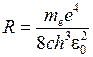 . (6.12)
. (6.12)

