Скачки потенциала возникают на границах: 1) Ме1 – Ме2 - контактный потенциал; 2) Ме – раствор – электрохимический потенциал; 3) раствор 1 – раствор 2 – диффузионный потенциал.
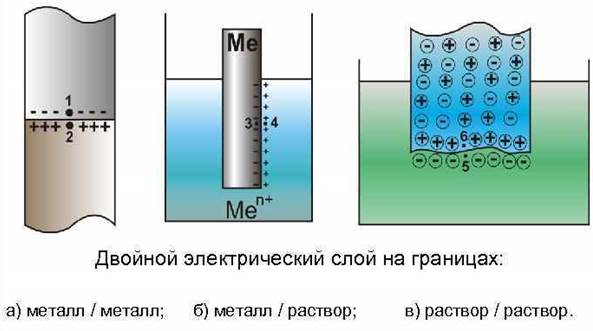
Между электродом и контактирующим с ним раствором электролита возникает разность электрических потенциалов (скачок потенциала), называемая электродным потенциалом. Возникновение его связано с протеканием на границе Ме – раствор равновесных электрохимических реакций.
Причины возникновения электрохимического потенциала:
Энергию, необходимую для отрыва иона от металла, обозначим UМе, выделяющуюся при сольватации (гидратации) иона в растворе через Uсольв. Энергия UМе зависит только от природы Ме, энергия Uсольв зависит от природы ионов, их активности в растворе и от природы растворителя.
Если металлическую пластинку (электрод) опустить в раствор своей соли, то в зависимости от соотношения UМе / Uсольв возможны различные начальные электродные процессы.
а) ТД условие образования отрицательного заряда на поверхности Ме:
энергия Uсольв > UМе; хим .потенциал μ Ме > μ раствора
ион переходит из Ме в раствор, Ме заряжается отрицательно
б) ТД условие образования положительного заряда на поверхности Ме:
энергия Uсольв < UМе; хим .потенциал μ Ме < μ раствора
ион переходит из раствора в Ме, Ме заряжается положительно.
По мере протекания рассматриваемых процессов на электроде будет изменяться соотношения UМе / Uсольв , и наступит такой момент, когда UМе = Uсольв, скорости обоих процессов выравниваются, устанавливается равновесие. Скачок потенциала – электродный потенциал достигает равновесного значения.
Отдавать свои катионы в раствор и заряжаться отрицательно способны только химически активные Ме, например, цинк, алюминий, железо. У малоактивных Ме, таких как медь, ртуть, серебро, ионы могут переходить в раствор в незначительных количествах. Поэтому при контакте этих Ме с растворами их солей преимущественно идет осаждение катионов из раствора на Ме. В результате Ме заряжается положительно, а раствор, в котором остались анионы, отрицательно.
Некоторые металлы (например, золото, платина, медь, серебро и др.) обладают настолько прочными кристаллическими решетками, что катионы из нее почти не могут выйти и перейти в раствор. Поэтому они практически не имеют собственного скачка потенциала. Но поверхность таких металлов может адсорбировать многие другие вещества, которые способны окисляться или восстанавливаться. Такие электроды (металлы) в этом случае называют инертными, а потенциал их определяется равновесием между окисленной и восстановленной формой веществ адсорбированных на их поверхности.
При условной записи электродов границу проводников I и II рода обозначают вертикальной чертой. Например, для медного электрода (медная пластина, опущенная в раствор соли меди) условная запись имеет вид:
Cu2+ | Cu,
Mez+ | Me
Вертикальная линия характеризует поверхность раздела между 2-мя фазами; слева указываются ионы, находящиеся в растворе – окисленная форма; справа – электродный материал – восстановленная форма.
Измерить абсолютное значение электродного потенциала, возникающего на границе металл – раствор, невозможно, так как для подключения измерительного прибора необходим второй металлический электрод, на котором при погружении в раствор сразу же образуется свой собственный двойной электрический слой, т. е. скачок потенциала. В этом случае измеряют только относительную величину потенциала по отношению к электроду, принятому за стандарт (электрод сравнения), при этом будет измерена разность потенциалов двух электродов, называемая электродвижущей силой (ЭДС) цепи.
Таким образом, электродным потенциалом называют ЭДС электрохимической цепи, составленной из стандартного и исследуемого электрода.
Обычно в качестве электрода сравнения используют стандартный водородный электрод, потенциал которого условно принят за нуль при всех температурах. Водородный электрод представляет платиновую пластину, покрытую тончайшим порошком платины (платиновой чернью), которая опущена в раствор с активностью ионов водорода ан+ = 1 (обычно 1 М раствор H2SO4) и омывается током чистого Н2 при нормальном давлении (101325 Па).
Электрохимическая схема стандартного электрода:
Pt , H 2 ( PH 2 = 1 атм ) | H 2 SO 4 ( a Н+ = 1 моль)
На водородном электроде протекает следующая реакция:
Н+ + е → ½ Н2
Условным потенциалом электрода называют ЭДС гальванического элемента, составленного из исследуемого электрода и стандартного водородного электрода при соблюдении условий:
-диффузионный потенциал отсутствует;
-водородный электрод размещается слева, исследуемый – справа;
-полурекция на исследуемом электроде записывается как реакция восстановления (такая реакция называемая потенциалопределяющей).
Условный потенциал электрода называют стандартным условным потенциалом, если активности всех участников электродной полурекции равны единице.
Значения стандартных электродных потенциалов (Ео) являются константой, свойственной каждому электроду, и приведено в справочных таблицах физико-химических величин при 25°С.
Относительно потенциала стандартного водородного электрода, принятого за нуль, все стандартные потенциалы металлических электродов будут или положительнее, или отрицательнее его.
Если расположить Ме в порядке возрастания значений их стандартных потенциалов, то получится ряд стандартных электродных потенциалов, или электрохимический ряд напряжений:
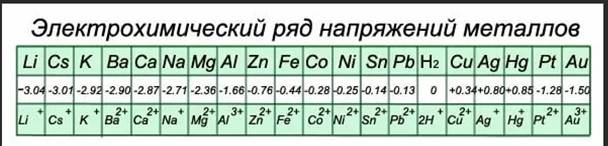
На практике водородный электрод используется редко, вместо него используют другие электроды сравнения, потенциалы которых предварительно точно определяют относительно водородного электрода.







