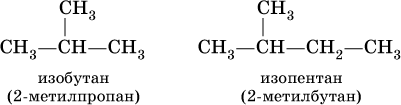Изомерия
Для алканов характерна изомерия углеродного скелета и пространственная (поворотная). Привести примеры структурных изомеров для гептана.
Атомы углерода могут свободно вращаться вокруг σ-связей. Конформациимолекулы = динамические изомеры, отличаются друг от друга пространственным расположением атомов .Конформации молекулы представляют собой различные ее геометрические формы, возникающие в результате вращения вокруг одинарных связей.
Метильные группы в углеводородах могут свободно вращаться вокруг соединяющих их одинарных связей. Для изображения конформаций используют проекционные формулы Ньюмена. Для их построения выбирается наиболее длинная связь(С-С 0,154 нм> C - H), относительно которой производится свободное вращение. Ближний атом углерода обозначается точкой - дальний кругом.
Н3С – СН3 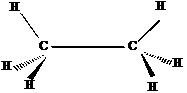
строение конфигурация
Атомы, образующие С—С связь строго проецируются друг на друга так, что мы видим ближайший к нам атом С и от него располагаем все связи к заместителям. Второй атом С как бы прикрыт кружком, идущие от этого атома связи, изображаются выступающими за кружок. При этом возникают два резко отличающихся типа конформеров.
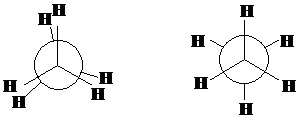
I II
I – конформации, в которых заместители как бы налагаются друг на друга или находятся друг относительно друга в наиболее близко положении, обладают самой высокой энергией и называются заслоненными.
II – заместители одного атома на проекции размещены между заместителями другого, деля валентные углы, т.е. заместители расположены наиболее далеко друг от друга в пространстве. Такиеконформеры обладают наименьшей энергией и называются заторможенными.
В пространстве алканы с большим, чем 2 атома углерода (пентан) имеют зигзагообразную форму, или клещевидную,или промежуточную.
Физические свойства.
При обычных условиях первые алканы – метан, этан, пропан и бутан (С1—С4) – представляют собой газы без цвета и запаха, малорастворимые в воде, хорошо в бензоле, четыреххлористом углероде.Последующие гомологи (С5—C15) – жидкости (при 20 °C), высшие гомологи (C16 и выше) – твердые вещества.
Химические свойства.
В молекулах алкановвсе атомы связаны между собой прочными σ-связями, а валентности углеродных атомов полностью насыщены водородом. Поэтому алканы при обычных условиях инертны: не взаимодействуют с ионными реагентами (кислотами, щелочами), окислителями, активными металлами (поэтому, например, металлический натрий можно хранить в керосине). По этой же причине предельные углеводороды в своё время получили название парафинов (от лат.Рarumaffinis - малое сродство). В практике парафинами называют твёрдые углеводороды, содержащиеся в нефтеи нефтепродуктах.
Основные химические превращения алканов идут только при сообщении им достаточно высокой энергии (за счёт нагревания или УФ- облучения). При этом может произойти разрыв связи С-Н с последующей заменой атома водорода на другой атом или группу атомов (реакции замещения), или же разрыв молекулы по связи С-С (реакции расщепления).
II. Реакции окисления.
В присутствии большого избытка кислорода (или воздуха) при высокой температуре алканы сгорают полностью до воды и диоксида углерода, например: CnH2n+2 + (3n+1)O2 → nCO2 + (n+1)H2O. Эта реакция используется для получения тепловой энергии.
Неполное окисление метана кислородом воздуха приводит к образованию смеси оксида углерода и водорода, называемой синтез-газом:
CH4 + 0,5O2→ CO + 2H2
Синтез-газ используют для получения многих органических продуктов. Окисление алканов кислородом воздуха в более мягких условиях приводит к получению смеси карбоновых кислот, спиртов, альдегидов, кетонов. Каталитическим окислением метана и продуктов его окисления можно получить метиловый спирт, формальдегид, муравьиную кислоту:
CH4 + O2→ H2CO +H2O
В процессе неполного окисления бутанаполучаются уксусный альдегид и уксусная кислота, этилацетат, этанол:
CH3- CH2- CH2 -CH3 + O2→ CH3-CHO + CH3- COOH + CH3- C O O -C2H5 + CH3CH2OH
Действие на организм.
УВ ряда метана вызывают C5-C8 умеренно раздражающее действие на дыхательные пути, обладаютсильным наркотическим действием, оказывают снотворный эффект.Высшие члены ряда более опасны при воздействии на кожные покровы, чем при ингаляции паров.
Тема2.1: «Углеводороды. Алканы»
План: 1. Определение. Химическое строение.
2.Номенклатура, изомерия, конформация.
3.Физические и химические свойства.
4. Природные источники алканов, медицинское применение.
5.Зависимость между строением и действием на организм.
1.Алканы (парафины) – это соединения углерода с водородом, в молекулах которых атомы углерода, находятся свсостояннии sp3гибридизации, соединены между собой одинарной связью (предельные углеводороды). Общая формула гомологического ряда алканов СnН2n+2. Первый представитель- метан- родоначальник гомологического ряда.
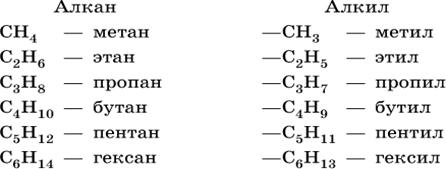
Каждый последующий алкан отличается от предыдущего на метеленовую группу-СН2–называемой гомологической разницей. Гомологи –вещества, имеющие сходное химическое строение, обладающие сходными химическими свойствами, но различающиеся по составу по числу группСН2.
Радикал, получающийся при отрыве одного атома водорода от молекулы предельного углеводорода, называетсяалкил, общая формула алкилов СnН2n+ 1
Атомы углерода, входящие в состав органических соединений, будут всегда четырехвалентны, имеют электронную конфигурацию 1s22s22р2 и могут находиться в трех валентных состояниях.
Первое валентное состояние атома углерода.
При образовании молекулы метана СН4 атом углерода из основного состояния переходит в возбужденное состояние и имеет четыре неспаренных электрона: один S и три р-электрона, которые и участвуют в образовании четырех связей с четырьмя атомами водорода. Однако, все связи в молекуле метана равноценны и направлены к вершине тетраэдра. Это объясняется тем, что при образовании молекулы метана ковалентные связи возникают за счет взаимодействия не «чистых», а так называемых гибридных, т. е. усредненных по форме и размерам, и по энергии орбиталей. Гибридизацией орбиталей называется процесс выравнивания их по форме и энергии. Число гибридныхорбиталей равно числу исходных орбиталей. По сравнению с ними гибридные орбитали более вытянуты в пространстве, что обеспечивает их более полное перекрывание с орбиталями соседних атомов. В молекулах алканах, а также во всехорганических молекулах по месту одинарной связи атомы углерода будут находиться в состоянии sр3-гибридизации, т. е. у атома углерода гибридизации подверглись орбитали одного s- и трех р-электронов и образовались четыре одинаковые гибридные орбитали.
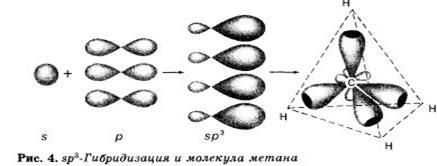
В результате перекрывания четырех гибридных sр3-орбиталей атома углерода и s орбиталей четырех атомов водорода образуется тетраэдрическая молекула метана с четырьмя одинаковыми σ -связями под углом 109°28'.
В молекуле алкановсуществует одинарная неполярная углерод-углеродная связь длиной 0,154 нм.
Второе валентное состояние атома. В гибридизацию вступают только три электронные орбитали: одна s в и две р, т. е. происходит sр2-гибридизация. Эти три орбитали располагаются в одной плоскости под углом 120° по отношению друг к другу. Три sp2-гибридные орбитали образуют три σ-связи. р-орбитали атомов углерода, которые не участвуют в гибридизации, будут перекрываться в двух областях, перпендикулярных плоскости молекулы («боковое перекрывание»), и образуют π-связь.
Однако «боковое» перекрывание р-орбиталей происходит в меньшей степени,поэтомуπ-связь будет менеепрочной, чемσ-связь.
Третье валентное состояние атома углерода. Происходит s р-гибридизация, в которой участвуют лишь две орбитали: одна s и одна р. Две гибридные орбитали ориентируются друг относительно друга под углом 180° и образуют две σ-связи, два р- электрона за счет бокового перекрывания будут образовывать две π-связи, расположенные во взаимно перпендикулярных плоскостях.
σ-связь - ковалентная связь, образованная при перекрывании S, P и гибридных А.О.(атомных орбиталей) вдоль оси, соединяющей ядра связываемых атомов.σ- связь – прочная, подвижная, первичная. Π- связь - ковалентная связь, возникающая при боковом перекрывании негибридных Р- А.О.Перекрывание происходит выше и ниже линии, соединяющей ядра атомов. Π- связи возникают междуатомами, уже соединенными σ- связью.Π- связь –непервичная, непрочная,подвижная.
Номенклатура. Правила современной номенклатуры были разработаны на XIX конгрессе Международного союза теоретической и прикладной химии в 1957 году. Эти правила известны под названием номенклатуры ИЮПАК (международный союз чистой и прикладной химии). Номенклатурные правила ИЮПАК предусматривают несколько вариантов образования названий органических соединений. Наиболее широко применяются заместительная и радикало-функциональная номенклатуры.
Заместительная номенклатура. Согласнозаместительной номенклатуре, органические соединения рассматривают как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на другие атомы или атомные группы.
Дадим определение основным понятиям: родоначальная структура, радикал, заместитель. Родоначальная структура — структурный фрагмент молекулы (молекулярный остов), лежащий в основе названия соединения: главная углеродная цепь атомов для ациклических соединений, цикл — для карбо- и гетероциклических.
 Радикал — остаток углеводорода, образующийся в результате удаления одного или нескольких атомов водорода. Свободную валентность в радикале обозначают черточкой. В зависимости от того, у какого атома углерода находится свободная валентность, различают первичные, вторичные и третичные радикалы:
Радикал — остаток углеводорода, образующийся в результате удаления одного или нескольких атомов водорода. Свободную валентность в радикале обозначают черточкой. В зависимости от того, у какого атома углерода находится свободная валентность, различают первичные, вторичные и третичные радикалы:
 Радикалами называют атомы или атомные группы, которые не входят в родоначальную структуру.Положение заместителей (радикалов) в молекуле указывают цифрами или буквами, которые называют локантами. Для обозначения нескольких одинаковых заместителей или кратных связей применяют множительные (умножающие) приставки: ди- (два), три- (три), тетра-(четыре), пента- (пять) и т. д.
Радикалами называют атомы или атомные группы, которые не входят в родоначальную структуру.Положение заместителей (радикалов) в молекуле указывают цифрами или буквами, которые называют локантами. Для обозначения нескольких одинаковых заместителей или кратных связей применяют множительные (умножающие) приставки: ди- (два), три- (три), тетра-(четыре), пента- (пять) и т. д.
Правила составления названий: 1. Среди всех функциональных групп, имеющихся в соединении, выбирают старшую. В названии органического вещества старшая функциональная группа обозначается в суффиксе, все остальные — в префиксе; некоторые функциональные группы всегда находят свое отражение в префиксе.
2. Устанавливают родоначальную структуру. Если соединение содержит кратные связи, то они должны войти в родоначальную структуру.
3. Проводят нумерацию атомов родоначальной структуры таким образом, чтобы старшая функциональная группа получила по возможности меньший номер.
4. Составляют название соединения в целом: первым указывают в алфавитном порядке функциональные группы (кроме старшей) и углеводородные радикалы в префиксе, затем — название родоначальной структуры в корне и в конце названия — старшую функциональную группу в суффиксе.Степень насыщенности обозначается суффиксами: -ан — для насыщенных, -ен — для двойной, -ин — для тройной связи.Локанты, буквенные или цифровые, и множительные приставки располагают перед названием заместителей или кратных связей.
Названия первых четырех гомологов метана по ИЮПАК утверждены исторически сложившимися названиями. Названия остальные алканов с нормальной,прямой углеродной цепью происходят от греческих названий числительных, соответствующих числу атомов углерода в цепи с добавлением суффикса –АН.Алканы с разветвленной цепью рассматриваются как производные нормального алкана, в котором один или несколько атомов водорода замещены на углеводородные радикалы. Для составления названий алканов с разветвленной цепью, например
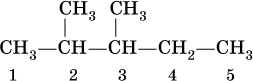
выбирают самую длинную углеродную цепь (в примере – 5 атомов) и получают основу названия (5 – пентан). Нумеруют цепь (от 1 до 5) так, чтобы заместители (—СН3) получили наименьшие номера (2 и 3). В названии арабскими цифрами указывают положение заместителей, а приставками ди – 2, три – 3, тетра – 4 и т. д. – число одинаковых заместителей.При наличии разных заместителей их названия расставляют по алфавиту, т. е., например, сначала метил, а затем этил. В нашем примере алканимеет название2,3-диметилпентан.
Для некоторых разветвленных предельных углеводородов используются, наравне с систематическими, традиционные названия.
Для алканов состава С4Н10 и С5Н12 с формулами:
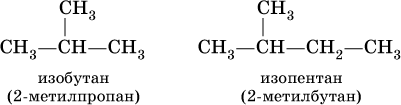
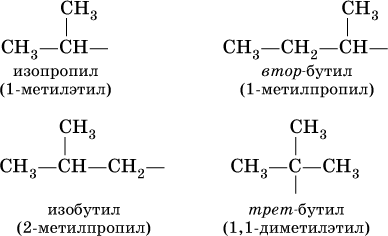
Такие же названия используются для разветвленных радикалов:
Изомерия
Для алканов характерна изомерия углеродного скелета и пространственная (поворотная). Привести примеры структурных изомеров для гептана.
Атомы углерода могут свободно вращаться вокруг σ-связей. Конформациимолекулы = динамические изомеры, отличаются друг от друга пространственным расположением атомов .Конформации молекулы представляют собой различные ее геометрические формы, возникающие в результате вращения вокруг одинарных связей.
Метильные группы в углеводородах могут свободно вращаться вокруг соединяющих их одинарных связей. Для изображения конформаций используют проекционные формулы Ньюмена. Для их построения выбирается наиболее длинная связь(С-С 0,154 нм> C - H), относительно которой производится свободное вращение. Ближний атом углерода обозначается точкой - дальний кругом.
Н3С – СН3 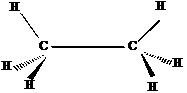
строение конфигурация
Атомы, образующие С—С связь строго проецируются друг на друга так, что мы видим ближайший к нам атом С и от него располагаем все связи к заместителям. Второй атом С как бы прикрыт кружком, идущие от этого атома связи, изображаются выступающими за кружок. При этом возникают два резко отличающихся типа конформеров.
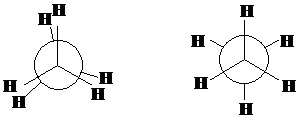
I II
I – конформации, в которых заместители как бы налагаются друг на друга или находятся друг относительно друга в наиболее близко положении, обладают самой высокой энергией и называются заслоненными.
II – заместители одного атома на проекции размещены между заместителями другого, деля валентные углы, т.е. заместители расположены наиболее далеко друг от друга в пространстве. Такиеконформеры обладают наименьшей энергией и называются заторможенными.
В пространстве алканы с большим, чем 2 атома углерода (пентан) имеют зигзагообразную форму, или клещевидную,или промежуточную.
Физические свойства.
При обычных условиях первые алканы – метан, этан, пропан и бутан (С1—С4) – представляют собой газы без цвета и запаха, малорастворимые в воде, хорошо в бензоле, четыреххлористом углероде.Последующие гомологи (С5—C15) – жидкости (при 20 °C), высшие гомологи (C16 и выше) – твердые вещества.
Химические свойства.
В молекулах алкановвсе атомы связаны между собой прочными σ-связями, а валентности углеродных атомов полностью насыщены водородом. Поэтому алканы при обычных условиях инертны: не взаимодействуют с ионными реагентами (кислотами, щелочами), окислителями, активными металлами (поэтому, например, металлический натрий можно хранить в керосине). По этой же причине предельные углеводороды в своё время получили название парафинов (от лат.Рarumaffinis - малое сродство). В практике парафинами называют твёрдые углеводороды, содержащиеся в нефтеи нефтепродуктах.
Основные химические превращения алканов идут только при сообщении им достаточно высокой энергии (за счёт нагревания или УФ- облучения). При этом может произойти разрыв связи С-Н с последующей заменой атома водорода на другой атом или группу атомов (реакции замещения), или же разрыв молекулы по связи С-С (реакции расщепления).



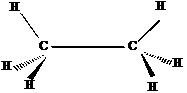
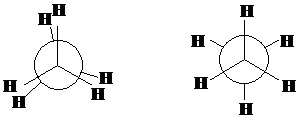


 Радикал — остаток углеводорода, образующийся в результате удаления одного или нескольких атомов водорода. Свободную валентность в радикале обозначают черточкой. В зависимости от того, у какого атома углерода находится свободная валентность, различают первичные, вторичные и третичные радикалы:
Радикал — остаток углеводорода, образующийся в результате удаления одного или нескольких атомов водорода. Свободную валентность в радикале обозначают черточкой. В зависимости от того, у какого атома углерода находится свободная валентность, различают первичные, вторичные и третичные радикалы: Радикалами называют атомы или атомные группы, которые не входят в родоначальную структуру.Положение заместителей (радикалов) в молекуле указывают цифрами или буквами, которые называют локантами. Для обозначения нескольких одинаковых заместителей или кратных связей применяют множительные (умножающие) приставки: ди- (два), три- (три), тетра-(четыре), пента- (пять) и т. д.
Радикалами называют атомы или атомные группы, которые не входят в родоначальную структуру.Положение заместителей (радикалов) в молекуле указывают цифрами или буквами, которые называют локантами. Для обозначения нескольких одинаковых заместителей или кратных связей применяют множительные (умножающие) приставки: ди- (два), три- (три), тетра-(четыре), пента- (пять) и т. д.