

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
Интересное:
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
ФАРМАЦЕВТИЧЕСКИЙ ФИЛИАЛ
ГБОУ СПО «СВЕРДЛОВСКИЙ ОБЛАСТНОЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
ЦМК химии и фармацевтической технологии
НОМЕНКЛАТУРА
НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Учебное пособие для самостоятельной работы студентов по дисциплине «Общая и неорганическая химия»
Екатеринбург
2015
Пособие для самостоятельной работы студентов по общей и неорганической химии / сост. Главатских Т.В., преподаватель химии – Екатеринбург: Фармацевтический филиал ГБОУ СПО «СОМК», 2015 – 45с.
Рецензент: И.В.Лужкова, научный сотрудник ФГУБН Института химии твердого тела УрО РАН.
Учебное пособие предназначено для самостоятельной работы студентов.
В настоящем пособии описаны основные принципы классификации неорганических соединений. Рассмотрен общий подход к вопросам классификации, приведены примеры неорганических классов соединений. Описаны правила традиционной химической номенклатуры простых веществ, бинарных соединений, кислот, оснований, солей и комплексных соединений. Даны основные понятия и определения терминам, применяемым в химии координационных соединений, а также правила систематической номенклатуры, используемой для составления названий этих соединений. Большое количество примеров, приведенных в пособии, поможет обучающимся в освоении непростого химического языка. Предназначено для студентов 1-го курса при изучении дисциплин «Общая и неорганическая химия», «Аналитическая химия» и студентов 2-го и 3-го курса при изучении ПМ 02 МДК 02.02. «Контроль качества лекарственных средств».
Учебное пособие рассмотрено на заседании цикловой методической комиссии химии и фармацевтической технологии (…………….
|
|
СОДЕРЖАНИЕ
Введение…………………………………………………………………….4с.
I. Номенклатура неорганических соединений……………………………5с.
1.1.Виды номенклатуры …………………………………………………5с.
1.2. Общие правила……………………………………………………….7с.
1.3. Химические элементы. Простые вещества…………………………9с.
1.4. Номенклатура бинарных соединений…………………………….. 11с.
1.5. Номенклатура для катионов и анионов…………………………… 13с.
1.6. Оксиды и их номенклатура………………………………………….15с.
1.7. Номенклатура кислот ……………………………………………… 16с.
1.8. Номенклатура оснований и гидратов……………………………….20с.
1.9. Номенклатура солей………………………………………………….23с.
II. Комплексные соединения и их номенклатура………………………....26с.
III. Примеры и задания для самостоятельного решения…………………33с.
Библиографический список………………………………………………...38с.
Приложения………………………………………………………………… 39с.
Введение
Номенклатура химическая - система рациональных названий химически индивидуальных веществ. Первая такая система была выработана в 1787 Комиссией французских химиков под председательством А. Л. Лавуазье. До этого названия веществ давались произвольно: по случайным признакам, по способам получения, по имени первооткрывателя и т. п. Каждое вещество имело по нескольку названий - синонимов. Комиссия Лавуазье постановила, что каждое вещество может иметь только одно название; наименование сложного вещества состоит из двух слов, указывающих на род и вид соединения, должно быть удобопроизносимым и не противоречить нормам языка. Номенклатура неорганических соединений, предложенная французскими учёными и основанная на кислородной теории, явилась образцом для создания в начале 19 в. национальных номенклатур, в том числе русской. Современная номенклатура неорганических соединений и номенклатура органических соединений разработаны международными комиссиями, стремившимися выразить словами всю информацию, содержащуюся в формулах химических. Задача эта чрезвычайно сложная. При пользовании так называемой международной номенклатурой, следует помнить высказывание А. М. Бутлерова (1859) о русской химической номенклатуре: «большею частью своей массы она сольется с общею химической номенклатурой, а русские названия, выработавшиеся в обыденном языке, как были, так и останутся в употреблении у русских химиков». По мнению Д. И. Менделеева (1869), «... в деле номенклатуры нельзя быть совершенно последовательным: есть известного рода обычаи..., от которых отступить невозможно, иначе рискуешь быть непонятым даже теми, кто привык уже к химическому изложению. Из разных названий, более или менее рационально составленных, нужно избрать... не только такое, которое более ясно выражает особенность или состав данного вещества, но также и такое, которое не поражает ухо своим неудобством».
|
|
I. Номенклатура неорганических соединений
Виды номенклатуры
Номенклатура неорганических веществ состоит из формул и названий. Химическая формула - изображение состава вещества с помощью символов химических элементов, числовых индексов и некоторых других знаков. Химическое название - изображение состава вещества с помощью слова или группы слов. Построение химических формул и названий определяется системой номенклатурных правил. Символы и наименования химических элементов приведены в Периодической системе элементов Д.И. Менделеева. Элементы условно делят на металлы и неметаллы. К неметаллам относят все элементы VIII А-группы (благородные газы) и VII А-группы (галогены), элементы VI А-группы (кроме полония), элементы азот, фосфор, мышьяк (V А-группа); углерод, кремний (IV А-группа); бор (III А-группа), а также водород. Остальные элементы относят к металлам.
|
|
|
|
Таблица 1
Числовые приставки
| Множитель | Приставка | Множитель | Приставка | Множитель | Приставка |
| 1 | моно | 5 | пента | 9 | нона |
| 2 | ди | 6 | гекса | 10 | дека |
| 3 | три | 7 | гепта | 11 | ундека |
| 4 | тетра | 8 | окта | 12 | додека |
Неопределенное число n указывается числовой приставкой поли-.
Общие правила
Стехиометрические отношения в формулах соединений должны выражатся простыми целыми числами. Молекулярные формулы используются только тогда, когда речь идет о молекулах вещества, степень ассоциации которых принимается независящей от температуры. Если же степень ассоциации зависит от температуры, то в общем случае следует пользоваться простейшей (эмпирической) формулой. Ионные кристаллические вещества также изображаются эмпирическими формулами, например, РСl3 - трихлорид фосфора, S2Cl2 - дихлорид дисеры, КСl - хлорид калия. Диоксид азота NO2 содержит также N2O4, в общем случае используют формулу NO2 и название диоксид азота, если же речь идет о димере, то его изображают формулой N2O4 и называют тетраоксид диазота.
|
|
В формулах химических соединений на первое место всегда ставится электроположительная составляющая, например, PСl3, НСl. В порядке исключения пишут NH3 и N2H4. Аналогично изображают и более сложные соединения, например, РВrCl2 и РСl3О; для последнего соединения можно записать формулу (РО)Сl3, если группа (РО) рассматривается в качеств радикала.
Названия соединений, как правило, состоят из двух слов: названий электроположительной и электроотрицательной части.
В английской литературе порядок перечисления частей следует порядку их перечисления в формуле, например, КСl - potassium chloride (в руссом языке - наоборот). В одно слово пишутся названия комплексных соединений без внешней сферы, например, [Ni(CO)4] - тетракарбонилникель, традиционные названия некоторых распространенных веществ (особенно растворителей), например, NH3 - аммиак, названия многих водородных соединений, например, SiH4 - силан; в русской литературе в также пишутся названия интерметаллических соединений, например, AuCu3 – тримедь - золото. При составлении названий не делается различий между ионными и ковалентными веществами.
Количественные отношения между составляющими в названиях обозначаются числовыми приставками. Приставка моно- (1) обычно опускается; числовые приставки выше 12 изображаются в названиях цифрами. Умножающие числовые приставки (такие, как бис-, трис-, тетракис-) используются только тогда, когда в названии уже есть числовая приставка, а также когда можно неоднозначно понять написание названия. Приставки могут отделяться от основы названия скобками. Конечные гласные приставок никогда не опускаются, например, пентаоксид, а не пентоксид.
При составлении названий соединений часто необходимо указывать степень окисления того или иного элемента. Без этого можно обойтись, если не нарушается однозначность названия, например, хлорид натрия (sodium chloride), оксид кальция (calcium oxide), оксид дейтерия (deuterium oxide) и хлорид бария (barium chloride).
Степень окисления элемента в соединении - это тот формальный заряд, который возник бы на атоме данного элемента, если бы электроны каждой его связи полностью перешли бы к более электроотрицательному атому.
Водород принято считать положительным во всех соединениях с неметаллами.
Принято считать, что в простых веществах степень окисления элемента равна нулю и, следовательно, связь между атомами одного и того же элемента в любых веществах не влияет на оценку степени окисления.
Если элементы соединяются в различных количественных отношениях, названия полученных соединений строятся по одному из следующих четырех способов.
1. Для обозначения стехиометрического состава используются числовые приставки, например: трихлорид железа (iron trichloride), дихлорид меди (copper dichloride), тетраоксид трижелеза (triiron tetraoxide), пентасульфид диазота (dinitrogen pentasulfide).
2. Степень окисления, обычно для электроположительного элемента, указывается римской цифрой в скобках (без пробела) за символом элемента (способ Штока), например: MnO2 - оксид марганца(IV) [manganese(IV) oxide] PbO-оксид свинца(II) [lead(II) oxide]. Строчными или заглавными обозначать римские цифры значения не имеет, хотя в русской литературе отдается предпочтение заглавным.
Хотя правила IUPAC рекомендуют при составлении названий отдавать предпочтение латинским названиям элементов (даже в названиях электроположительных частей), это часто не принимается во внимание в американских и английских публикациях, например: FeС13 – iron (III) chloride, а не ferrim (III) chloride, CuCl2 – copper (II) chloride, а не cuprum (II) chloride. В русской литературе всегда используются русские названия элементов.
3. Для ионных соединений можно использовать способ Эвенса - Бассетта, указывая заряд катиона арабской цифрой в скобках, например: FeCl3 – iron (3+) chloride, CuCl2 – copper (2+) chloride. Этот способ используется сейчас в указателях журнала Chemical Abstracts. В русской литературе способ Эвенса-Бассета используется только в тех случаях, когда неприменимы правила с числовыми приставками и способ Штока, например, N2H5+ - катион гидразиния (1+), N2H62+ - катион гидразиния (2+), S 4 2- - тетрасульфид (2-)-ион.
4. В английской и американской литературе применяется еще и старый прием, заключающийся в добавлении суффикса -ic к названию аниона для указания более высокой степени окисления элемента катиона и суффикса -ous для более низкой степени окисления, например: FeCl3 - iron chloric, FeCl2 - iron chlorous. В русской литературе названия типа хлорное железо FeCl3 и хлористое железо FeCl2 являются устаревшими и более не применяются. Этот прием оказывается недостаточным, если элемент может существовать в более чем двух валентных состояниях; неприменим для написания названий комплексных соединений и соединений редко встречающихся элементов. Комиссия IUPAC считает этот прием допустимым к использованию, но нежелательным.
Оксиды и их номенклатура
Оксиды - сложные вещества, молекулы которых состоят из атомов кислорода и какого-нибудь другого элемента.
Оксиды делят на солеобразующие и несолеобразующие. Последних довольно мало (СО, NO, N2О), они не образуют солей ни с кислотами, ни с щелочами.
Солеобразующие оксиды делят на основные (их гидраты, т.е. продукты взаимодействия с водой - основания), кислотные (их гидраты - кислоты), амфотерные (их гидраты проявляют свойства, как кислот, так и оснований).
К основным оксидам относятся оксиды щелочных и щелочно - земельных металлов (I и II группа (главные подгруппы) периодической системы Д.И.Менделеева), а также многие оксиды других металлов со степенью окисления +1, +2.
Непосредственно с водой при обычной температуре реагируют только оксиды щелочных и щелочно - земельных металлов. Основные оксиды взаимодействуют с кислотами и кислотными оксидами, образуя, соли и воду.
СаО + СО2 = СаСО3
CuО + 2HCl = CuCl2 + Н2O
Кислотные оксиды образуют неметаллы (С12О, СО2 N2О5 и др.), а также металлы со степенью окисления +5, +6, +7 (V2О5, CrО3, Mn2О7, WO3).
Многие кислотные оксиды непосредственно взаимодействуют с водой, образуя кислоты:
S02 + Н20 = H2S03
С основаниями кислотные оксиды образуют соль и воду:
N205 + 2Na0H = 2NaN03 + Н20
Амфотерные оксиды образуют металлы, имеющие степени окисления +2,+3,+4. К амфотерным оксидам относятся, например, BеO, ZnO, A1203, Cr203, SnO, PbO, и другие. Амфотерные оксиды проявляют свойства основных оксидов при взаимодействии с кислотами и кислотных оксидов при взаимодействии с основаниями.
ZnO + 2НС1 = ZnCl2 + Н20
ZnO + 2Na0H = Na2Zn02 + H20
По одной из наиболее распространенных современных систем химической номенклатуры (ASE) - систематической - названия этого класса строятся следующим образом: к слову "оксид" добавляется название элемента с указанием его степени окисления, если она постоянна. Например, СаО - оксид кальция, Fe203 - оксид железа (III), Р205 — оксид фосфора (V).
В соединениях элементов с кислородом, где степень окисления кислорода составляет -1, к слову "оксид" добавляется приставка "пер-". Например, Н202 - пероксид водорода, Na202 - пероксид натрия.
Согласно устаревшей отечественной номенклатуре, если элемент образует только один оксид, то последний назывался окисью. Так, CaO назывался окисью кальция.
Если существует два или несколько оксидов данного элемента, то их названия образовывались в соответствии с числом атомов кислорода, приходящихся на один атом элемента, например: Э2О – полуокись, ЭО – одноокись, Э2О3 – полутораокись, ЭО2 – двуокись, Э2О5 – полупятиокись, ЭО3 – трехокись (символом Э здесь обозначен атом соответствующего элемента). Например, FeO – одноокись железа, Fe2O3 – полутораокись железа, Cu2O – полуокись меди, CuO – одноокись меди. Иногда оксиды, в которых элемент проявляет низшую валентность, назывались закисями (Cu2O – закись меди, N2O – закись азота), а кислотные оксиды – ангидридами соответствующих кислот (N2O5 – азотный ангидрид, Mn2O7 – марганцовый ангидрид). «Функциональная» терминология, например, употребление названия «азотный ангидрид» для N2O5 не рекомендует.
Номенклатура кислот
Номенклатура кислот имеет давнюю историю с прочно укоренившимися традициями. Правила ИЮПАК сохраняют наиболее полезные из старых названий, и в то же время в них делается попытка дать руководство для более рациональных названий новых соединений. Для составления названий кислот рекомендации правил IUPAC 1970 г. несколько менее строги, чем рекомендации 1957 г., в которых выражалась надежда на то, что традиционные названия типа серная кислота (sulfuric acid) будут полностью заменены на названия типа сульфат водорода (hydrogen sulfate). Правила 1970 г. разрешают свободно пользоваться как традиционными, так и систематическими формами названий, правда, предпочтение отдается систематической форме, особенно для редко встречающихся и необычных кислот.
Кислоты, от которых образованы названия анионов с окончанием – ид, рассматриваются как двойные и псевдодвойные соединения водорода, например, H2S – водород сульфид, HCN – водород цианид. Чаще бескислородные кислоты называются одним словом, которое составляется из русского наименования элемента и слова "водород ". Например, НС1 - хлороводородная или хлористоводородная, H2S -сероводородная.
Если электроотрицательная составляющая является гетерополиатомной, ее следует обозначить окончанием –ат, -ит, но в соответствии со сложившейся практикой их названия получаются путем присоединения к слову кислота прилагательного с окончанием (- ый, -ыватый) и (- истый, -ватистый) в зависимости от окончания анионов –ат и – ит соответственно. Таким образом, хлорноватая кислота соответствует хлорату, серная – сульфату, азотистая – нитриту. Окончание –ит употребляется для обозначения низших степеней окисления. Названия кислородных кислот составляются из двух слов: прилагательного, образуемого из русского названия кислотообразующего элемента и слова "кислота ".
При этом к прилагательному добавляются суффиксы, характеризующие степень окисления этого элемента.
- новатистая - низшая степень окисления;
- нистая, - истая, - новатая, - оватая, - средняя степень окисления;
- ная, - овая, - евая - высшая степень окисления.
Например:
+1
HCl0 - хлорноватистая;
+3
HCl02 - хлористая;
+5
HCl03 - хлорноватая;
+7
HCl04 - хлорная.
Приставка гипо- применяется, чтобы обозначить более низкую степень окисления: HСlO - гипохлористая кислота, HВrO – гипобромистая кислота, HJO – гипоиодистая кислота. В русской химической терминологии для этих соединений укоренились соответственно названия: хлорноватистая, бромноватистая, иодноватистая кислоты.
Приставка пер- применяется, чтобы обозначить более высокую степень окисления и сохраняется только для HСlO4 (перхлорная кислота) и для соответствующих кислот других элементов VII группы. Применение приставки пер- не должно распространяться на элементы других групп. Приставки орто - и мета- применяются, чтобы распознать кислоты, различающиеся по «содержанию воды». Одобряются следующие названия:
H3BO3 - ортоборная кислота
H2SiO4 - ортокремниевая кислота
H3PO4 - ортофосфорная кислота
H5IO6 - ортопериодная кислота
H6TeO6 - ортотеллуровая кислота
(HBO2)n - метаборная кислота
(H2SiO3)n - метакремниевая кислота
(HPO3)n - метафосфорная кислота
Приставка пиро- применяется для обозначения кислоты, состоящей из двух молекул ортокислоты с вычетом одной молекулы воды. Название пирофосфорная кислота можно сохранить для H4P2O7, хотя название дифосфорная кислота предпочтительнее. Когда приставка пероксо- применяется с тривиальными названиями кислот, она указывает замещение иона – О – ионом – О – О –. Например:
HNO4 - пероксоазотная кислота
H4P2O8 - пероксодифосфорная кислота
Кислоты, образованные из оксокислот путем замещения кислорода серой, называются тиокислотами. Когда замещено более одного атома кислорода, количество атомов серы желательно указывать:
HSCN - тиоциановая кислота
H3PO2S2 - дитиофосфорная кислота
Нижеприведенный список содержит принятые названия для некоторых оксокислот и их пероксо- и тио- производных.
H2CO3 - угольная кислота
HOCN - циановая кислота
HNCO - изоциановая кислота
HONC - гремучая кислота
HNO3 - азотная кислота
HNO2 - азотистая кислота
H2NO2 - нитроксильная кислота
H2N2O2 - гипоазотистая кислота
H3PO5 - пероксомонофосфорная кислота
H2PHO3 - фосфоновая кислота
H3AsO4 - мышьяковая кислота
H2SO4 - серная кислота
H2S2O7 - дисерная кислота
H2S2O3 - тиосерная кислота
H2SO3 - сернистая кислота
H2SeO4 - селеновая кислота
H2SeO3 - селенистая кислота
H2CrO4 - хромовая кислота
H2Cr2O7 - дихромовая кислота
HСlO3 - хлорновая кислота
HBrO4 - пербромная кислота
HBrO3 - бромноватая кислота
HIO3 - иодноватая кислота
HMnO4 - пермарганцовая кислота
H2ReO4 - рениевая кислота
Бескислородные кислоты называются одним словом, которое составляется из русского наименования элемента и слова "водород ". Например, НС1 - хлороводородная или хлористоводородная, H2S -сероводородная.
Названия кислородных кислот составляются из двух слов: прилагательного, образуемого из русского названия кислотообразующего элемента и слова "кислота ".
Решение.
I205 - оксид иода (V) или пентаоксиддииода;
НIO4 - метаиодиая кислота, тетраоксоиодат водорода;
H5IO6 - ортоиодная кислота или гексаоксоиодат пентаводорода;
КIO3 - традиционное название - иодат калия, систематическое - триоксоиодат калия.
Пример 2. Написать формулы следующих веществ:
а) пероксосульфат диводорода;
б) трисульфиддиаммония;
в) триоксотиосульфат динатрия.
Решение.
а) пероксосульфат диводорода - K2S03(02) или KSO5 - содержит пероксогруппу О 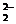 и серу в высшей степени окисления;
и серу в высшей степени окисления;
б) трисульфиддиаммония - (NH4)2S3;
в) триоксотиосульфат динатрия - N2S203 - содержит серу в степени окисления -2 (тио-) и серу в высшей степени окисления, то есть в сульфат-ионе один ион О2- заменен на S 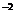 .
.
Пример 3. Классифицировать, полностью охарактеризовать и дать названия следующим комплексным соединениям: а) K3[Ag(SO3S)2];
б) [Co(NH3)4Cl2]Cl;
в) [W(CO)6].
Решение:
а)
1) K3[Ag(SO3S)2] - 3 иона К+ - внешняя сфера, ее общий заряд +3, [Ag(SO3S)2]3- - внутренняя сфера, ее общий заряд равен заряду внешней сферы, взятому с противоположным знаком - (3-);
2) Комплексное соединение анионного типа, так как заряд внутренней сферы - отрицательный;
3) Центральный атом - комплексообразователь - ион серебра Ag+
4) Лиганды - два двухзарядных остатка тиосерной кислоты H2S2O3, относится к ацидокомплексам;
5) Координационное число комплексообразователя в данном случае как исключение равно 4 (у двух остатков кислоты 4 валентных σ - связи без 4-х катионов водорода);
6) Заряд комплексообразователя равен +1:
+1 х -2
K3[Ag(SO3S)2]: +1 · 3 + Х + (-2) · 2 = 0 à X= +1
7) Название: – калия дитиосульфатоаргентат (I).
б)
1) [Co(NH3)4Cl2]Cl - 1 ион - Сl- - внешняя сфера, ее общий заряд -1, - [Co(NH3)4Cl2] - внутренняя сфера, ее общий заряд равен заряду внешней сферы, взятому с противоположным знаком - (3+);
2) Комплексное соединение катионного типа, так как заряд внутренней сферы – положительный;
3) Центральный атом - комплексообразователь - ион кобальта Со, вычисляем его заряд:
х 0 -1 1+
[Co(NH3)4Cl2]: Х + 0 · 4 + (-1) · 2 = +1 à Х = 0 +2 +1 = +3
4) Комплексное соединение смешанного типа, так как в его составе разные лиганды; ацидокомплекс (Cl-- остаток хлороводородной кислоты) и амминкамплекс - аммиакатный (NH3 - аммиак-нейтральное соединение);
5) Координационное число комплексообразователя равно 6;
6) Название – дихлоротетраамминкобальта(III) хлорид.
в)
1) [W(CO)6] - внешней сферы нет;
2) Комплексное соединение нейтрального типа, так как заряд внутренней сферы = 0;
3) Центральный атом - комплексообразователь - атом вольфрама,
его заряд =0;
4) Карбонилкомплекс, так как лигандом является нейтральная частица - карбонил - СО;
5) Координационное число комплексообразователя равно 6;
6) Название: – гексакарбонилвольфрам
Пример 4. Какие оксиды вступают в реакцию с соляной кислотой -HCl:
а) СuO; б) SiO; в) BeO?
Решение:
а) оксид меди (II) CuО - основной, следовательно, в реакuии с кислотой образует соль и воду:
CuO + 2НCl = CuCl2 + H2O;
б) оксид кремния (IV) SiО2 - кислотный, следовательно, в реакцию с кислотой не вступает;
в) оксид берилия BeО - амфотерный, следовательно, в реакuии с кислотой образует соль и воду:
BeO + 2НCl = BeCl2 + H2O.
Пример 5. Какие оксиды вступают в реакцию с гидроксидом натрия -NaOH:
а) FeO; б) SO2; в) Al2O3?
Решение:
а) оксид меди (II) CuО - основной, следовательно, в реакцию со щелочью не вступает;
б) оксид серы (IV) SО2 - кислотный, следовательно, в реакцию со щелочью вступает и образует соль и воду:
SО2 + 2NaOH = Na2SO3 + H2O;
в) оксид алюминия Al2O3 - амфотерный, следовательно, в реакuии со щелочью образует соль и воду:
Al2O3 + 2NaOH = 2Na AlO2 + H2O.
Пример 6. Составьте формулы гидроксидов, соответствующих оксидам:
а) FeO; б) SO2; в) Al2O3?
Решение:
а) оксид железа (II) FeО - основной, следовательно, соответствующий гидроксид - основание, в формуле число гидроксогрупп (ОН) равно валентности металла (II) или степени окисления (+2); формула гидроксида - основания Fe(OH)2;
б) оксид серы (IV) SО2 - кислотный, следовательно, соответствующий гидроксид - кислота:
SО2 + H2O = Н2SO3;
в) оксид алюминия - амфотерный, следовательно, соответствующий гидроксид - амфотерен. Амфотерные гидроксиды, чаще, записывают в форме оснований - Аl(OH)3.
Пример 7. Составьте формулы а) гидроксида хрома(+3);
б) фосфорной кислоты
Решение:
а) гидроксид хрома (+3) - амфотереный, формула Cr(ОН)3; кислотная ортоформа - H3CrO3 и метаформа (с меньшим содержанием воды) - HCrO2;
б) Данное название кислоты (- ная) соответствует максимальной валентности (степени окисления) фосфора (+5). Формулу кислоты можно вывести:
1) P 2О5 + H2O = 2НPO3 - метафосфорная кислота
P 2О5 + 3H2O = 2Н 3 PO4 - ортофосфорная кислота;
2) общая условная формула гидроксида фосфора Р(ОН)5; при последующем постепенном вычитании двух молекул воды получаются ортофосфорная и метафосфорная кислота, соответственно.
Пример 8. Составьте формулы: а) карбоната хрома (+3);
б) гидросульфата бария;
в) сульфита дигидроксоалюминия
Решение
а) Сr 3+ и CO32- - ион хрома и двухзарядный (двухвалентный) остаток угольной кислоты - карбонат-анион. Составляем формулу, учитывая валентности:Сr2(CO3)3;
б) Ba2+ и анион, в котором с сульфат-ионом связан один катион водорода HSO4-. Составляем формулу: Ba(HSO4)2
в) катион, в котором ион алюминия Al3+ связан с двумя гидроксогруппами OH- т.е., Al(OH)2+ и анион SO32-. Составляем формулу, учитывая валентности (заряды) этих двух ионов: (Al(OH)2)2 SO3.
Задание 9. Составьте формулы:
а) гидроксида марганца (+2);
б) хлорной кислоты (с высшей степенью окисления хлора);
в) гидроксида свинца (+4) и его кислотных орто- и метаформ.
Задание 10. Составьте формулы всех солей, которые могут быть образованы гидроксидом кальция и ортофосфорной кислотой. Дайте им название.
Задание 11. Составьте формулы:
а) карбоната хрома (+3);
б) гидросульфата бария;
в) дигидроксосульфита алюминия
(или сульфита дигидроксоалюминия).
Задание 12. Составьте формулы солей:
а) дигидрофосфата меди (+2);
б) нитрата кобальта (+3);
в) гидроксохлорида железа (+3).
Задание 13. Составьте формулы всех солей, которые могут быть образованы гидроксидом кальция - Ca(OH)2 и сернистой кислотой - H2SO3
Приведите названия полученным соединениям.
Задание 14. В реакциях, между какими веществами возможно образование кислых солей: a) Na2S + H2S;
б) KOH + H3PO4;
в) Al(OH)3+ HBr;
г) NaOH + SO2 (изб.).
Напишите уравнения реакций, дайте названия продуктам реакции.
Задание 1 5. Охарактеризуйте комплексные соединения:
а) Li3 Cr (OH)6]
б) [Zn(H2O)3 F] I2
в) [ Pt Cl2 (NH3)2]
и дайте им названия.
Задание 16. Назовите комплексные соединения и дайте им названия
[C
|
|
|

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!