Переваривание холестеридов и всасывание холестерина. Понятие об экзо- и эндогенном ХС.
Холестерин в организме человека бывает 2 видов:
1) холестерин, поступающий с пищей через ЖКТ и называемый экзогенный
2) холестерин, синтезируемый из Ац – КоА - эндогенный.
С пищей ежедневно поступает ≈ 0,2 – 0,5 г, синтезируется ≈ 1 г (почти все клетки за исключением эритроцитов синтезируют холестерин, 80% холестерина синтезируется в печени.)
Взаимоотношения экзо и эндогенного холестерина в определенной степени конкурентные – холестерин пищи ингибирует его синтез в печени.
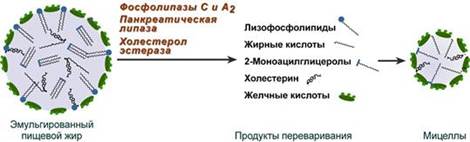
В составе пищи холестерин находится в основном в виде эфиров. Гидролиз эфиров холестерола происходит под действием холестеролэстеразы. Продукты гидролиза всасываются в составе смешанных мицелл.

Всасывание холестерина происходит в основном в тощей кишке (пищевой холестерин всасывается почти полностью – если в пище его не очень много)
+Всасывание холестерина осуществляется только после эмульгирования эфиров холестерина. Эмульгаторами являются желчные кислоты. Холестеридыгидролизуютсяхолестеринэстеразой поджелудочной железы.
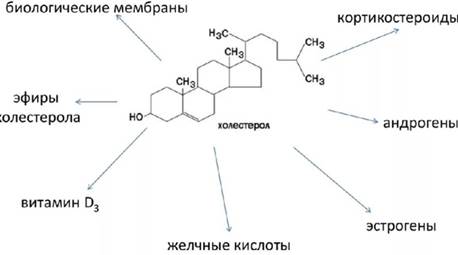
Биологический роль ХС. Пути использования ХС в различных тканях.
- 1. ХС входит в состав всех мембран клеток, увеличивает их электроизоляционные свойства, придает им жесткость и прочность;
- 2. В мембране ХС защищает полиненасыщенные ЖК от окисления;
- 3. из ХС в печени синтезируются жёлчные кислоты (0,5-0,7 г ХС в сут), стероидных гормоны (половые и кортикоиды) (40 мг ХС в сут) и витамин Д3 (10 мг ХС в сут).
- 4. ХС является компонентом желчи.
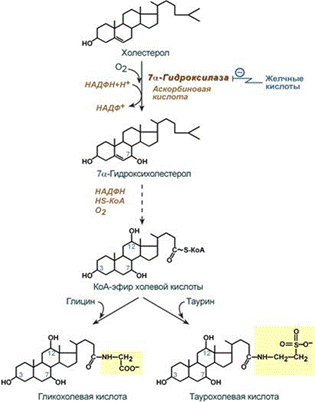
Структура и био роль желчных и парных жлч кислот. Биосинтез жлч кислот.
Желчные кислоты: простые и парные
Простые: 1. Холевая (3,7,12 тригидроксихолановая) (первичные желчные к)
2. дезоксихолевая (3,12 дигидроксихолановая) (вторичные желчные к)
3. хенодезоксихолевая (3,7.дигидроксихолановая)
Парные желчные кислот ы образуются в результате комплексирования простых с таурином или гликоколом, что повышает их растворимость и поверхностно-активные свойства.

Синтез желчных кислот
Образование желчных кислот идет в эндоплазматическом ретикулуме при участии цитохрома Р450, кислорода, НАДФН и аскорбиновой кислоты. 75% холестерина, образуемого в печени, участвует в синтезе желчных кислот.
В печени синтезируются первичные желчные кислоты:
• холевая (3α, 7β, 12α, гидроксилирована по С3, С7, С12),
• хенодезоксихолевая (3α, 7α, гидроксилирована по С3, С7).
Затем они образуют парные желчные киcлоты – конъюгаты с глицином (гликопроизводные) и с таурином (тауропроизводные), в соотношении 3:1 соответственно. При этом повышается их гидрофильность и снижается токсичность.
В кишечнике под влиянием ферментов микрофлоры первичные желчные кислоты деконъюгируются; из 7-го положения удаляется ОН- группа, и они превращаются во вторичные – 3,12 диоксихолановую (дезоксихолевую) и 3-оксихолановую (литохолевую) кислоты, которые всасываются в подвздошной кишке и возвращаются в печень, откуда вновь поступают в желчь.
Особенности обмена ХС в организме человека. Роль ЛПЛ, печеночной липазы,ЛП, ЛХАТ, апопротеинов в транспорте ХС в крови: альфа и бетта ХС, коэфициентатерогенности, АХАТ, накопление ХС в тканях. Путь распада и выведения ХС.
Липопротеинлипаза (ЛПЛ) — фермент, относящийся к классу липаз. ЛПЛ расщепляет хиломикронов и липопротеинов очень низкой плотности (ЛПОНП или ЛОНП) до их остаточных форм. Он активируется гепарином и располагается в эндотелии сосудов
Печёночная липаза - синтезируется в печени и секретируется в кровь, после чего связывается со стенкой сосуда (почти исключительно в печени) и расщепляет липиды остаточныхлипопротеинов (ХМ и ЛПОНП).
Печёночная липаза работает в кровотоке в тандеме с липопротеинлипазой. Липопротеинлипаза расщепляет липопротеины, богатые триглицеридами (липопротеины очень низкой плотности и хиломикроны), до их остатков. Остатки липопротеинов являются в свою очередь субстратом для печёночной липазы. Таким образом, в результате действия печёночной липазы образуются атерогенные липопротеины низкой плотности, которые поглощаются печенью.
Липопротеины: (ЛПВП) — Транспорт холестерина от периферийных тканей к печени
(ЛПНП) — Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям. ЛПНП являются атерогенными, способствуют развитию атеросклероза.
(ЛППП)— Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
(ЛОНП)-Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
Хиломикроны-Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень.
Лецитинхолестеринацилтрансфераза (ЛХАТ)- является ферментом метаболизма ЛПВП. ЛХАТ связан с поверхностью липопротеинов высокой плотности, которые содержат аполипопротеин A1 — активатор этого фермента. ЛХАТ катализирует этерификацию ХС ненасыщенной ЖК. Холестерин, превращённый в эфиры холестерина, благодаря высокой гидрофобности перемещается с поверхности липопротеина в ядро, освобождая место на поверхности частицы для захвата нового свободного холестерина. Таким образом, эта реакция является исключительно важной для процесса очищения периферических тканей от холестерина
Апопротеины формируют структуру липоппротеинов,взаимодействуют с рецепторами на поверхности клеток и таким образом определяют какими тканями будет захватываться данный тип липопротеидов, служат ферментами или активаторами ферментов, действующих на липопротеины.

|
При расчете коэффициента атерогенностипользуютсяформулой:

|
Индексатерогенности является нормальным в диапазоне от 2 до 2.5 единиц (но не выше 3.2 для женщин и 3.5 для мужчин). Показатель свыше указанной нормы может свидетельствовать о наличии атеросклероза.
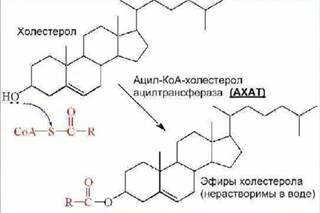
АХАТ (ацетилКоА: холестеринацилтрансфераза) - фермент, этерифицирующий ХС в энтероцитахпутем взаимодействия с ацетил КоА (катализирует ресинтез эфиров ХС в энтероцитах). От активности этого фермента зависит скорость поступления экзогенного ХС в организм.
При высоком содержании ХС в организме она начинает осаждаться и накапливаться на клетках, образуя холестериновые камни (при желчекаменной болезни), а также на стенках сосудов, приводя к атеросклерозу.
Выведение ХС из организма. В печени ХС, поступивший в составе ЛПВП, используется для биосинтеза ЖлчК, которые затем секретируются в 12пк.Часть ХС в кишечнике под действием ферментов бактерий восстанавливается по двойной связи, образуя холестанол и копростанол (который далее выходт с калом). С кожным салом в сутки выделяется 0,1г ХС.
Таким образом, ХС выводится из организма в основном с калом и немного с потом через кожу.
6. Содержание холестерина в сыворотке крови. Принцип метода определения и диагностическая ценность определения содержания общего холестерина в сыворотке крови
Уровни холестерина в сыворотке (плазме) крови:
- нормальный (желаемый) - < 5,2 ммоль/л;
- погранично – высокий – 5,2 – 6,2 ммоль/л;
- высокий – более 6,2 для мужчин и 6,7 ммоль/л для женщин.
Принцип метода. Метод основан на сопряженных реакциях с участием ряда ферментов: а) холестеролэстеразы (ХЭ), катализирующий гидролиз эфира холестерина до свободного холестерина:
ХЭ
Эфиры холестерина +Н2О---холестерин + жирная кислота
б) холестеролоксидазы (ХО), катализирующий окисление холестерина в холестенон с образованием пероксида водорода:
ХО
холестерин + О2+ Н2О---холестенон + Н2О2
в) пероксидазы, катализирующей взаимодействия пероксида водорода с 4-аминоантипирином (4-АПП) и фенолом с образованием хенонимина розовомалинового цвета с максимумом поглощения при 500 нм:
пероксидаза
2Н2О2 + 4-АПП+фенол------4Н2О + хинонимин
Интенсивность окраски образовавшегося хинонимина пропорциональна концентрации холестерина.
Диагностическая ценность определения содержания общего холестерина в сыворотке крови
Тяжелая гиперхолестеринемия – более 7,5 ммоль для женщин и 7,8 ммоль для мужчин. Гиперхолестеринемия (повышенное содержание холестерина в крови) отмечается при атеросклерозе, гипертонической болезни, ишемической болезни сердца, дислипопротеинемиях, сахарном диабете, гипотиреозе, подагре, хроническом алкоголизме, заболеваниях печени, почек и др.
Гипохолестеринемия (снижение содержания холестерина в крови) возникает при гипертиреозе, голодании, синдроме мальабсорбции, поражении центральной нервной системы, хронических обструктивных заболеваниях легких.
Типы дислипопротеинемий.
Первый тип. Диагностируется редко. Проявляется резким повышением уровня жиров в крови после приема жирной пищи. Лечится путем изменения режима питания.
Второй тип. Встречается наиболее часто. Обычно приводит к развитию атеросклероза сосудов, может стать причиной инфаркта миокарда.
Третий тип. Дислипопротеидемия является наследственной. Пациенты с данной формой заболевания часто страдают ожирением, сахарным диабетом, подагрой.
Четвертый тип. В крови наблюдается повышенная концентрация триглицеридов, число которых сильно увеличивается после употребления алкоголя.
Пятый тип. Наблюдается повышенная концентрация липопротеинов с чрезмерно низкой плотностью. У пациентов с данным типом дислипопротеидемии резко повышается вероятность развития панкреатита.
9. Структура глицеролфосфатов и сфинголипидов.
Глицерофосфолипиды являются производными фосфатидной кислоты. В их состав входят глицерин, жирные кислоты, фосфорная кислота и обычно азотсодержащее соединение (холин, этанол-амин, серин).
Сфингофосфолипиды. Особую группу составляют фосфолипиды, у которых вместо глицерина содержится аминоспирт сфингозин. К наиболее распространенным сфинголипидам относят сфингомиелин.


Переваривание в желудке
Собственная липаза желудка у взрослого не играет существенной роли в переваривании липидов из-за ее небольшого количества и того, что ее оптимум рН 4,5-5,5. Также влияет отсутствие эмульгированных жиров в обычной пище (кроме молока).
Тем не менее, у взрослых теплая среда и перистальтика желудка вызывает некоторое эмульгирование жиров. При этом даже низко активная липаза расщепляет незначительные количества жира, что важно для дальнейшего переваривания жиров в кишечнике, т.к. наличие хотя бы минимального количества свободных жирных кислот облегчает эмульгирование жиров в двенадцатиперстной кишке и стимулирует секрецию панкреатической липазы.
Переваривание в кишечнике
Под влиянием перистальтики ЖКТ и составных компонентов желчи пищевой жир эмульгируется. Образующиеся при переваривании лизофосфолипиды также являются хорошим поверхностно-активным веществом, поэтому они способствуют дальнейшему эмульгированию пищевых жиров и образованию мицелл. Размер капель такой жировой эмульсии не превышает 0,5 мкм.
Гидролиз эфиров ХС осуществляет холестерол-эстераза панкреатического сока.

|
| Роль колипазы в действии липазы
|
Переваривание ТАГ в кишечнике осуществляется под воздействием панкреатической липазы с оптимумом рН 8,0-9,0. В кишечник она поступает в виде пролипазы, для проявления ее активности требуется колипаза, которая помогает липазе расположиться на поверхности липидной капли.
Колипаза, в свою очередь, активируется трипсином и затем образует с липазой комплекс в соотношении 1:1. Панкреатическая липаза отщепляет жирные кислоты, связанные с С1 и С3 атомами углерода глицерола. В результате ее работы остаются 2-моноацилглицеролы (2-МАГ), которые всасываются или превращаются моноглицерол-изомеразой в 1-МАГ. Последний гидролизуется до глицерола и жирной кислоты. Примерно 3/4 ТАГ после гидролиза остаются в форме 2-МАГ и только 1/4 часть ТАГ гидролизуется полностью.

Точки действия фосфолипаз
Образование мицелл
В результате воздействия на эмульгированные жиры ферментов панкреатического и кишечного соков образуются 2-моноацилглицерол ы, свободные жирные кислоты и свободный холестерол, формирующие структуры мицеллярного типа (размер уже около 5 нм). Свободный глицерол всасывается напрямую в кровь.
Функции липопротеинов
Функциями липопротеинов крови являются
1. Перенос к клеткам тканей и органов
· насыщенных и мононенасыщенных жирных кислот в составе триацилглицеролов для последующего депонирования или использования в качестве энергетических субстратов,
· полиненасыщенных жирных кислот в составе эфиров холестерола для использования клетками в синтезе фосфолипидов или образования эйкозаноидов,
· холестерола в качестве мембранного материала,
· фосфолипидов в качестве мембранного материала,
Хиломикроны и ЛПОНП ответственны, в первую очередь, за транспорт жирных кислот в составе ТАГ. Липопротеины высокой и низкой плотности – за транспорт свободного холестерола и жирных кислот в составе его эфиров.
ЛПВП способны также отдавать клеткам часть своей фосфолипидной оболочки.
2. Удаление избытка холестерола с мембран клеток.
3. Транспорт жирорастворимых витаминов.
4. Перенос стероидных гормонов (наряду со специфическими транспортными белками).
Апобелки липопротеинов
Белки в липопротеинах обычно называются апобелками, выделяют несколько их типов – А, В, С, D, Е. В каждом классе липопротеинов находятся соответствующие ему апобелки, выполняющие свою собственную функцию:
1. Структурная функция («стационарные» белки) – связывают липиды и формируют белок-липидные комплексы:
· апоВ-48 – присоединяет триациллицеролы,
· апоВ-100 – связывает как триацилглицеролы, так и эфиры холестерина,
· апоА-I – акцептирует фосфолипиды,
· апоА-IV – связывается с холестеролом.
2. Кофакторная функция («динамические» белки) – влияют на активность ферментов метаболизма липопротеинов в крови:
· апоС-II - кофактор гепаринзависимой липопротеинлипазы,
· апоС-III – кофактор печеночной ТАГ-липазы и ингибитор липопротеинлипазы,
· апоА-I, апоА-II и апоС-I – кофакторы лецитин-холестерол-ацилтрансферазы,
· апоЕ – ингибитор липопротеинлипазы.
3. Векторная функция (белки-маркеры, стационарные) – обеспечивают направленный транспорт липопротеинов:
· апоВ-48, апоВ-100 и апоА-I – связываются со своими рецепторами клеток-мишеней,
· апоЕ помогает взаимодействию векторных апобелков с рецепторами.
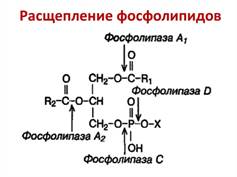
13. Тканевый распад фосфолипидов. Ферменты расщепления фосфоглицеридов.
Вводимые с пищей глицерофосфолипиды подвергаются в кишечнике воздействию специфических гидролитических ферментов, разрывающих эфирные связи между компонентами, входящими в состав фосфолипидов. В пищеварительном тракте распад глицерофосфолипидов происходит при участии ферментов фосфолипаз, выделяемых с панкреатическим соком, по приведенной ниже схеме.
Различают несколько типов фосфолипаз:
Фосфолипаза А1 гидролизует эфирную связь в положении 1 глицерофосфолипида, в результате чего отщепляется 1 молекула жирной кислоты, и в данном случае образуется 2-моноацилглицеролфосфохолин.
Фосфолипаза А2 катализирует гидролитическое отщепление жирной кислоты в положении 2; образующееся соединение называется лизофосфатидилхолин. Оно токсично и вызывает разрушение мембран клеток. Высокая активность фосфолипазы А2 в яде змей и скорпионов приводит к тому, что при их укусе гемолизируются эритроциты.
Накопление лизофосфолипидов в кишечнике обычно не происходит, если фосфолипазы А1 А2 действуют одновременно - в этом случае образуется нетоксичный для организма продукт, что является нормой.
Фосфолипаза С вызывает гидролиз связи между Р и глицерином; образуется 1,2- диацилглицерол и фосфохолин.
Фосфолипаза Д расщепляет эфирную связь между азотистым основанием и Р с образованием фосфатидной кислоты и холина.
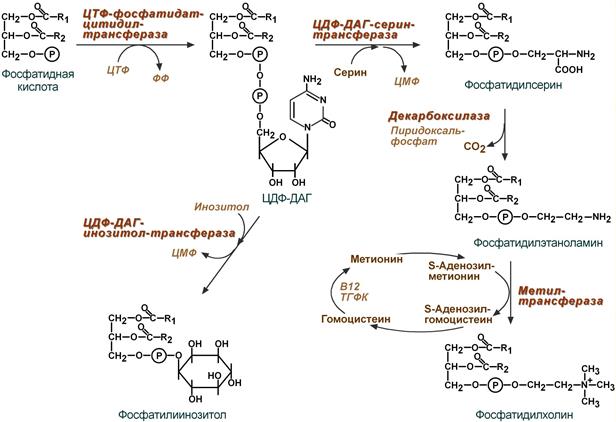
14. Синтез Фосфолипидов. Cинтез фосфоглицеридов путем активации азотистых оснований и через стадию фосфатидной кислоты. Роль ЦТФ. Цитидинтрифосфат
Биосинтез фосфолипидов по сравнению с синтезом ТАГ имеет существенные особенности. Они заключаются в дополнительной активации компонентов ФЛ – фосфатидной кислоты или холина и этаноламина.
1 путь – "спасательный"
Благодаря этому пути холин и этаноламин используются повторно и не катаболизируют. Активация холина (или этаноламина) происходит через промежуточное образование фосфорилированных производных с последующим присоединением ЦМФ. В следующей реакции фосфохолин (или фосфоэтаноламин) переносится на ДАГ. Этот путь особенно характерен для легких и кишечника, но идет и в других тканях.

Реакции синтеза фосфолипидов
с использованием 1,2-ДАГ на примере фосфатидилхолина
2 путь – основной, синтез de novo
Здесь холин (или этаноламин) не встраиваются в готовом виде, а образуются уже в молекуле фосфолипида.
Активация фосфатидной кислоты заключается в присоединении к ней ЦМФ с образованием ЦДФ-ДАГ. Далее к нему присоединяется шестиатомный спирт инозитол или серин с образованием фосфатидилинозитола и фосфатидилсерина. Синтезированный фосфатидилсерин подвергается декарбоксилированию с образованием фосфатидилэтаноламина. Последний метилируется при участии S-аденозилметионина в фосфатидилхолин.
Реакции синтеза фосфолипидов
с использованием фосфатидной кислоты
Путь – обратное превращение
Между фосфатидилэтаноламином и серином может происходить реакция с образованием в результате реакции фосфатидилсерина и свободного этаноламина.
Липотропные вещества
Все вещества, способствующие синтезу ФЛ и препятствующие синтезу ТАГ, и способные предотращать жировую инфильтрацию печени, называются липотропными факторами. К ним относятся:
1. Структурные компоненты фосфолипидов: полиненасыщенные жирные кислоты, инозитол, серин, холин, этаноламин.
2. Метионин – в виде S-аденозилметионина является донором метильных групп для синтеза холина и фосфатидилхолина.
3. Витамины:
· пиридоксин (В6), способствующий образованию ФЭА из ФС.
· цианкобаламин (В12) и фолиевая кислота, участвующие в реакциях обмена серина, глицина и метионина при ресинтезе метионина из гомоцистеина. Следовательно они, хотя и не напрямую, но необходимы для синтеза фосфатидилхолина.
Из другого сайта: Синтез фосфолипидов. Сейчас рассматриваются два пути синтеза фосфолипидов.
· a. По одному пути 1,2-ДАГ не превращается в ТАГ, а связывается с этаноламином с образованием фосфатидилэтаноламина, либо с холином – образуется фосфатидилхолин.
· b. По другому пути, ЦДФ-ДАГ связывается либо с инозитолом, либо с серином с образованием соответственно фосфатидилинозитола или фосфатидилсерина. При декарбоксилировании фосфатидилсерина далее образуется фосфатидилэтаноламин, который может превратиться, в свою очередь, в фосфатидилхолин.
· Синтезированный любым способом фосфатидилэтаноламин также способен взаимодействовать с серином и обратно образовывать фосфатидилсерин. ЦДФ-ДАГ, являясь активной формой фосфатидной кислоты, способен превращаться не только в фосфатидилинозитол, фосфатидилсерин, но и в другие фосфолипиды, например в кардиолипин.
· Наиболее простым глицерофосфолипидом является фосфатидная кислота. Это фосфолипиды клеточных мембран и жировых эмульсий.
· Фосфатидилсерин (ФС), фосфатидилэтаноламин (ФЭА, кефалин), фосфатидилхолин (ФХ, лецитин) – структурные ФЛ, вместе с холестерином формируют липидный бислой клеточных мембран, обеспечивают активность мембранных ферментов, вязкость и проницаемость мембран. Также фосфатидилхолин, являясь одним из важнейших компонентов желчи, поддерживает находящийся в ней холестерин в растворенном состоянии и, таким образом, препятствует образованию желчных камней.
15. Гормональная регуляция липолиза и липогенеза. Влияние на обмен липидов адреналина, норадреналина, половых гормонов, йодированных гормонов щитовидной железы, инсулина, лактикотропина, простогландинов.
1. Инсулин активирует ферментные системы, ответственные за липогенез и тормозит ферментные системы ответственные за липолиз. Чем больше количество глюкозы в крови, тем больше в крови инсулина, тем больше поступает в адипоцит из крови глюкозы, глицерина и жирных кислот, тем больше образуется внутриклеточного жира. Поэтому избыточное употребление пищевых углеводов влечёт за собой увеличение количества жира в адипоцитах.
2. Еще один гормон, обеспечивающий запасание жира – пролактин (лактотропный гормон). Метаболические эффекты пролактина заключаются в повышении липолитической активности плазмы крови (активация липопротеинлипазы) и перехода жирных кислот в ткани, в усилении реакции инсулина на введение глюкозы. Особенно ярко проявляются эффекты пролактина во время беременности и после родов, когда количество пролактин-синтезирующих клеток в гипоталамусе увеличивается и зачастую это увеличение сохраняется и после родов, что часто вызывает ожирение.
Секреция пролактина подвержена многим регуляторным влияниям. Например, при обезвоживании или гипонатриемии происходит активация системы РААС и образуемый ангиотензин II стимулирует секрецию пролактина. Стимулятором секреции пролактина также является тиреотропин-рилизинг-фактор (тиреолиберин) гипоталамуса. При первичной недостаточности тиреоидных гормонов по механизму обратной отрицательной связи повышается синтез этого фактора в гипоталамусе и происходит (даже вне беременности) повышенная секреция пролактина в кровь. Кроме ожирения, следствием такого явления могут быть галакторея, отсутствие овуляции, аменорея и бесплодие.
3. Гормоны катехоламины: адреналин и норадреналин активируют как липогенез, так и липолиз в адипоцитах. Свое влияние на эти два противоположных процесса катехоламины реализуют через разные адренорецепторы адипоцитов – α2-адренорецепторы и β-адренорецепторы. Действие через α2-адренорецепторы активирует в адипоците липогенез, влияние через β-адренорецепторы – липолиз. α2-Адренорецепторы имеют б о льш е е сродство к катехоламинам, поэтому соединение катехоламинов с β-адренорецепторами происходит только тогда, когда свободных α2-адренорецепторов уже нет. Иными словами, когда концентрация катехоламинов низка, они соединяются с α2-адренорецепторами, поддерживая в адипоците липогенез. При увеличении концентрации (острый стресс) они связываются с β-адренорецепторами, активизируя в адипоците липолиз.
6. Гормоны щитовидной железы повышают активность Na+/К+-АТФазы и повышают потребность клетки в энергии, что решается ускорением катаболизма. Поскольку на обеспечение работы этого фермента (поддержание мембранного потенциала) затрачивается от 40 до 60% всей клеточной АТФ, малейшая его активация резко повышает катаболизм гликогена и триацилглицеролов для восполнения затрат АТФ. Параллельно тиреоидные гормоны снижают активность фосфодиэстеразы, гидролизующей цАМФ и уменьшающей катаболизм. Таким образом, избыточное действие тиреоидных гормонов приводит к снижению массы тела. Общий катаболический эффект тироксина и трийодтиронина присутствует во всех тканях, кроме печени.
Способностью активировать в адипоцитах процесс липолиза обладают также гормоны тестостерон.
Инсулин - Способствует синтезу липидов
-Стимулирует распад глюкозы с образованием ацетил-КоА
-Активирует пентозный цикл, в котором синтезируется НАДФН2
-Активирует ацетил-КоА-карбоксилазу и синтетазу жирных кислот, усиливая синтез жирных кислот
-Стимулирует синтез триацилглицеринов
-Тормозит освобождение жирных кислот в результате активации гликолиза в жировой ткани
-Активирует фосфодиэстеразу цАМФ, что способствует снижению липолиза
-Ингибирует активность тканевой липазы
Простагландины
-Снижают мобилизацию жирных кислот из жировой ткани за счет угнетения аденилатциклазы
-Снижают влияние катехоламинов на аденилатциклазу
Пролактин
-Способствует синтезу липидов в жировой ткани в период грудного вскармливания
Адреналин
-Увеличивает мобилизацию липидов за счет активации аденилатциклазы
Тироксин
-Увеличивает окисление жирных кислот и липолиз жира
Половые гормоны
-Тормозят липогенез
-Способствует перераспределению жира по «буйволовому типу» ожирения
Переваривание холестеридов и всасывание холестерина. Понятие об экзо- и эндогенном ХС.
Холестерин в организме человека бывает 2 видов:
1) холестерин, поступающий с пищей через ЖКТ и называемый экзогенный
2) холестерин, синтезируемый из Ац – КоА - эндогенный.
С пищей ежедневно поступает ≈ 0,2 – 0,5 г, синтезируется ≈ 1 г (почти все клетки за исключением эритроцитов синтезируют холестерин, 80% холестерина синтезируется в печени.)
Взаимоотношения экзо и эндогенного холестерина в определенной степени конкурентные – холестерин пищи ингибирует его синтез в печени.
В составе пищи холестерин находится в основном в виде эфиров. Гидролиз эфиров холестерола происходит под действием холестеролэстеразы. Продукты гидролиза всасываются в составе смешанных мицелл.

Всасывание холестерина происходит в основном в тощей кишке (пищевой холестерин всасывается почти полностью – если в пище его не очень много)
+Всасывание холестерина осуществляется только после эмульгирования эфиров холестерина. Эмульгаторами являются желчные кислоты. Холестеридыгидролизуютсяхолестеринэстеразой поджелудочной железы.




















