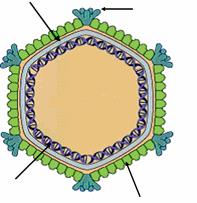
ДНК
Рисунок 14 - Электронная микрофотография и схема строения фагов семейства Plasmaviridae.
Строение фагов семейства Corticoviridae.
Фосфолипидный
 бислой Белок шипов Р2
бислой Белок шипов Р2
ДНК
Белок капсида Р1
Капсид
ДНК
Рисунок 16 - Электронная микрофотография и схема строения фагов семейства Microviridae.
Бактериофаги третьего морфологического типа имеют головку и небольшие выступы или аналоги отростка
Выступы и аналоги отростка отмечаются у представителей семейств
Tectiviridae, Cystoviridae и Leviviridae (рисунки 18-21).
Шипы
 ДНК Капсид
ДНК Капсид
Рисунок 18 - Строение фагов семейства Tectiviridae.
Рисунок 19 - Электронная микрофотография бактериофагов семейства Cystoviridae
Белок внешнего капсида Р8
Белок внешнего
 капсида Р4 Белок оболочки Р6
капсида Р4 Белок оболочки Р6
Белок оболочки Р3
Сегментированная РНК
Суперкапсид
Литический фермент Р5
Белок внутреннего капсида Р1
Полимераза Р2
Рисунок 20 - Схема строения фагов семейства Cystoviridae.
А-белок

+РНК СР-белок
Рисунок 21 – Строение фагов семейства Leviviridae.
Бактериофаги четвертого морфологического типа содержат головку и короткий отросток
К бактериофагам четвертого морфологического типа относятся представители семейства Podoviridae и Fuselloviridae (рисунки 23 и 24).
 ДНК Капсид
ДНК Капсид
Хвост
Фибриллы
Рисунок 23 - Электронная микрофотография и схема строения фагов семейства Podoviridae
Интеграза Хвост
ДНК
Капсид
 схема строения фагов семейства Fuselloviridae.
схема строения фагов семейства Fuselloviridae.
Бактериофаги пятого морфологического типа состоят из головки и длинного отростка, чехол которого не способен сокращаться
К пятому морфологическому типу относятся бактериофаги семейства
Siphoviridae (рисунок 26).
 Головка
Головка
Д
схема строения фагов семейства Siphoviridae.
Шестой морфологический тип объединяет бактериофаги, состоящие из головки и отростка, окруженного чехлом. Особенностью бактериофагов этого типа является то, что чехол, окружающий отросток, способен сокращаться
Представителями шестого морфологического типа являются бактериофаги, относящиеся к семейству Myoviridae
ДНК
Хвост
Шипы
Головка
 Фибриллы
Фибриллы
схема строения фагов семейства Myoviridae.
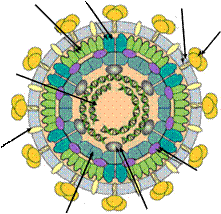
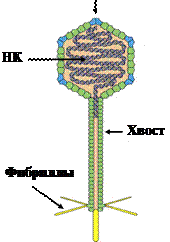
Типичная фаговая частица состоит из головки и хвостового отростка. Длина хвостового отростка обычно в 2-4 раза больше диаметра головки. Размеры бактериофагов колеблются от 2 до 200 нм. Чем крупнее бактериофаги, тем больше у них генов и сложнее их жизненный цикл. Большинство бактериофагов напоминают сперматозоиды (головастики, барабанные палочки), то есть относятся к шестому морфологическому типу.
Головка фага имеет округлую или овальную форму диаметром 60-95 нм. Внутри головки содержится геном бактериофага, представленный нуклеиновой кислотой. Нуклеиновые кислоты бактериофагов могут быть однонитевыми, двунитевыми, линейными, кольцевыми. У большинства фагов геном образует спирально упакованная двойная нить ДНК. У некоторых фагов в головке находится белок, обеспечивающий суперспирализацию молекулы ДНК. В таком виде ДНК может упаковываться в сравнительно небольшом объёме головки. Нуклеиновая кислота бактериофага окружена белковой оболочкой - капсидом. Капсид состоит из белковых молекул (капсомеров), организованных по принципу кубической симметрии. Нуклеиновая кислота и капсид вместе составляют нуклеокапсид.
Хвостовой отросток бактериофагов организован по принципу спиральной симметрии. Отросток имеет длину до 250 нм и толщину 10-25 нм. Он состоит из полого стержня и сократительного чехла, который присоединяется к воротничку, окружающему стержень около головки. Белковый стержень является продолжением белковой оболочки головки. Стержень заканчивается шестиугольной базальной пластинкой с шестью шипами (зубцами). От каждого зубца отходит по одной нити (фибриллы) длиной 150 нм. У Т-чётных фагов концы фибрилл опущены вниз, а у нечётных фагов концы нитей загнуты вверх. Базальная пластинка и нити обусловливают адсорбцию бактериофага на бактериальной клетке. У некоторых бактериофагов в дистальной части хвостового отростка содержится лизоцим (эндолизин), облегчающий проникновение нуклеиновой кислоты бактериофага в бактериальную клетку. Строение бактериофага представлено на рисунке 29.
 Головка
Головка
Воротничок
Лизис Лизогения
Рисунок 40 - Схема продуктивного и интегративного путей развития фага.
Некоторые умеренные фаги могут быть дефектными, то есть неспособными образовывать зрелые фаговые частицы ни в естественных условиях, ни при индукции профага.
Фаг
Образование трансдуцирующего фага
Образование трансдуктанта
Рисунок 43 – Схема трансдукции.
Введенная ДНК клетки-донора наделяет клетку-реципиент (трансдуктант) новыми признаками.
При специфической трансдукции фаги переносят только определенные гены клетки-донора. Это связано с тем, что при специфической трансдукции образование трансдуцирующего фага происходит в результате соединения его ДНК со строго определенными генами донора. При освобождении такой фаг захватывает только рядом расположенную строго определенную область хромосомы донора и передает ее реципиенту. В последующем наблюдается интеграция умеренного фага в определенный участок генома реципиента. При этом происходит не только лизогенизация, но и появление у реципиента нового признака (лизогенная конверсия). Например, умеренный фаг способен вызывать лизогенную конверсию дифтерийной палочки, превращая нетоксигенную культуру в токсигенную.
В некоторых случаях переносимый фрагмент ДНК не встраивается в геном реципиента, а сохраняется автономно в цитоплазме клетки. Это явление называется абортивной трансдукцией. При делении бактерий фаговая ДНК передается только одной из двух дочерних клеток.
При трансдукции возможен перенос генов, которые детерминируют питательные потребности бактерий, устойчивость клеток к лекарственным препаратам, ферментативную активность, подвижность, факторы патогенности и другие свойства.
Практическое применение бактериофагов
Способность бактериофагов лизировать клетки определенных видов бактерий позволяет использовать их для диагностики, профилактики и лечения инфекционных заболеваний. Бактериофаги применяют для установления источника инфекции, путей передачи возбудителя, для выявления определенных видов бактерий во внешней среде, при проведении генно-инженерных исследований.
Фагодиагностика. Бактериофаги используются при диагностике
сибирской язвы, брюшного тифа, дизентерии и других инфекционных заболеваний. Высокая чувствительность бактерий к специфическому фагу позволяет отличить близкородственные виды, (возбудителя чумы от возбудителя псевдотуберкулеза, холерный вибрион от холероподобного). С помощью бактериофагов можно опреде- лить типы (варианты) внутри одного вида бактерий (измененные штаммы бруцелл и сибиреязвенного микроба).
При проведении фагодиагностики культивирование бактерий осуществляют на плотной или в жидкой питательных средах. Размножение фагов в бактериальных культурах на плотных питательных средах сопровождается лизисом бактерий и образованием зон просветления (стерильных пятен, бляшек или негативных колоний). Разные фаги формируют негативные колонии определенных размеров и формы. Размножение бактериофагов в жидких культурах сопровождается просветлением среды, бывшей перед заражением фагом мутной.
В лабораториях применяют несколько методов выявления специфического действия фагов:
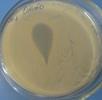
1. Метод Отто (метод стекающей капли) используется для идентификации неизвестных бактерий с помощью известных диагностических фагов (фагоидентификация, фаготипирование). Для выполнения этого метода на чашку с МПА наносится капля суточной бульонной культуры и шпателем круговыми движениями распределяется по поверхности агара. Затем наносится капля суспензии известного бактериофага и наклоном чашки дают капле стечь по поверхности агара. Посевы инкубируют в термостате в течение суток, после чего учитывают результаты. При соответствии фага и бактерий в месте нанесения диагностического фага наблюдается отсутствие роста культуры (рисунок 44).
| Рисунок 44 - Фагоидентификация бактерий по методу Отто.
|
|
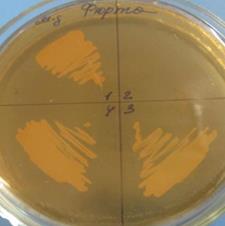
| Рисунок 45 – Фаготипирование бактерий по методу Фишера.
| 
|
2. Метод Фишера также используется для идентификации неизвестных бактерий с помощью известных фагов. Для выполнения этого метода каплю испытуемой суточной бульонной культуры наносят на МПА и шпателем распределяют по поверхности агара. Затем чашку условно делят на квадраты. В каждый квадрат наносят по капле суспензий разных фагов. После суточного культивирования в термостате учитывают результаты. При соответствии бактерий и фага обнаруживаются зоны лизиса (рисунок 45).
3. Метод Фюрта также используется для типирования неизвестных бактерий с помощью известных фагов. При выполнении этого метода в расплавленный и остуженный до 45-50ОС МПА добавляют суспензию известного бактериофага и тщательно перемешивают. Полученную смесь разливают в чашки Петри. Каждую чашку условно делят на несколько секторов, в которые высевают штрихом исследуемые культуры. Чашки инкубируют в термостате, после чего учитывают результаты. Рост культуры будет отсутствовать в том секторе, в котором бактерии и фаг соответствуют друг другу (рисунок 46).
Рисунок 46 – Фагоидентификация бактерий по методу Фюрта.
Фаготипирование используют также для выявления источника и путей распространения инфекции (эпидемиологическое маркирование). При этом выделение бактерий одного фаговара от разных больных указывает на общий источник их заражения.
Санитарно-показательное значение бактериофагов. По содержанию некоторых бактериофагов во внешней среде можно судить о присутствии в них соответствующих бактерий. Например, наличие фагов кишечных бактерий свидетельствует о фекальном загрязнении объектов внешней среды. Поэтому бактериофаги кишечных бактерий используются в качестве санитарно- показательных микроорганизмов (СПМ). Во внешней среде бактериофаги выжи-
вают в течение 8-9 месяцев, поэтому их обнаруживают как при свежем фекальном загрязнении, так и после отмирания бактерий кишечной группы. При этом одновременное обнаружение фага и кишечной палочки указывает на свежее фе- кальное загрязнение, а обнаружение одного фага - на давнее фекальное загрязнение.
При исследовании питьевой воды определяют присутствие и количество колифагов – фагов, лизирующих кишечные палочки рода Escherichia. Колифаги являются индикаторами загрязнения воды патогенными энтеровирусами и очистки питьевой воды от энтеровирусов. Для определения количества колифагов определенное количество питьевой воды смешивают с расплавленным питательным агаром и культурой кишечной палочки. Смесь разливают в чашки Петри и инкубируют в термостате. Через 72 часа учитывают зоны лизиса, образовавшиеся на сплошном газоне Е. coli. Результаты выражают в бляшкообразующих единицах (БОЕ) на 100 см3 воды.
Индикация бактерий с помощью реакции нарастания титра фага. Присутствие каких-либо микроорганизмов в исследуемой пробе (вода, пищевые продукты) можно установить с помощью бактериофагов. Этот прием основан на специфичности действия бактериофагов: бактериофаг E. coli лизирует только кишечную палочку, холерный бактериофаг вызывает лизис только холерного вибриона и т. д. Для установления присутствия определенных бактерий в исследуемую пробу добавляют известное количество специфического фага. При наличии гомологичных бактерий фаг размножается, в результате чего нарастает его титр (количество). Следовательно, реакция нарастания титра фага основана на увеличении количества фага при его контакте с возбудителем непосредственно в исследуемом материале.
Реакцию нарастания титра фага используют при диагностике дизентерии и брюшного тифа, для выявления бактерионосительства при брюшном тифе, для обнаружения брюшнотифозных и дизентерийных бактерий в воде и молоке, для обнаружения дизентерийных микробов на предметах внешней среды, для выявления чумного микроба и холерного вибриона в воде.
Фагопрофилактика – это предупреждение бактериальных инфекций путем применения бактериофагов. В профилактических целях бактериофаг используется в тех случаях, когда возбудитель известен. Фагопрофилактика проводится в комплексе с другими методами. В настоящее время по эпидемическим показаниям фагопрофилактику проводят только при дизентерии и брюшном тифе. Фагопрофилактика имеет ряд преимуществ: возможность использования в больших количествах, быстрота действия, легкость введения, полная безвредность.
Фаготерапия – это способ лечения некоторых бактериальных инфекций (брюшного тифа, дизентерии, холеры и др.) специфическими бактериофагами. При использовании бактериофагов в лечебных целях предварительно определяют чувствительность возбудителей к данному бактериофагу. В настоящее время применение фагов с лечебной целью проводится редко. Это связано с широким применением антибиотиков и возрастанием количества фагоустойчивых бактерий.
При лечении часто используют смесь из разных фагов: против протея, кишечной палочки и энтерококка; против синегнойной палочки и других гноеродных микробов. Поливалентные препараты могут включать бактериофаги
против различных вариантов бактерий одного вида (например, против пяти серологических групп сальмонелл).
Для профилактического и терапевтического применения бактериофаги выпускаются в виде таблеток, жидких форм и др. (рисунок 47).
Генная инженерия. Трансдуцирующие фаги широко используются в генной инженерии. В частности, феномен неспецифической трансдукции применяется для картирования генома бактерий.
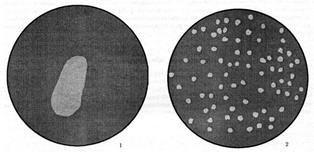
Выделение бактериофагов. Бактериофаги выделяют из субстратов, контаминированных бактериями, или из лизогенных бактерий, содержащих профаг. В качестве субстрата используют отделяемое гнойных ран, испражнения, сточные воды, старые бактериальные культуры. Для индукции профага на бактериальную культуру воздействуют химическими веществами или физическими факторами (митомицином С, УФЛ, ионизирующим излучением и др.). Индуцированный профаг обусловливает синтез фаговых частиц и вызывает лизис бактериальных клеток. После этого суспензию субстратов (или лизат бактериальной культуры) фильтруют через мелкопористые фильтры или центрифугируют. Полученный фильтрат (центрифугат) исследуют на способность лизировать чувствительные бактерии. С этой целью фильтрат наносят на плотную или вносят в жидкую питательную среду, засеянную бактериями, в которых способен размножаться фаг. О присутствии фага судят по лизису бактериальной культуры. На плотных питательных средах фаги обнаруживаются либо с помощью спот-теста (анг. spot – пятно), либо методом агаровых слоев по А. Грациа (рисунок 49).
| Обнаружение бактериофагов в исследуемом материале: 1 – спот-тест; 2 – титрование по Грациа.
| 
|
При проведении спот-теста (капельного теста) на поверхность агара в чашке Петри высевают бактериальную культуру, а затем на нее наносят каплю суспензии бактериофага. В месте нанесения фага бактериальная культура лизируется и образуется стерильное пятно. Иногда каплю суспензии бактериофага наносят ближе к краю чашки, а затем чашку наклоняют, позволяя фаговой суспензии стечь по поверхности агара. В этом случае роста бактериальной культуры не будет в виде “ фаговой дорожки ”.
Метод агаровых слоев по Грациа (A. Gratia, 1936) используется как для выделения фага, так и для определения его титра. При выполнении этого метода в чашку Петри наливают слой МПА. После застывания на этот слой наливают 2 мл расплавленного и охлажденного до 45ОС полужидкого (0,7%) агара, в который предварительно добавляют каплю бактериальной суспензии и определенный объем суспензии фага. После застывания верхнего слоя агара чашку инкубируют в термостате при температуре 37ОС в течение 18-24 часов (рисунок 50).
Бактерии размножаются внутри верхнего слоя агара, образуя сплошной непрозрачный фон, на котором хорошо видны негативные колонии фага в виде стерильных пятен. Считается, что каждая негативная колония образуется за счет размножения одной фаговой частицы. Метод Грациа позволяет рассчитывать концентрацию (титр) фага в исходной суспензии.

Рисунок 50 – Определение количества фаговых частиц методом агаровых
слоев по Грациа.
Количества фаговых частиц выражают в бляшкообразующих единицах
(БОЕ/мл). Титр фага в исходной суспензии рассчитывают по формуле:
N = y/vx,
где: N - титр фага;
y - количество негативных колоний;
v - объем использованного фильтрата фага; х - разведение суспензии фага.
Например, если 0,1 мл фильтрата фага в разведении 10-5 образует 250 негативных колоний, то титр равен 250:0,1 x 10-5 = 2,5 x 108 БОЕ/мл.
При использовании жидкой питательной среды проводят титрование по методу Аппельмана. В этом случае готовят серию десятикратных разведений фильтрата бактериофага и определенное количество разведений вносят в свежезасеянный бульон. Максимальное разведение фильтрата, вызывающее полный лизис бульонной культуры чувствительных бактерий, принимается за титр бактериофага.
Получение фаговой суспензии с высоким титром производится путем инфицирования концентрированной жидкой бактериальной культуры или путем высева смеси фага и бактерий на питательный агар. В последующем фаги освобождают от остатков питательной среды и бактериальных клеток центрифугированием или фильтрованием через бумажные фильтры. Получаемая при этом суспензия фага может содержать до 1011-1012 фаговых частиц в 1 мл.
Большие количества фага получают путем добавления в аппараты с бульонными культурами бактерий суспензии специального производственного фага, выдерживают при температуре 37°С одни сутки, затем фильтруют. Полученный фильтрат проверяют на чистоту, стерильность, безвредность и активность.
Реакция фаголизиса
Реакция фаголизиса применяется для идентификации выделенной чистой культуры бактерий по фагочувствительности. Реакцию ставят в двух пробирках: №1 (опыт) и №2 (контроль). Реакция фаголизиса изучаем на примере идентификации выделенной чистой культуры S.sonnei из испражнения при подозрении на дизентерию.

Посевы инкубируют в термостате 18-24 часов при 370 С.
При наблюдении за посевами впервые часы бульон в пробирках слегка мутнеет вследствие размножения бактерий. В дальнейшем в контрольной пробирке (без бактериофага) помутнение усиливается; в пробирке с бактериофагом через 6 часов происходит просветление в результате лизиса бактерий. Учет реакции проводятся по просветлению МПБ в результате лизируещего действия монофага на бактерии.
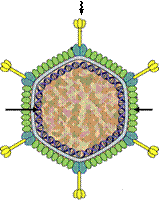
ДНК
Рисунок 14 - Электронная микрофотография и схема строения фагов семейства Plasmaviridae.
Строение фагов семейства Corticoviridae.
Фосфолипидный
 бислой Белок шипов Р2
бислой Белок шипов Р2
ДНК
Белок капсида Р1
Капсид
ДНК
Рисунок 16 - Электронная микрофотография и схема строения фагов семейства Microviridae.
Бактериофаги третьего морфологического типа имеют головку и небольшие выступы или аналоги отростка
Выступы и аналоги отростка отмечаются у представителей семейств
Tectiviridae, Cystoviridae и Leviviridae (рисунки 18-21).
Шипы
 ДНК Капсид
ДНК Капсид
Рисунок 18 - Строение фагов семейства Tectiviridae.
Рисунок 19 - Электронная микрофотография бактериофагов семейства Cystoviridae
Белок внешнего капсида Р8
Белок внешнего
 капсида Р4 Белок оболочки Р6
капсида Р4 Белок оболочки Р6
Белок оболочки Р3
Сегментированная РНК
Суперкапсид
Литический фермент Р5
Белок внутреннего капсида Р1
Полимераза Р2
Рисунок 20 - Схема строения фагов семейства Cystoviridae.
А-белок

+РНК СР-белок
Рисунок 21 – Строение фагов семейства Leviviridae.
Бактериофаги четвертого морфологического типа содержат головку и короткий отросток
К бактериофагам четвертого морфологического типа относятся представители семейства Podoviridae и Fuselloviridae (рисунки 23 и 24).
 ДНК Капсид
ДНК Капсид
Хвост
Фибриллы
Рисунок 23 - Электронная микрофотография и схема строения фагов семейства Podoviridae
Интеграза Хвост
ДНК
Капсид
 схема строения фагов семейства Fuselloviridae.
схема строения фагов семейства Fuselloviridae.
Бактериофаги пятого морфологического типа состоят из головки и длинного отростка, чехол которого не способен сокращаться
К пятому морфологическому типу относятся бактериофаги семейства
Siphoviridae (рисунок 26).
 Головка
Головка
Д
схема строения фагов семейства Siphoviridae.
Шестой морфологический тип объединяет бактериофаги, состоящие из головки и отростка, окруженного чехлом. Особенностью бактериофагов этого типа является то, что чехол, окружающий отросток, способен сокращаться
Представителями шестого морфологического типа являются бактериофаги, относящиеся к семейству Myoviridae
ДНК
Хвост
Шипы
Головка
 Фибриллы
Фибриллы
схема строения фагов семейства Myoviridae.
Типичная фаговая частица состоит из головки и хвостового отростка. Длина хвостового отростка обычно в 2-4 раза больше диаметра головки. Размеры бактериофагов колеблются от 2 до 200 нм. Чем крупнее бактериофаги, тем больше у них генов и сложнее их жизненный цикл. Большинство бактериофагов напоминают сперматозоиды (головастики, барабанные палочки), то есть относятся к шестому морфологическому типу.
Головка фага имеет округлую или овальную форму диаметром 60-95 нм. Внутри головки содержится геном бактериофага, представленный нуклеиновой кислотой. Нуклеиновые кислоты бактериофагов могут быть однонитевыми, двунитевыми, линейными, кольцевыми. У большинства фагов геном образует спирально упакованная двойная нить ДНК. У некоторых фагов в головке находится белок, обеспечивающий суперспирализацию молекулы ДНК. В таком виде ДНК может упаковываться в сравнительно небольшом объёме головки. Нуклеиновая кислота бактериофага окружена белковой оболочкой - капсидом. Капсид состоит из белковых молекул (капсомеров), организованных по принципу кубической симметрии. Нуклеиновая кислота и капсид вместе составляют нуклеокапсид.
Хвостовой отросток бактериофагов организован по принципу спиральной симметрии. Отросток имеет длину до 250 нм и толщину 10-25 нм. Он состоит из полого стержня и сократительного чехла, который присоединяется к воротничку, окружающему стержень около головки. Белковый стержень является продолжением белковой оболочки головки. Стержень заканчивается шестиугольной базальной пластинкой с шестью шипами (зубцами). От каждого зубца отходит по одной нити (фибриллы) длиной 150 нм. У Т-чётных фагов концы фибрилл опущены вниз, а у нечётных фагов концы нитей загнуты вверх. Базальная пластинка и нити обусловливают адсорбцию бактериофага на бактериальной клетке. У некоторых бактериофагов в дистальной части хвостового отростка содержится лизоцим (эндолизин), облегчающий проникновение нуклеиновой кислоты бактериофага в бактериальную клетку. Строение бактериофага представлено на рисунке 29.
 Головка
Головка
Воротничок



 бислой Белок шипов Р2
бислой Белок шипов Р2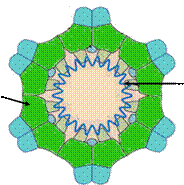
 ДНК Капсид
ДНК Капсид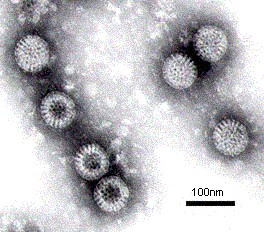
 капсида Р4 Белок оболочки Р6
капсида Р4 Белок оболочки Р6
 ДНК Капсид
ДНК Капсид схема строения фагов семейства Fuselloviridae.
схема строения фагов семейства Fuselloviridae. Головка
Головка Фибриллы
Фибриллы Головка
Головка