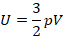Итак, какие инструменты мы получили? Основной инструмент один – уравнение состояния идеального газа. А все остальное – это запись этого же уравнения в более удобных формах для решения той или иной задачи. Если мы имеем дело с неизменной массой газа (то есть нет утечек), то три параметра состояния связаны уравнением Клапейрона. А если при этом еще и остается неизменным один из параметров состояния, применяем уравнение для изотермического, изобарного или изохорного процесса, их еще называют газовыми законами. Применим наши инструменты, решив несколько задач.
Задача 2. При сжатии воздуха в цилиндре дизельного двигателя объем воздуха уменьшается в 15 раз, а температура повышается от 47 до 620 ˚С. Каково давление воздуха в конце сжатия, если в начале сжатия давление воздуха было равно атмосферному (100 кПа)?
Анализ условия. В задаче описано изменение состояния воздуха, будем его описывать с помощью модели идеального газа – температура сотни градусов по Цельсию это позволяет. Состояние газа описано тремя макропараметрами (давлением, температурой и объемом), причем изменяются все три макропараметра, это не изопроцесс. При этом ничего об утечках воздуха из цилиндра ничего не сказано, значит, количество воздуха не изменяется. Будем применять уравнение Клапейрона.
Физическая часть решения. Запишем уравнение в виде, удобном для описания перехода из состояния 1 в состояние 2:
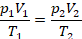
Температуры заданы (нужно только перевести их в кельвины), давление тоже. Что сказано об объеме – перепишем условие в математическом виде. Объем уменьшился в 15 раз, это значит, что в состоянии 2 объем в 15 раз меньше, чем в состоянии 1:
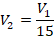
Получили простую систему уравнений, решим ее – это будет математическая часть решения. Подставим второе давление:
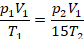
Выразим давление во втором состоянии:


Получили ответ: 4,2 МПа (или 42 атмосферы).
Задача 3. После повышения температуры на 15 К давление газа в закрытом баллоне увеличилось на 3 %. Какой была начальная температура?
Анализ условия. В задаче описано изменение состояния газа. За неимением другой информации будем применять модель идеального газа. Речь идет о закрытом баллоне. Это значит, во-первых, что масса газа постоянна, а, во-вторых, баллоны обычно жесткие, значит, и объем не изменяется. Поэтому можем описать процесс как изохорный.
Физическая часть решения. Запишем уравнение для изохорного процесса:
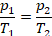
Перепишем условие в математическом виде, чтобы можно было подставлять в уравнение. Температура увеличилась на 15 К, значит,  .
.
А давление увеличилось на 3 %, это по-другому можно записать:

Физика здесь закончилась на выборе закона, которым описывать процесс, осталось подставить переписанные величины и решить уравнение:
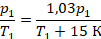

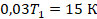

Нашли начальную температуру, она равна 500 К. Или, в более привычных для нас градусах Цельсия, 227 ˚С.
Часто бывает удобно выразить зависимость одного параметра от другого в виде графиков. Это наглядно, помогает лучше представить себе процесс, а иногда по графикам можно оценить численные значения. Начертим графики зависимостей параметров газа и разберемся, какую информацию можно из них получить. Начнем с изотермического процесса, 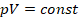 .
.
Чтобы начертить график зависимости давления от объема, нужно переписать уравнение в виде 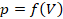 :
:

Это обратно пропорциональная зависимость типа 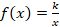 , и ее график имеет вид гиперболы (см. рис. 3).
, и ее график имеет вид гиперболы (см. рис. 3).

Рис. 3. Изотермический процесс на графике зависимости давления от температуры
От константы зависит расположение кривой: чем больше константа, тем выше располагается график. А вы помните, что константа содержит температуру, в промежуточном варианте уравнение выглядело так:
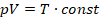
Так что если у нас есть две изотермы для одной и той же массы газа, значит, каждая изотерма описывает процесс, при котором температура постоянна. Но в первом случае эта постоянная температура равна 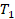 , которая меньше, чем постоянная температура во втором случае
, которая меньше, чем постоянная температура во втором случае 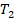 (см. рис. 3).
(см. рис. 3).
Графики двух остальных изопроцессов мы будем рассматривать в координатах  и
и  , поэтому сразу рассмотрим и изотермический процесс в этих координатах. Начертим график (см. рис. 4) изотермы в координатах
, поэтому сразу рассмотрим и изотермический процесс в этих координатах. Начертим график (см. рис. 4) изотермы в координатах  .
.
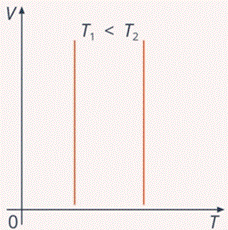
Рис. 4. Изотермический процесс на графике зависимости 
Температура не меняется, значит, графики будут перпендикулярны оси Т, а объем при этой температуре приобретает разные значения. И легко определить по оси Т, какая изотерма соответствует большей температуре. На этом графике не видно, как изменяется давление, но мы понимаем, что давление увеличивается при уменьшении объема, что соответствует движению точки на графике вниз.
Аналогично выглядят графики изотермического процесса в координатах  : температура постоянна, температура для второго процесса больше, чем для первого. А давление изменяется при изменении объема, которого на графике явно не видно, но можно понять по изменению давления (см. рис. 5).
: температура постоянна, температура для второго процесса больше, чем для первого. А давление изменяется при изменении объема, которого на графике явно не видно, но можно понять по изменению давления (см. рис. 5).

Рис. 5. Изотермический процесс на графике зависимости 
Теперь рассмотрим изобарный процесс.
Представим в виде зависимости  :
:

Это прямо пропорциональная зависимость вида  , ее график – прямая, которая начинается в точке начала координат (см. рис. 6).
, ее график – прямая, которая начинается в точке начала координат (см. рис. 6).
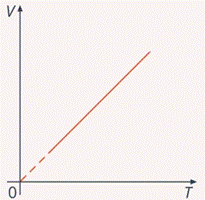
Рис. 6. График зависимости  для изобарного процесса
для изобарного процесса
Коэффициентом перед  определяется крутизна графика. Там у нас стоит константа, которая содержит давление, вспомните промежуточное уравнение, полученное из уравнения Клапейрона:
определяется крутизна графика. Там у нас стоит константа, которая содержит давление, вспомните промежуточное уравнение, полученное из уравнения Клапейрона:
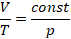
Там давление в числителе, поэтому чем больше давление, тем меньше коэффициент пропорциональности на графике и тем ниже располагается график. Поэтому у двух процессов, происходящих с одной и той же массой газа при разных давлениях:  .
.

Рис. 7. График зависимости  для двух изобарных процессов при разных давлениях
для двух изобарных процессов при разных давлениях
Начертим графики изобары в двух других системах координат. В координатах  найдем на оси
найдем на оси  нужное нам давление и горизонтальной прямой покажем, что при любом изменении объема
нужное нам давление и горизонтальной прямой покажем, что при любом изменении объема  оно не изменяется. При другом давлении это будет такая же прямая, только выше или ниже (см. рис. 8).
оно не изменяется. При другом давлении это будет такая же прямая, только выше или ниже (см. рис. 8).
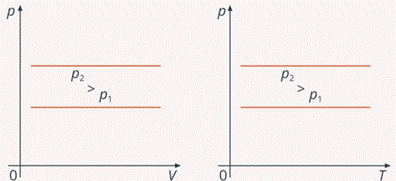
Рис. 8. Графики зависимости 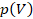 и
и  для изобарного процесса
для изобарного процесса
Аналогично выглядят графики изобар в координатах  : при любом значении температуры давление остается постоянным.
: при любом значении температуры давление остается постоянным.
И последним рассмотрим изохорный процесс:
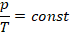
Представим в виде зависимости  :
:

Это тоже прямо пропорциональная зависимость вида  , с графиком – прямой, крутизна которой определяется коэффициентом перед переменной
, с графиком – прямой, крутизна которой определяется коэффициентом перед переменной  , а в нашем случае –
, а в нашем случае – 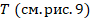 .
.
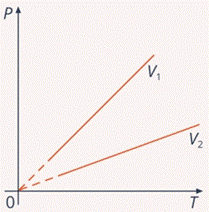
Рис. 9. График зависимости  для изохорного процесса
для изохорного процесса
Этот коэффициент определяется объемом, при котором протекает изохорный процесс, и чем объем меньше, тем коэффициент больше и график круче:

Графики, описывающие изохорные процессы при разных объемах, в координатах 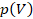 и
и  , начертите самостоятельно. И напоследок поговорим о границах применимости моделей.
, начертите самостоятельно. И напоследок поговорим о границах применимости моделей.
Мы подробно обсудили, что в реальности нельзя абсолютно точно сохранять неизменными температуру, давление или объем при изопроцессах. Но даже в этом приближении модель работает с ограничениями. В уравнение, например  , мы можем подставить любое значение температуры и получить соответствующее значение объема. Но вспомните: мы изначально всю эту модель строили на модели идеального газа. Это работает при привычных нам температурах, близких к комнатной, и более высоких, используемых в технике, и при давлениях, близких к атмосферному.
, мы можем подставить любое значение температуры и получить соответствующее значение объема. Но вспомните: мы изначально всю эту модель строили на модели идеального газа. Это работает при привычных нам температурах, близких к комнатной, и более высоких, используемых в технике, и при давлениях, близких к атмосферному.
Но реальный газ нельзя, например, охлаждать до сколь угодно малых температур, чтобы он сжимался до сколь угодно малого объема. В какой-то момент размеры молекул не будут уже пренебрежимо малыми по сравнению с расстояниями между ними, а это уже не описывается моделью идеального газа. Усилится взаимодействие между молекулами, которым мы изначально пренебрегли, и газ перейдет в состояние жидкости (см. рис. 9).
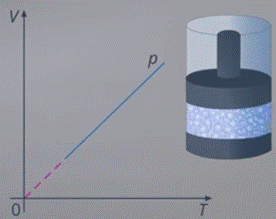
Рис. 9. Границы применимости модели идеального газа
Конечно, это не значит, что физика здесь больше не работает. Если нужно рассмотреть состояние жидкости, это тоже можно сделать: у нее тоже можно измерить температуру, рассмотреть изменение объеме при сжатии – оно будет небольшим. Только это будет другая модель с другими инструментами ее описания.
Внутренняя энергия
Когда закипает закрытая кастрюля с водой, то можно увидеть, как приподнимается крышка – с увеличением температуры возрастает давление водяного пара внутри кастрюли. Воздушный шар поднимается вверх, когда горелка нагревает воздух внутри купола и давление внутри становится выше, чем снаружи. Сдавливая надутый воздушный шарик, мы увеличиваем давление воздуха внутри него, уменьшая при этом объем, который он занимает. Это общие наблюдения, которые позволяют сделать выводы: как связаны три основные характеристики газа – давление, температура и объем.
Но чтобы сконструировать механизм или решить прикладную задачу, нужно уметь точно рассчитать характеристики газа при заданных условиях. Для этого мы предположили (а затем подтвердили экспериментально), что вещество состоит из атомов и молекул, которые хаотично движутся. Движение мы умеем описывать с помощью инструментов механики – массы, скорости, импульса, энергии.
Когда летит рой пчел, то движение каждой пчелы по отдельности может быть разным, но все вместе они движутся как единый объект, для которого можно ввести обобщенные характеристики – скорость роя, среднюю температуру и т. д.Молекул много, описывать движение каждой, а потом суммировать полученные результаты не получится. Поэтому мы ввели усредненные характеристики газа: среднюю энергию, среднее количество ударов молекул о стенки сосуда и т. д.
Температуру газа (характеристику, которую мы можем непосредственно измерить) мы определили через среднюю кинетическую энергию движения молекул:

Энергия – это наш инструмент для описания превращений: нечто, что сохраняется и переходит из одного вида в другой.Сначала мы рассматривали закон сохранения механической энергии – то есть сохранения и превращения энергии в системе, в которой действуют только консервативные силы (силы, работа которых не зависит от вида траектории; работа таких сил определяется только начальным и конечным положением тела).Затем обобщили его: если в замкнутой системе действуют неконсервативные силы, то общая энергия системы все равно будет сохраняться, но механическая энергия может превращаться в другие виды энергии.
При ударе молота о наковальню оба они в месте контакта нагреваются. Нагревание мы описываем увеличением температуры, то есть меры внутренней энергии тела. Внутренняя энергия тела – это суммарная кинетическая энергия движения его частиц. То есть кинетическая энергия движения молота как единого целого (механическая энергия молота) переходит в его внутреннюю энергию – или, как мы говорил раньше, в тепло.
Почему модель механической энергии молота – как единого объекта – нам для описания удара по наковальне не подходит? Если рассматривать только силы, работа которых определяется исключительно начальным и конечным положением тела, то наличие или отсутствие наковальни на пути молота не повлияет на механическую энергию системы (см. рис. 1).
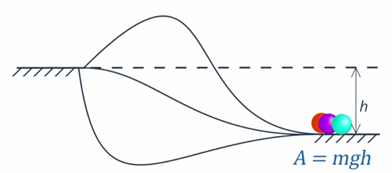
Рис. 1. Работа силы тяжести определяется только начальным и конечным положением тела
Также во время удара произойдет неупругая деформация молота, а это смещение его частей друг относительно друга. Такое смещение в данной модели не учитывается, так как рассматривается положение всего тела как целого. Значит, чтобы описать процессы, которые происходят при ударе, нам нужна другая модель (см. рис. 2).
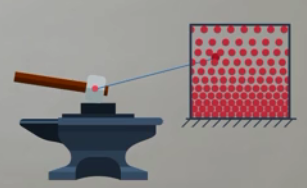
Рис. 2. Энергия взаимодействия молекул
Наша задача – научиться описывать процессы, которые происходят с молекулами вещества количественно.Достаточно ли нам для этого знать температуру вещества (или, что то же самое, среднюю кинетическую энергию молекул)? Внутренняя энергия вещества – это суммарная кинетическая энергия всех молекул. Понятно, что чем больше молекул (с данной средней кинетической энергией), тем больше будет внутренняя энергия.
Вы наверняка замечали, что при повышенной влажности мороз и жара переносятся хуже. Значит, для расчета характеристик газа будет важна не только температура, но и количество вещества (или масса, их можно выразить одно через другое).Исходя из проведенного анализа, выполним расчеты для простейшей модели, с которой мы работали до этого – модели идеального газа. Она удобна тем, что с хорошей точностью описывает реальные процессы и ее несложно описать.
В модели идеального газа мы сделали такое приближение: молекулы не взаимодействуют друг с другом, то есть не обладают потенциальной энергией, а только кинетической. Поэтому внутренняя энергия идеального газа – это суммарная кинетическая энергия всех его молекул.
Если мы взяли некоторое количество газа, которое содержит  атомов, то его внутренняя энергия (обозначим ее
атомов, то его внутренняя энергия (обозначим ее 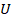 ) равна кинетической энергии одного атома (в среднем), умноженной на количество этих атомов:
) равна кинетической энергии одного атома (в среднем), умноженной на количество этих атомов:
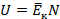
Где 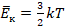 , по определению температуры.
, по определению температуры.

Зная, что в одном моле вещества  молекул, выразим количество молекул:
молекул, выразим количество молекул:

Количество вещества можно для удобства выразить через массу, а произведение двух констант  и
и 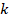 – это газовая постоянная
– это газовая постоянная  :
:
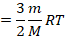
Как видим, внутренняя энергия данной массы идеального газа определяется его температурой. Выражение 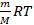 встречается в уравнении Менделеева – Клапейрона, оно равно
встречается в уравнении Менделеева – Клапейрона, оно равно  , так что внутреннюю энергию можно выразить через давление и объем газа:
, так что внутреннюю энергию можно выразить через давление и объем газа:
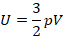
Эти выражения справедливы только для одноатомного идеального газа.
Следующее ответвление, в котором мы рассмотрим внутреннюю энергию двухатомного газа, обязательно к ознакомлению для учеников профильного уровня, для всех остальных – по желанию.



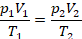
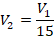
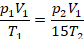


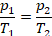
 .
.
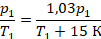

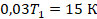

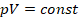 .
.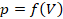 :
:
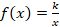 , и ее график имеет вид гиперболы (см. рис. 3).
, и ее график имеет вид гиперболы (см. рис. 3).
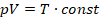
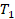 , которая меньше, чем постоянная температура во втором случае
, которая меньше, чем постоянная температура во втором случае 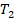 (см. рис. 3).
(см. рис. 3). и
и  , поэтому сразу рассмотрим и изотермический процесс в этих координатах. Начертим график (см. рис. 4) изотермы в координатах
, поэтому сразу рассмотрим и изотермический процесс в этих координатах. Начертим график (см. рис. 4) изотермы в координатах 

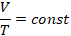
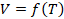 :
:
 , ее график – прямая, которая начинается в точке начала координат (см. рис. 6).
, ее график – прямая, которая начинается в точке начала координат (см. рис. 6).
 определяется крутизна графика. Там у нас стоит константа, которая содержит давление, вспомните промежуточное уравнение, полученное из уравнения Клапейрона:
определяется крутизна графика. Там у нас стоит константа, которая содержит давление, вспомните промежуточное уравнение, полученное из уравнения Клапейрона: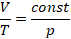
 .
.
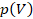 найдем на оси
найдем на оси  нужное нам давление и горизонтальной прямой покажем, что при любом изменении объема
нужное нам давление и горизонтальной прямой покажем, что при любом изменении объема  оно не изменяется. При другом давлении это будет такая же прямая, только выше или ниже (см. рис. 8).
оно не изменяется. При другом давлении это будет такая же прямая, только выше или ниже (см. рис. 8).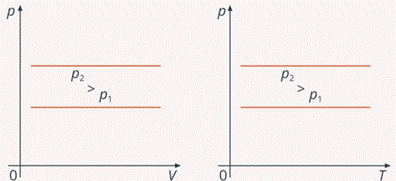
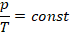
 :
:
 , а в нашем случае –
, а в нашем случае – 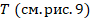 .
.





 атомов, то его внутренняя энергия (обозначим ее
атомов, то его внутренняя энергия (обозначим ее 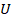 ) равна кинетической энергии одного атома (в среднем), умноженной на количество этих атомов:
) равна кинетической энергии одного атома (в среднем), умноженной на количество этих атомов: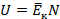
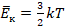 , по определению температуры.
, по определению температуры.
 молекул, выразим количество молекул:
молекул, выразим количество молекул:
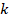 – это газовая постоянная
– это газовая постоянная  :
: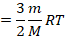
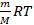 встречается в уравнении Менделеева – Клапейрона, оно равно
встречается в уравнении Менделеева – Клапейрона, оно равно  , так что внутреннюю энергию можно выразить через давление и объем газа:
, так что внутреннюю энергию можно выразить через давление и объем газа: