Синтез сфинголипидов начинается с образования церамида.Серин конденсируется с пальмитиол-КоА. Продукт их взаимодействия сначала восстанавливается коферментом NADPH,затем к амногруппе дигидросфингозина амидной связью присоединяется жирная кислота,содержащая 24 атома углерода.После окисления FAD-зависимой дегидрогеназой образуется церамид.Церамид служит предшественником в синтезе большой группы сфинголипидов:сфингомиелинов,не содержащих углеводов,и гликосфинголипидов.
Последующие реакции синтеза катализируются специфическими трансферазами,набор которых в разных тканях отличается.Соединение фосфорилхолина с церамидом сфингомиелинсинтетазой приводит к образованию сфингомиелина.Присоединение углеводных компонентов катализируется специфическим гликозилтрансферазами.Донорами углеводных компонентов служат активированные сахара:УДФ-галактоза и УДФ-глюкоза.Галактоцереброзид-глав. Липид миелиновых оболочек;глюкоцереброзид входит в состав мемран многих клеток и служит предшественником в синтезе более слож.гликолипидов или продуктом на пути их катаболизма.
Катаболизм сфингомиелина и его нарушения
В лизосомах находятся ферменты,способные гидролизовать любые компоненты клеток.Эти ферменты называют кислыми гидролазами,т.к они активны в кислой среде.Значение pH=5,оптимальное для работы ферментов,создается протонным насосом который,используя энергию АТФ,накачивает ионы водорода в лизосомы.Катаболизм сфингомиелинов и гликолипидов происходит в лизосомах.В распаде сфингомиелинов участвуют 2 фермента-сфингомиелиназа,отщепляющая фосфорилхолин,и церамидаза,продуктами которой являются сфингозин и жирная кислота.
генетический дефект сфингомиелиназы-причина болезни Ниманна-Пика.Дети с таким дефектом погибают в раннем возрасте.Симптомы заболевания:увеличение печени и селезенки(гепатоспленомегалия),в лизосомах которых накапливается сфингомиелин;умственная отсталость.Генетический дефект другого фермента-(церамидазы) приводит к развитию болезни Фарбера,симптомами которой также являются гепато- и спленомегалия,а также поражение суставов(болезненность ии отечность)
Катаболизм гликосфинголипидов.
Катаболизм гликосфинголипидов начинается с перемещением их на поверхности клетки в цитоплазму по механизму эндоцитоза.В результате молекулы,расположенные на поверхности мембран,оказываются в эндоцитозных везикулах в цитоплазме и сливаются с лизосомами.
В лизосомах находятся все ферменты,необходимые для гидролиза сложных молекул гликосфинголипидов: A- и бета-галактозидазы,бета-глюкозидазы,нейроминидаза и церамидаза.В результате последовательных реакций гидролиза сложные молекулы гликосфинголипидов распадаются ьдо мономеров:глюкозы,галактозы,жирной кислоты,сфингозина и др.метаболитов.
генетический дефект лизосомных ферментов катаболизма гликосфинголипидов.
В норме синтез и катаболизм гликосфинголипидов сбалансированы таким образом,что количество этих компонентов в мембранах постоянно.Если имеется генетический дефект какого-либо лизосомного фермента,участвующего в катаболизме гликосфинголипида,то в лизосомах накапливается недополимеризованный субстрат,так наз. «остаточные тельца»,размеры лизосом увеличиваются,их мембрана может разрушаться,ферменты выходят в цитозоль,и функции клеток нарушаются.Генетические заболевания вследствие дефекта какого-л фермента катаболизма гликосфинголипидов называют сфинголипидозами или лизосом.болезнями.Эти заболевания редки,но среди некоторых популяций людей их частота высока.Сфинголипидозы обычно приводят к смерти в раннем возрасте,т.к происходит поражение клеток нервной ткани,где сконцентрированы гликосфинголипиды. Однако при болезнях Гоше и Фабри больные живут относительно долго.
Кетоновые тела.
Кетоновые тела, группа органических соединений (b-оксимасляная кислота, ацетоуксусная кислота, ацетон), образующихся в печени, накапливающихся в крови (кетонемия) и выделяющихся с мочой (кетоурия) при неполном окислении жирных кислот в результате нарушения обмена веществ при голодании и некоторых патологических состояниях, например при сахарном диабете; то же, что ацетоновые тела. Метаболизм кетоновых тел 
Ацетил-КоА
Ацетон в плазме крови в норме присутствует в крайне низких концентрациях, образуется в результате спонтанного декарбоксилирования ацетоуксусной кислоты и не имеет определённого физиологического значения[2] (в сущности являясь токсическим веществом для головного мозга, циркулирует в мизе́рной концентрации).
Нормальное содержание кетоновых тел в плазме крови человека и большинства млекопитающих (за исключением жвачных) составлет 1…2 мг% (по ацетону). При увеличении их концентрации свыше 10…15 мг% они преодолевают почечный порог и определяются в моче. Наличие кетоновых тел в моче всегда указывает на развитие патологического состояния.
Кетоновые тела синтезируются в печени из ацетил-КоА:[2]
На первом этапе из двух молекул ацетил-КоА синтезируется ацетоацетил-КоА. Данная реакция катализируется ферментом ацетоацетил-КоА-тиолазой.
Ac—КоА + Ac—КоА → H3C—CO—CH2—CO—S—КоА
Затем под влиянием фермента гидроксиметилглутарил-КоА-синтазы присоединяется ещё одна молекула ацетил-КоА.
H3C—CO—CH2—CO—S—КоА + Ac—КоА → HOOC—CH2—COH(CH3)—CH2—CO—S—КоА
Образовавшийся β-гидрокси-β-метилглутарил-КоА (OMG-KoA) способен под действием фермента гидроксиметилглутарил-КоА-лиазы расщепляться на ацетоуксусную кислоту (ацетоацетат) и ацетил-КоА.
HOOC—CH2—COH(CH3)—CH2—CO—S—КоА → H3C—CO—CH2—COOH + Ac—КоА
Ацетоуксусная кислота способна восстанавливаться при участии НАД-зависимой D-β-оксибутиратдегидрогеназы; при этом образуется D-β-оксимасляная кислота (D-β-оксибутират). Фермент специфичен по отношению к D-стереоизомеру и не действует на КоА-эфиры.[2]
H3C—CO—CH2—COOH + NADH → H3C—CHOH—CH2—COOH
Ацетоуксусная кислота в процессе метаболизма способна окисляться до ацетона с выделением молекулы углекислого газа:[1]
H3C—CO—CH2—COOH → CO2 + H3C—CO—CH3
Альтернативный путь
Существует второй путь синтеза кетоновых тел:
образовавшийся путём конденсации двух молекул ацетил-КоА ацетоацетил-КоА способен отщеплять Кофермент A с образованием свободной ацетоуксусной кислоты[3]. Процесс катализирует фермент ацетоацетил-КоА-гидролаза (деацилаза), однако данный путь не имеет существенного значения в синтезе ацетоуксусной кислоты, так как активность деацилазы в печени низкая.[2]
H3C—CO—CH2—CO—S-КоА + H2O → H3C—CO—CH2—COOH + КоА-SH
Кетонемия и кетонурия.
В крови здорового человека кетоновые (ацетоновые) тела содержатся в очень небольших концентрациях. Однако при голодании, а также у лиц с тяжелой формой сахарного диабета содержание кетоновых тел в крови может повышаться до 20 ммоль/л. Это состояние носит название кетонемии; оно обычно сопровождается резким увеличением содержания кетоновых тел в моче (кетонурия). Например, если в норме за сутки с мочой выводится около 40 мг кетоновых тел, то при сахарном диабете содержание их в суточной порции мочи может доходить до 50 г и более.
В настоящее время явления кетонемии и кетонурии при сахарном диабете или голодании можно объяснить следующим образом. И диабет, и голодание сопровождаются резким сокращением запасов гликогена в печени. Многие ткани и органы, в частности мышечная ткань, находятся в состоянии энергетического голода (при недостатке инсулина глюкоза не может с достаточной скоростью поступать в клетку). В этой ситуации благодаря возбуждению метаболических центров в ЦНС импульсами с хе-морецепторов клеток, испытывающих энергетический голод, резко усиливаются липолиз и мобилизация большого количества жирных кислот из жировых депо в печень. В печени происходит интенсивное образование кетоновых тел. Образующиеся в необычно большом количестве кетоновые тела (ацетоуксусная и β-гидроксимасляная кислоты) с током кровитранспортируются из печени к периферическим тканям. Периферические ткани при диабете и голодании сохраняют способность использовать кетоновые тела в качестве энергетического материала, однако ввиду необычно высокой концентрации кетоновых тел в притекающей крови мышцы и другие органы не справляются с их окислением и как следствие возникает кетонемия.
58. Холестери́н.
.Органическое соединение, природный жирный (липофильный) спирт, содержащийся в клеточных мембранах всех живых организмов за исключением безъядерных (прокариоты). Нерастворим в воде, растворим в жирах и органических растворителях. Около 80 % холестерина вырабатывается самим организмом (печенью, кишечником, почками, надпочечниками, половыми железами), остальные 20 % поступают с пищей[1]. В организме находится 80 % свободного и 20 % связанного холестерина. Холестерин обеспечивает стабильность клеточных мембран в широком интервале температур. Он необходим для выработки витамина D, выработки надпочечниками различных стероидных гормонов, включаякортизол, альдостерон, женских половых гормонов эстрогенов и прогестерона, мужского полового гормонатестостерона, а по последним данным — играет важную роль в деятельности синапсов головного мозга и иммунной системы, включая защиту от рака.
Пути транспорта холестерина. В кровотоке переносчиками липидов являются липопротеины. Они состоят из липидного ядра, окруженного растворимыми фосфолипидами и свободным холестерином, а также апопротеинами, которые отвечают за направление липопротеинов к специфическим органам и тканевым рецепторам. Известно пять основных классов липопротеинов, различающихся по плотности, липидному составу и аполипопротеинам (табл. 5.1). 
Рис. 5.7 дает характеристику основных путей метаболизма циркулирующих липопротеинов. Жиры, поступившие с пищей, включаются в цикл, известный как экзогенный путь. Пищевые холестерин и триглицериды всасываются в кишечнике, включаются в хиломикроны клетками кишечного эпителия и транспортируются через лимфатические протоки в венозную систему. Эти большие, богатые триглицеридами частицы гидроли-зируются ферментом липопротеинлипазой, которая высвобождает жирные кислоты, захватываемые периферическими тканями, такими как жировая и мышечная. Образующиеся остатки хиломикронов состоят преимущественно из холестерина. Эти остатки поглощаются печенью, которая затем выделяет липиды в виде свободного холестерина либо желчных кислот обратно в кишечник.
Эндогенный путь начинается с того, что липопротеины очень низкой плотности (ЛОНП) высвобождаются из печени в кровоток. Хотя основным липидным компонентом ЛОНП являются триглицериды, содержащие мало холестерина, основная часть холестерина поступает из печени в кровь именно в составе ЛОНП. 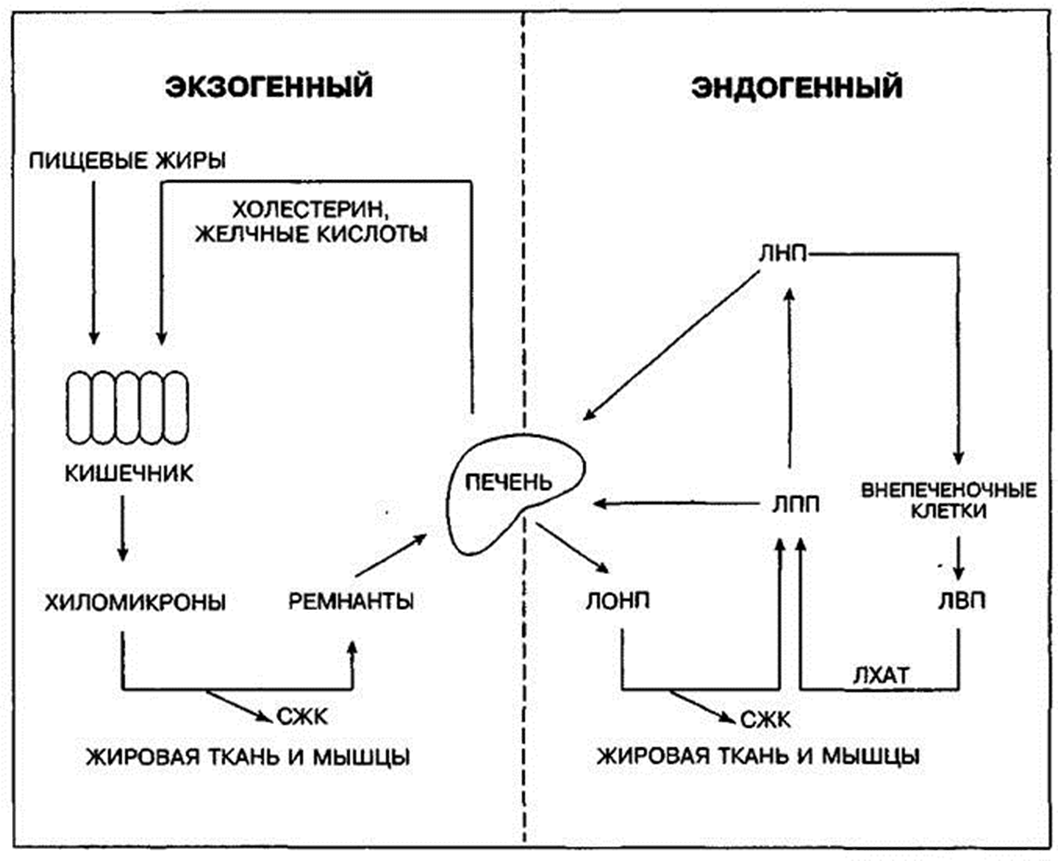
Рис. 5.7. Обзор системы транспорта липопротеинов. Экзогенный путь: в желудочно-кишечном тракте пищевые жиры включаются в хиломикроны и через лимфатическую систему попадают в циркулирующую кровь. Свободные жирные кислоты (СЖК) поглощаются периферическими клетками (например, жировой и мышечной тканью); остатки (ремнанты) липопротеинов возвращаются в печень, где их холестериновая составляющая может транспортироваться обратно в ЖК тракт или использоваться в других метаболических процессах. Эндогенный путь: в печени синтезируются и поступают в кровь богатые триглицеридами липопротеины очень низкой плотности (ЛОНП), и их СЖК поглощаются и накапливаются в периферических жировых клетках и мышцах. Образующиеся в результате липопротеины промежуточной плотности (ЛПП) превращаются в липопротеины низкой плотности, основной циркулирующий липопротеин, осуществляющий транспорт холестерина. Большая часть ЛНП захватывается печенью и другими периферическими клетками путем рецептор-опосредованного эндоцитоза. Обратный транспорт холестерина, освобождаемого периферическими клетками, осуществляется липопротеинами высокой плотности (ЛВП), которые превращаются в ЛПП под действием циркулирующей лецитинхолестеринацилтрансферазы (ЛХАТ) и, наконец, возвращаются в печень. Липопротеинлипаза мышечных клеток и жировой ткани отщепляет от ЛОНП свободные жирные кислоты, которые проникают в клетки, а циркулирующий остаток липопротеина, называемый ремнантным липопротеином промежуточной плотности (ЛПП), содержит в основном эфиры холестерина. Дальнейшие преобразования, которым ЛПП подвергается в крови, ведут к появлению богатых холестерином частиц липопротеинов низкой плотности (ЛНП). Приблизительно 75% циркулирующих ЛНП захватываются печенью и внепеченочными клетками благодаря наличию ЛНП-рецепторов. Остаток подвергается деградации отличными от классического ЛНП-рецепторного пути способами, в основном посредством моноцитарных клеток-мусорщиков.
Считается, что холестерин, поступающий в кровь из периферических тканей, транспортируется липопротеинами высокой плотности (ЛВП) в печень, где он вновь включается в липопротеины или секретируется в желчь (путь, включающий ЛПП и ЛНП, называется обратным транспортом холестерина). Таким образом, ЛВП, видимо, играет защитную роль в отношении отложения липидов в атеросклеротических бляшках. В крупных эпидемиологических исследованиях уровень циркулирующего ЛВП обратно коррелирует с развитием атеросклероза. Поэтому ЛВП часто называют хорошим холестерином в противоположность плохому холестерину ЛНП.
Семьдесят процентов холестерина плазмы транспортируется в виде ЛНП, и повышенный уровень ЛНП тесно коррелирует с развитием атеросклероза. В конце 1970-х гг. докторами Брауном и Гольдштейном была продемонстрирована центральная роль рецептора ЛНП в доставке холестерина к тканям и его клиренсе из кровотока. Экспрессия рецепторов ЛНП регулируется механизмом отрицательной обратной связи: нормальный или высокий уровень внутриклеточного холестерина подавляет экспрессию рецептора ЛНП на уровне транскрипции, в то время как снижение внутриклеточного холестерина повышает экспрессию рецептора с последующим увеличением захвата ЛНП клеткой. Пациенты с генетическими дефектами рецептора ЛНП (обычно гетерозиготы с одним нормальным и одним дефектным геном, кодирующим рецептор) не могут эффективно удалять ЛНП из кровотока, что приводит к высокому уровню ЛНП в плазме и склонности к преждевременному развитию атеросклероза. Это состояние называется семейной гиперхолестеринемией. Гомозиготы с полным отсутствием рецепторов ЛНП встречаются редко, но у этих людей инфаркт миокарда может развиваться уже в первое десятилетие жизни.
Недавно на основании различий в плотности и плавучести были идентифицированы подклассы ЛНП. Лица с более мелкими и плотными частицами ЛНП (свойство, определяемое как генетическими, так и внешними факторами) подвержены более высокому риску инфаркта миокарда, чем обладатели менее плотных разновидностей. Пока остается неясным, почему более плотные частицы ЛНП сопряжены с большим риском, однако это может быть связано с большей подверженностью плотных частиц окислению, ключевому моменту атерогенеза, о чем будет сказано ниже.
Возрастает число свидетельств того, что триглицериды сыворотки, в основном транспортирующиеся в составе ЛОНП и ЛПП, могут также играть важную роль в развитии атеросклеротических поражений. Пока не ясно, является ли это их прямым действием или объясняется тем, что уровень триглицеридов обычно находится в обратном соотношении с уровнем ЛВП. Сахарный диабет, начинающийся во взрослом возрасте, является одним из частых клинических состояний, ассоциированных с гипертриглицеридемией и низким уровнем ЛВП, а часто — и с ожирением и артериальной гипертензией. Этот набор факторов риска, который может быть связан с инсулинорезистентностью (обсуждается в главе 13), особенно атерогенен.
Использование организмом:
Холестерол входит в состав всех мембран клеток и влияет на их свойства,служит исходным субстратом в синтезе желчных кислот и стероидных гормонов.Холестерол за счет своей гидроксильной группы может образовывать эфиры с жирными кислотами.
Уровень холестерина
Исследования установили зависимость между содержанием различных групп липопротеинов и здоровьем человека. Большое количество ЛПНП сильно коррелирует с атеросклеротическими нарушениями в организме. По этой причине такие липопротеины часто называют «плохими». Низкомолекулярные липопротеиды малорастворимы и склонны к выделению в осадок кристаллов холестерина и к формированию атеросклеротических бляшек в сосудах, тем самым повышая риск инфаркта или ишемического инсульта, а также других сердечно-сосудистых осложнений.
С другой стороны, большое содержание ЛПВП в крови характерно для здорового организма, поэтому часто эти липопротеины называют «хорошими». Высокомолекулярные липопротеины хорошо растворимы и не склонны к выделению холестерина в осадок, и тем самым защищают сосуды от атеросклеротических изменений (то есть не являются атерогенными).
Уровень холестерина в крови измеряется либо в ммоль/л (миллимоль на литр, стандарт действующий в РФ) либо в мг/дл (миллиграмм на децилитр, 1 ммоль/л равен 38.665 мг/дл). Идеально, когда уровень «плохих» низкомолекулярных липопротеинов ниже 100 мг/дл (для лиц с высоким риском сердечно-сосудистых заболеваний — ниже 70 мг/дл). Такой уровень, однако, у взрослых достигается редко. Если уровень низкомолекулярных липопротеинов выше 160 мг/дл, рекомендуется использовать диету для снижения его ниже 130 мг/дл. Если этот уровень выше 190 мг/дл или упорно держится выше 160 мг/дл, рекомендуется взвесить возможность лекарственной терапии. Для лиц с высоким риском сердечно-сосудистых заболеваний эти цифры могут снижаться. Процент «хороших» высокомолекулярных липопротеинов в общем уровне холестерин-связывающих липопротеинов чем выше, тем лучше. Хорошим показателем считается, если он гораздо выше 1/5 от общего уровня холестерин-связывающих липопротеинов.
К факторам, повышающим уровень «плохого» холестерина, относятся:
• курение;
• избыточный вес или ожирение, переедание;
• гиподинамия или недостаточная физическая активность;
• неправильное питание с высоким содержанием холестерина, транс-жиров (содержащихся в частично гидрогенизированных жирах), насыщенных животных жиров в пище (в частности, жирное мясо, сало), высоким содержанием в пище углеводов (особенно легкоусваиваемых, типа сладостей и кондитерских изделий), недостаточным содержаниемклетчатки и пектинов, липотропных факторов, полиненасыщенных жирных кислот, микроэлементов и витаминов;
• застой желчи в печени при различных нарушениях работы этого органа[источник не указан 271 день] (также ведёт к желчнокаменному холециститу). Возникает при злоупотреблении алкоголем, некоторых вирусных заболеваниях, приёме некоторых лекарств;
• также некоторые эндокринные нарушения — сахарный диабет, гиперсекреция инсулина, гиперсекреция гормонов коры надпочечников, недостаточность гормонов щитовидной железы, половых гормонов.
Повышенный уровень «плохого» холестерина также может наблюдаться при некоторых заболеваниях печени и почек, сопровождающихся нарушением биосинтеза «правильных» липопротеидов в этих органах. Он может также быть наследственным, генетически обусловленным при некоторых формах так называемых «семейных дислипопротеинемий». В этих случаях больным, как правило, нужна специальная лекарственная терапия.
К факторам, снижающим уровень «плохого» холестерина, относятся физкультура, спорт и вообще регулярная физическая активность, отказ от курения и употребления алкоголя, еда, содержащая мало насыщенных животных жиров и легкоусваиваемых углеводов и богатая клетчаткой, полиненасыщенными жирными кислотами, липотропными факторами (метионином, холином, лецитином), витаминами и микроэлементами.
Холестерин также является основным компонентом большинства камней в желчном пузыре.
Выведение из организма
стурктурная основа холестерола-кольца циклопентанпергидрофенантрена-не может быть расщеплена до СО2 и воды,как другие органические компоненты,поступающие с пищей или синтезированные в организме.Поэтому основное количество холестерола выводится в виде желчных кислот.
Некторое количество желчных кислот для выведения в неизменном виде,а часть подвергается действию ферментом бактерий в кишечнике.Продукты их разрушения выводятся из организма.
Часть молекул холестерола в кишечнике под действием ферментов бактерий восстанавливается по двойной связи в кольце В,в результате чего образуется 2 типа молекул-холестанол и копростанол,выводимые с фекалиями.В сутки из организма выводится от 1,0 до 1,3 г холестерола,основная часть удаляется с фекалиями.
Методы определения общего холестерина подразделяются на:
1) колориметрические. Насчитывается около 150 колориметрических методов, основывающихся на реакциях образования цветных комплексов;
2) нефелометрические методы, основанные на сравнении степени мутности стандартного и исследуемого раствора;
3) титрометрические методы;
4) флюориметрические методы, позволяющие определять холестерин в микрообъемах сыворотки крови (например, в 0,01 мл ее);
5) газохроматографические и хроматографические методы;
6) гравиметрические методы.
Метод определения общего холестерина в сыворотке крови, основанный на реакции Либермана—Бурхарда (метод Илька).
Принцип метода
В сильнокислой безводной среде ХС взаимодействует со смесью серной, уксусной кислот и уксусного ангидрида. В ходе реакции ХС последовательно окисляется. При этом каждая стадия реакции сопровождается образованием молекулы ХС, которая имеет на одну двойную связь больше, чем соединение, из которого она образовалась. В результате конечного окисления иона 3,5-холестодиена получается окрашенное соединение, растворенное в серной кислоте и дающее максимум абсорбции при 410 и 610 нм. Из-за неустойчивости окраски соединения время фотометрирования должно быть точно выдержано.
Реакционная смесь со стандартным раствором ХС имеет изумрудный цвет. Однако пробы сыворотки могут давать зеленый, голубой, бурый цвета. Это связано с тем, что в результате образования эндогенного тепла в реакцию вступают многие компоненты сыворотки крови. Кроме того, в реакции Либермана—Бурхарда свободный ХС и его эфиры образуют цветные комплексы с разным коэффициентом молекулярного поглощения. В случае высокого содержания эфиров ХС оптическая плотность оказывается более высокой. Поскольку на прямое определение ХС влияют многие факторы, реакцию ХС со смесью Либермана—Бурхарда нельзя считать специфичной.
Прямой метод определения ХС относительно прост в исполнении и недорог. Однако токсичность и способность вызывать коррозию системы в современных анализаторах ограничивают применение метода. В крупных лабораториях предпочтение отдают ферментативным методам определения ХС.
Референтные величины: холестерин 4,65—6,46 ммоль/л (180—250 мг/дл).
При концентрации холестерина в пробе выше 16 ммоль/л сыворотку разводят физиологическим раствором в соотношении 1: 1 (результат).
Реакция чувствительна на изменение температуры, поэтому необходимо особенно соблюдать охлаждение реакционной смеси после добавки серной кислоты.
Билирубин в концентрации выше 50 мкмоль/л влияет на результат анализа. Интерференцию билирубина можно исправить расчетом. Содержание 17 мкмоль/л билирубина приводит к завышению содержания холестерина в сыворотке примерно на 0,1 моль/л.
Сыворотка должна быть негемолизированной.








