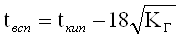Диффузионное горение жидкостей
По ГОСТ12.01.044-89 жидкости — вещества, давление насыщенных паров которых при температуре 25 °С и давлении 101,3 кПа меньше 101,3 кПа. К жидкостям относят также твердые плавящиеся вещества, температура плавления или каплепадения которых меньше 50 °С.
По сравнению с газами жидкости обладают во много раз большей плотностью. В жидкостях расстояние между молекулами – порядка размеров самих молекул, а силы межмолекулярного взаимодействия весьма значительны.
Процесс горения жидкостей начинается с воспламенения паровоздушной смеси. Однако не все жидкости при обычных условиях имеют над своей поверхностью достаточную концентрацию паров и такую скорость их образования, чтобы после воспламенения установился процесс горения. Стационарный процесс горения устанавливается только при определенной температуре жидкости, однако при более низких температурах жидкости уже могут представлять пожарную опасность, так как над поверхностью их может создаться взрывоопасная концентрация паров.
Процесс свободного горения большинства горючих жидкостей, протекает в газовой фазе – диффузионном режиме горения. В этом случае зона горения располагается на некотором расстоянии от горящей поверхности жидкости и существование пламени возможно только при наличии естественно конвективных потоков воздушной среды, поставляющих в достаточном количестве окислитель в зону горения, а также наличии процесса испарения с поверхности жидкости, создаваемого излучением пламени и поставляющего горючее в зону горения. Тепло из зоны горения к поверхности жидкости передается излучением. Передача тепла теплопроводностью невозможна, так как скорость движения паров от поверхности жидкости к зоне горения больше скорости передачи тепла по ним от зоны горения к жидкости. Передача тепла конвекцией также невозможна, так как поток паров в объеме пламени направлен от поверхности менее нагретой (жидкость) к поверхности более нагретой. Поступающие с поверхности жидкости горючие пары до воспламенения смешиваются с окружающей газовой средой медленно по механизму конвективной и молекулярной диффузии. Но, если к образовавшейся паровоздушной смеси подвести источник зажигания, то возникнет факел пламени, который изменит соотношение газовых и тепловых потоков над зеркалом жидкости: горячие продукты сгорания, как более легкие, устремятся вверх, а на их место из окружающего пространства поступит свежий холодный воздух, который приведет к разбавлению паров горючей жидкости. Максимальная температура турбулентного диффузионного пламени большинства ЛВЖ не превышает 1250-1350°С.
Механизм горения жидких топлив включает в себя несколько этапов:
- Искра (или другой посторонний источник).
- Воспламенение паровоздушной смеси
- Горение паровоздушной смеси у поверхности жидкости.
- Повышение скорости испарения за счет передачи тепла от пламени (до того момента, пока не наступит равновесие).
- В равновесии скорость испарения равна скорости сгорания.
В установившемся процессе горения (т.е. при постоянной температуре пламени) наблюдается равновесие между количеством сгоревшего в зоне горения (пламени) вещества и массой пара, поступающего в пламя. Это определяет постоянную скорость испарения и, следовательно, выгорание жидкости в течение всего процесса горения.
Таким образом, испарение определяет скорость сгорания жидкости.
Испарение — это переход жидкости в пар со свободной поверхности при температурах ниже точки кипения жидкости. Испарение происходит в результате теплового движения молекул жидкости. Часть молекул, имеющих достаточно большую кинетическую энергию, вырывается из поверхностного слоя жидкости в газовую (воздушную) среду. Избыточная энергия теряемых жидкостью молекул затрачивается на преодоление сил взаимодействия между молекулами и работу расширения (увеличения объема) при переходе жидкости в пар. Испарение является эндотермическим процессом.
Скорость (интенсивность) испарения определяется количеством пара, образующегося за единицу времени на единице поверхности жидкости. Движение атмосферы над испаряющейся жидкостью напрямую связано с интенсивностью испарения. Если скорость атмосферы над поверхностью жидкости увеличивается, интенсивность испарения также растет, так как молекулы пара не накапливаются над поверхностью жидкости. Следовательно, давление пара над жидкостью остается более низким, что сокращает количество кинетической энергии, которая требуется молекуле для отделения от поверхности и таким образом увеличивает интенсивность испарения. Если поместить над сосудом с водой вентилятор, интенсивность испарения увеличится, и жидкость испарится за более короткое время.
Другой фактор, который затрагивает интенсивность испарения, это площадь поверхности жидкости, которая открыта в атмосферу. При увеличении площади поверхности интенсивность испарения возрастает, так как масса молекул пара распространяется по большей площади, что сокращает давление на жидкость. Сокращение давления пара уменьшает количество кинетической энергии, необходимой молекулам для отделения от поверхности жидкости, что увеличивает интенсивность испарения. Следовательно, если объем воды из сосуда, переместить в бутылку, площадь поверхности жидкости значительно сократится, и потребуется больше времени для испарения воды.
Скорость испарения зависит от температуры и рода жидкости. Это необходимо учитывать в производствах, связанных с применением, получением или переработкой легковоспламеняющихся жидкостей. Увеличение скорости испарения при повышении температуры приводит к более быстрому образованию взрывоопасных концентраций паров. Максимальная скорость испарения наблюдается при испарении в вакуум и в неограниченный объем. Это можно объяснить следующим образом. Наблюдаемая скорость процесса испарения является суммарной скоростью процесса перехода молекул из жидкой фазы V 1 и скоростью конденсации V 2. Суммарный процесс равен разности этих двух скоростей: V= V 1 —V 2. При постоянной температуре V 1 не изменяется, а V 2 пропорциональна концентрации пара. При испарении в вакуум в пределе V 2 = 0, т. е. суммарная скорость процесса максимальная. Интенсивность испарения W определяется по справочным и экспериментальным данным.
Чем больше концентрация пара, тем выше скорость конденсации, следовательно, ниже суммарная скорость испарения. На поверхности раздела между жидкостью и ее насыщенным паром скорость испарения (суммарная) близка нулю. Жидкость, находящаяся в закрытом сосуде, испаряясь, образует насыщенный пар.
Насыщенным называется пар, находящийся в динамическом равновесии с жидкостью.
Динамическое равновесие при данной температуре наступает тогда, когда число испаряющихся молекул жидкости равно числу конденсирующихся молекул. Насыщенный пар, выходя из открытого сосуда в воздух, разбавляется им и становится ненасыщенным. Следовательно, в воздухе помещений, где находятся емкости с горячими жидкостями, имеется ненасыщенный пар этих жидкостей.
Насыщенные и ненасыщенные пары оказывают давление на стенки сосудов. Давлением насыщенного пара называют давление пара, находящегося в равновесии с жидкостью при данной температуре. Давление насыщенного пара всегда выше, чем ненасыщенного. Оно не зависит от количества жидкости, величины ее поверхности, формы сосуда, а зависит только от температуры и природы жидкости. С повышением температуры давление насыщенного пара жидкости увеличивается; при температуре кипения давление пара равно атмосферному. Для каждого значения температуры давление насыщенного пара индивидуальной жидкости постоянно.
Давление насыщенного пара смеси жидкостей зависит от состава смеси. Оно увеличивается с увеличением содержания в жидкости низкокипящих продуктов. Для большинства жидкостей давление насыщенного пара при различной температуре известно. Эти данные сведены в справочные таблицы и номограммы.
Часть общего давления, приходящаяся на долю данного газа или пара, называется парциальным. Поскольку давление насыщенных паров составляет часть общего давления смеси их с воздухом, есть возможность по известному общему давлению смеси и давлению паров определять концентрации паров жидкостей в воздухе.
Допустим, что удалось бы отделить пар от воздуха, причем давление в обеих частях осталось бы равным общему давлению Р общ. Тогда объемы, занимаемые паром и воздухом, соответственно уменьшились бы. Согласно закону Бойля-Мариотта:
Vпар Р общ = Vобщ Р пар 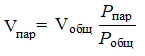
Если объем смеси принять за 100%, то содержание пара С,% (об.) можно найти из пропорции:
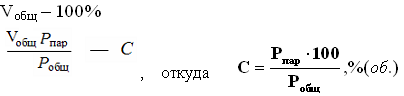
По этой формуле можно определить концентрацию паров жидкости в резервуарах, бочках и др. емкостях. Давление насыщенного пара при заданной температуре можно определить по таблицам и номограммам.
Если зависимость давления насыщенных паров от температуры для данной жидкости неизвестна, можно воспользоваться уравнением Антуана:
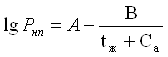
где Р нп – давление пара, кПа;
t ж – температура жидкости, о с ;
А, В, C a – константы Антуана, которые определяются для каждой жидкости по таблице.
Для оценки пожарной опасности жидкостей, при расчете безопасных режимов работы закрытых технологических аппаратов и складских емкостей с жидкостями и летучими твердыми веществами используют температурные пределы воспламенения.
Температура жидкости, при которой над поверхностью создается концентрация насыщенного пара, равная нижнему концентрационному пределу воспламенения, называется нижним температурным пределом воспламенения (НТПВ).
Температура жидкости, при которой над поверхностью создается концентрация насыщенного пара, равная верхнему концентрационному пределу воспламенения, называется верхним температурным пределом воспламенения (ВТПВ).
Например, для ацетона температурные пределы равны: НТПВ 253 К, ВТПВ 279 К. При этих температурах образуются концентрации паров соответственно 2,6 и 12,6% (об.).
Для пожаробезопасности технологического процесса, связанного с применением жидкостей, последний ведут при температурах ниже НТПВ на 10 К или выше ВТПВ на 15 К. Для многих жидкостей температурные пределы определены и результаты сведены в справочные таблицы.
Температурные пределы воспламенения определяют на стандартном приборе (ТП), разработанном во ВНИИПО (ГОСТ 13922—68). Сущность метода заключается в определении минимальной и максимальной температур жидкости, при которых образуются концентрации насыщенных паров, равные нижнему и верхнему концентрационным пределам.
Температурные пределы воспламенения можно рассчитать по экспериментально определенным концентрационным пределам. Если вычисленная величина не совпадает с экспериментальной, то в качестве действительной принимают более низкое значение для НТПВ и более высокое для ВТПВ.
Для расчетного определения ТПРП можно использовать зависимость давления насыщенного пара от температуры жидкости, которая выражается уравнением Антуана:
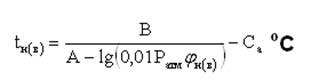
где А, В, С а - константы уравнения Антуана, которые определяются по таблице № 11 приложений.
Р атм – атмосферное давление, кПа;
 н(в) - концентрационные пределы распространения пламени, %.
н(в) - концентрационные пределы распространения пламени, %.
Для упрощенных расчетов безопасные температуры можно определить по формулам:
tнб< 0,9 (tн – Кбез)
tвб ≥ 1,1(tв + Кбез)
где К без — коэффициент безопасности, равный:
для индивидуальных веществ и нефтепродуктов 10,5°С,
для технических и реакционных смесей 14°С.
Таким образом, для воспламенения и горения жидкостей необходимо, чтобы жидкость была нагрета до температуры, не меньшей, чем нижний температурный предел воспламенения. После воспламенения скорость испарения должна быть достаточной для поддержания постоянного горения. Эти особенности горения жидкостей характеризуются температурой вспышки и температурой воспламенения.
Температура вспышки – самая низкая температура (в условиях специальных испытаний) вещества, при которой над поверхностью его образуются пары и газы, способные вспыхивать в воздухе от источника зажигания, но скорость образования еще недостаточна для последующего горения.
Температура вспышки жидкостей, принадлежащих к одному и тому же классу, повышается с увеличением молекулярной массы, температуры кипения и плотности. При смешении ГЖ с водой или четыреххлористым углеродом давление горючих паров при той же температуре понижается, что приводит к повышению температуры вспышки. Можно разбавить ГЖ так, что получившаяся смесь не будет иметь температуру вспышки.
Практика пожаротушения показывает, что горение хорошо растворимых в воде жидкостей прекращается, когда концентрация горючей жидкости достигает 10— 25%.
Для бинарных смесей горючих жидкостей, хорошо растворимых друг в друге, температура вспышки находится между температурами вспышки чистых жидкостей и приближается к температуре вспышки одной из них в зависимости от состава смеси.
Температуру вспышки в закрытом тигле можно рассчитать:
1. по формуле Элея:
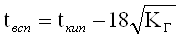
Где K Г – коэффициент горючести вещества, который определяется по формуле:
K Г = 4C + 4S + H + N – 2O – 2Cl – 3F – 5Br,
Паровоздушные смеси, так же как и газовоздушные, являются взрывоопасными. Их взрывоопасность характеризуется параметрами, определяющими взрывоопасность газовоздушных смесей, – энергией зажигания, температурой горения, нормальной скоростью распространения пламени и др.
Литература:
Диффузионное горение жидкостей
По ГОСТ12.01.044-89 жидкости — вещества, давление насыщенных паров которых при температуре 25 °С и давлении 101,3 кПа меньше 101,3 кПа. К жидкостям относят также твердые плавящиеся вещества, температура плавления или каплепадения которых меньше 50 °С.
По сравнению с газами жидкости обладают во много раз большей плотностью. В жидкостях расстояние между молекулами – порядка размеров самих молекул, а силы межмолекулярного взаимодействия весьма значительны.
Процесс горения жидкостей начинается с воспламенения паровоздушной смеси. Однако не все жидкости при обычных условиях имеют над своей поверхностью достаточную концентрацию паров и такую скорость их образования, чтобы после воспламенения установился процесс горения. Стационарный процесс горения устанавливается только при определенной температуре жидкости, однако при более низких температурах жидкости уже могут представлять пожарную опасность, так как над поверхностью их может создаться взрывоопасная концентрация паров.
Процесс свободного горения большинства горючих жидкостей, протекает в газовой фазе – диффузионном режиме горения. В этом случае зона горения располагается на некотором расстоянии от горящей поверхности жидкости и существование пламени возможно только при наличии естественно конвективных потоков воздушной среды, поставляющих в достаточном количестве окислитель в зону горения, а также наличии процесса испарения с поверхности жидкости, создаваемого излучением пламени и поставляющего горючее в зону горения. Тепло из зоны горения к поверхности жидкости передается излучением. Передача тепла теплопроводностью невозможна, так как скорость движения паров от поверхности жидкости к зоне горения больше скорости передачи тепла по ним от зоны горения к жидкости. Передача тепла конвекцией также невозможна, так как поток паров в объеме пламени направлен от поверхности менее нагретой (жидкость) к поверхности более нагретой. Поступающие с поверхности жидкости горючие пары до воспламенения смешиваются с окружающей газовой средой медленно по механизму конвективной и молекулярной диффузии. Но, если к образовавшейся паровоздушной смеси подвести источник зажигания, то возникнет факел пламени, который изменит соотношение газовых и тепловых потоков над зеркалом жидкости: горячие продукты сгорания, как более легкие, устремятся вверх, а на их место из окружающего пространства поступит свежий холодный воздух, который приведет к разбавлению паров горючей жидкости. Максимальная температура турбулентного диффузионного пламени большинства ЛВЖ не превышает 1250-1350°С.
Механизм горения жидких топлив включает в себя несколько этапов:
- Искра (или другой посторонний источник).
- Воспламенение паровоздушной смеси
- Горение паровоздушной смеси у поверхности жидкости.
- Повышение скорости испарения за счет передачи тепла от пламени (до того момента, пока не наступит равновесие).
- В равновесии скорость испарения равна скорости сгорания.
В установившемся процессе горения (т.е. при постоянной температуре пламени) наблюдается равновесие между количеством сгоревшего в зоне горения (пламени) вещества и массой пара, поступающего в пламя. Это определяет постоянную скорость испарения и, следовательно, выгорание жидкости в течение всего процесса горения.
Таким образом, испарение определяет скорость сгорания жидкости.
Испарение — это переход жидкости в пар со свободной поверхности при температурах ниже точки кипения жидкости. Испарение происходит в результате теплового движения молекул жидкости. Часть молекул, имеющих достаточно большую кинетическую энергию, вырывается из поверхностного слоя жидкости в газовую (воздушную) среду. Избыточная энергия теряемых жидкостью молекул затрачивается на преодоление сил взаимодействия между молекулами и работу расширения (увеличения объема) при переходе жидкости в пар. Испарение является эндотермическим процессом.
Скорость (интенсивность) испарения определяется количеством пара, образующегося за единицу времени на единице поверхности жидкости. Движение атмосферы над испаряющейся жидкостью напрямую связано с интенсивностью испарения. Если скорость атмосферы над поверхностью жидкости увеличивается, интенсивность испарения также растет, так как молекулы пара не накапливаются над поверхностью жидкости. Следовательно, давление пара над жидкостью остается более низким, что сокращает количество кинетической энергии, которая требуется молекуле для отделения от поверхности и таким образом увеличивает интенсивность испарения. Если поместить над сосудом с водой вентилятор, интенсивность испарения увеличится, и жидкость испарится за более короткое время.
Другой фактор, который затрагивает интенсивность испарения, это площадь поверхности жидкости, которая открыта в атмосферу. При увеличении площади поверхности интенсивность испарения возрастает, так как масса молекул пара распространяется по большей площади, что сокращает давление на жидкость. Сокращение давления пара уменьшает количество кинетической энергии, необходимой молекулам для отделения от поверхности жидкости, что увеличивает интенсивность испарения. Следовательно, если объем воды из сосуда, переместить в бутылку, площадь поверхности жидкости значительно сократится, и потребуется больше времени для испарения воды.
Скорость испарения зависит от температуры и рода жидкости. Это необходимо учитывать в производствах, связанных с применением, получением или переработкой легковоспламеняющихся жидкостей. Увеличение скорости испарения при повышении температуры приводит к более быстрому образованию взрывоопасных концентраций паров. Максимальная скорость испарения наблюдается при испарении в вакуум и в неограниченный объем. Это можно объяснить следующим образом. Наблюдаемая скорость процесса испарения является суммарной скоростью процесса перехода молекул из жидкой фазы V 1 и скоростью конденсации V 2. Суммарный процесс равен разности этих двух скоростей: V= V 1 —V 2. При постоянной температуре V 1 не изменяется, а V 2 пропорциональна концентрации пара. При испарении в вакуум в пределе V 2 = 0, т. е. суммарная скорость процесса максимальная. Интенсивность испарения W определяется по справочным и экспериментальным данным.
Чем больше концентрация пара, тем выше скорость конденсации, следовательно, ниже суммарная скорость испарения. На поверхности раздела между жидкостью и ее насыщенным паром скорость испарения (суммарная) близка нулю. Жидкость, находящаяся в закрытом сосуде, испаряясь, образует насыщенный пар.
Насыщенным называется пар, находящийся в динамическом равновесии с жидкостью.
Динамическое равновесие при данной температуре наступает тогда, когда число испаряющихся молекул жидкости равно числу конденсирующихся молекул. Насыщенный пар, выходя из открытого сосуда в воздух, разбавляется им и становится ненасыщенным. Следовательно, в воздухе помещений, где находятся емкости с горячими жидкостями, имеется ненасыщенный пар этих жидкостей.
Насыщенные и ненасыщенные пары оказывают давление на стенки сосудов. Давлением насыщенного пара называют давление пара, находящегося в равновесии с жидкостью при данной температуре. Давление насыщенного пара всегда выше, чем ненасыщенного. Оно не зависит от количества жидкости, величины ее поверхности, формы сосуда, а зависит только от температуры и природы жидкости. С повышением температуры давление насыщенного пара жидкости увеличивается; при температуре кипения давление пара равно атмосферному. Для каждого значения температуры давление насыщенного пара индивидуальной жидкости постоянно.
Давление насыщенного пара смеси жидкостей зависит от состава смеси. Оно увеличивается с увеличением содержания в жидкости низкокипящих продуктов. Для большинства жидкостей давление насыщенного пара при различной температуре известно. Эти данные сведены в справочные таблицы и номограммы.
Часть общего давления, приходящаяся на долю данного газа или пара, называется парциальным. Поскольку давление насыщенных паров составляет часть общего давления смеси их с воздухом, есть возможность по известному общему давлению смеси и давлению паров определять концентрации паров жидкостей в воздухе.
Допустим, что удалось бы отделить пар от воздуха, причем давление в обеих частях осталось бы равным общему давлению Р общ. Тогда объемы, занимаемые паром и воздухом, соответственно уменьшились бы. Согласно закону Бойля-Мариотта:
Vпар Р общ = Vобщ Р пар 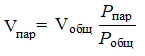
Если объем смеси принять за 100%, то содержание пара С,% (об.) можно найти из пропорции:

По этой формуле можно определить концентрацию паров жидкости в резервуарах, бочках и др. емкостях. Давление насыщенного пара при заданной температуре можно определить по таблицам и номограммам.
Если зависимость давления насыщенных паров от температуры для данной жидкости неизвестна, можно воспользоваться уравнением Антуана:
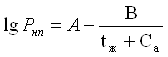
где Р нп – давление пара, кПа;
t ж – температура жидкости, о с ;
А, В, C a – константы Антуана, которые определяются для каждой жидкости по таблице.
Для оценки пожарной опасности жидкостей, при расчете безопасных режимов работы закрытых технологических аппаратов и складских емкостей с жидкостями и летучими твердыми веществами используют температурные пределы воспламенения.
Температура жидкости, при которой над поверхностью создается концентрация насыщенного пара, равная нижнему концентрационному пределу воспламенения, называется нижним температурным пределом воспламенения (НТПВ).
Температура жидкости, при которой над поверхностью создается концентрация насыщенного пара, равная верхнему концентрационному пределу воспламенения, называется верхним температурным пределом воспламенения (ВТПВ).
Например, для ацетона температурные пределы равны: НТПВ 253 К, ВТПВ 279 К. При этих температурах образуются концентрации паров соответственно 2,6 и 12,6% (об.).
Для пожаробезопасности технологического процесса, связанного с применением жидкостей, последний ведут при температурах ниже НТПВ на 10 К или выше ВТПВ на 15 К. Для многих жидкостей температурные пределы определены и результаты сведены в справочные таблицы.
Температурные пределы воспламенения определяют на стандартном приборе (ТП), разработанном во ВНИИПО (ГОСТ 13922—68). Сущность метода заключается в определении минимальной и максимальной температур жидкости, при которых образуются концентрации насыщенных паров, равные нижнему и верхнему концентрационным пределам.
Температурные пределы воспламенения можно рассчитать по экспериментально определенным концентрационным пределам. Если вычисленная величина не совпадает с экспериментальной, то в качестве действительной принимают более низкое значение для НТПВ и более высокое для ВТПВ.
Для расчетного определения ТПРП можно использовать зависимость давления насыщенного пара от температуры жидкости, которая выражается уравнением Антуана:
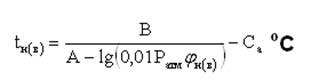
где А, В, С а - константы уравнения Антуана, которые определяются по таблице № 11 приложений.
Р атм – атмосферное давление, кПа;
 н(в) - концентрационные пределы распространения пламени, %.
н(в) - концентрационные пределы распространения пламени, %.
Для упрощенных расчетов безопасные температуры можно определить по формулам:
tнб< 0,9 (tн – Кбез)
tвб ≥ 1,1(tв + Кбез)
где К без — коэффициент безопасности, равный:
для индивидуальных веществ и нефтепродуктов 10,5°С,
для технических и реакционных смесей 14°С.
Таким образом, для воспламенения и горения жидкостей необходимо, чтобы жидкость была нагрета до температуры, не меньшей, чем нижний температурный предел воспламенения. После воспламенения скорость испарения должна быть достаточной для поддержания постоянного горения. Эти особенности горения жидкостей характеризуются температурой вспышки и температурой воспламенения.
Температура вспышки – самая низкая температура (в условиях специальных испытаний) вещества, при которой над поверхностью его образуются пары и газы, способные вспыхивать в воздухе от источника зажигания, но скорость образования еще недостаточна для последующего горения.



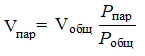

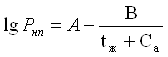
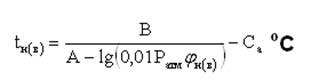
 н(в) - концентрационные пределы распространения пламени, %.
н(в) - концентрационные пределы распространения пламени, %.