МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РФ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«Орловский государственный аграрный университет»
ОСНОВЫ БИОХИМИИ И МОЛЕКУЛЯРНОЙ БИОЛОГИИ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ИЗУЧЕНИЮ ДИСЦИПЛИНЫ И ЗАДАНИЯ ДЛЯ КОНТРОЛЬНЫХ РАБОТ
студентам-заочникам
направления подготовки
БИОТЕХНОЛОГИЯ
Орел-2014 г
ОСНОВЫ БИОХИМИИ И МОЛЕКУЛЯРНОЙ БИОЛОГИИ.
Методические указания и задания для контрольных работ./Павловская Н.Е., Солохина И.Ю.
Рецензенты:
Прудникова Е.Г., к.с.-х.н., доцент кафедры химии
Методические указания составлены в соответствии с программой курса «Основы биохимии и молекулярной биологии»
Одобрено и рекомендовано кафедрой биотехнологии и методической комиссией ФГБОУ ВО Орел ГАУ
Издательство Орел ГАУ
1.Цели и задачи дисциплины
Цель дисциплины–сформировать у студентов современные представления о химическом составе организмов, о биохимических процессах, протекающих в живых клетках и организмах, а также о биологических субстратах, участвующих в этих процессах.
В задачи изучения дисциплины входит изучение строения и биологических функций важнейших биополимеров и биорегуляторов: белков, нуклеиновых кислот, углеводов, липидов, витаминов, коферментов, гормонов; механизмов ферментативных биоэнергетических превращений; специфических процессов, характерных для живых систем: ферментативный катализ, обмен углеводов, белков и липидов, мембранный транспорт, превращениям энергии, метаболизм ксенобиотиков, генетика прокариот и эукариот.
Задачей курса «Основы биохимии и молекулярной биологии» является изучение строения и свойств макромолекул, входящих в состав живой материи, их химических превращениях и значении этих превращений для понимания физико-химических основ жизнедеятельности, молекулярных механизмов наследственности и адаптации биохимических процессов в организмах к изменяющимся условиям окружающей среды. Знание биохимии имеет большое значение для формирования понимания единства метаболических процессов в организме и их регуляции на молекулярном, клеточном и организменном уровнях.
Рекомендуемая литература
Основная
1. Авдеева, Л.В. Биохимия: Учебник / Л.В. Авдеева, Т.Л. Алейникова, Л.Е. Андрианова; Под ред. Е.С. Северин. - М.: ГЭОТАР-МЕД, 2013. - 768 c.
2.Биологическая химия /(Ю.Б. Филиппович, Н.И. Ковалевская, Г.А. Севастьянова и др.); под ред. Н.И. Ковалевской.- М.: ИЦ «Академия», 2008.-256с.
3.Березов Т.Т., Коровкин Б.Ф. Биологическая химия: учебник. -3-е изд., стер. -М.: Медицина, 2008.03, [1] с.: рис., табл
4.. Коничев, А. С. Молекулярная биология: учебник для студентов пед. вузов / А. С. Коничев, Г. А. Севастьянова. – М.: Дрофа, 2008. - 359 с.
5. Ленинджер А. Основы биохимии. В 3-х тт. – М.: Мир, 2010.
6. Щербаков В.Г. Биохимия: учебник / В.Г. Щербаков, В.Г. Лобанов, Т.Н. Прудникова, А.Д. Минакова. – СПб.: ГИОРД, 2009
Дополнительная
1. Кнорре Д.Г., Мызина С.Д. Биологическая химия.– М., 2004. 479 с.
2. Тюкавкина Н.А. Биоорганическая химия: Учебн. для вузов / Н.А. Тюкавкина, Ю.И. Бауков. – М.: Дрофа, 2004. – 544 с.
3 Коничев, А. С. Молекулярная биологи: учебник для студентов пед. вузов / А. С. Коничев, Г. А. Севастьянова. – М.: Изд. центр «Академия», 2003. – 400 с.
4. Комов В.П., Шведова В.Н. Биохимия. СМ.: Дрофа, - 2004. -638 с.
5.Николаев А.Я. Биологическая химия: учебник / А.Я. Николаев. – М.: Медицинское информационное агентство, 2007.
6. Рогожин В.В. Биохимия растений: учебник / В.В. Рогожин. – СПб.: ГИОРД, 2011
7. Терах Е.И. Биохимия. Метаболизм веществ и энергии в клетке: учебное пособие / Е.И. Терах. – Новосибирск: СибУПК, 2010.
8. Чернова Н.Н. Биохимия. Руководство к практическим занятиям: учебное пособие / Н.Н. Чернова. – М.: ГЭОТАР-Медиа, 2009.
Тема 4. Пептиды, распространение в природе, участие в обмене
Петиды – это полиамиды, построенные из a -аминокислот. По числу аминокислотных остатков в молекуле пептида различают дипептиды, трипептиды, тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами, более 10 аминокислотных остатков – полипептидами. Природные полипептиды, включающие более 100 аминокислотных остатков, называют белками.
Строение пептидов
Формально пептиды можно рассматривать как продукты поликонденсации аминокислот.

Аминокислотные остатки в пептиде связаны амидными (пептидными) связями. Один конец цепи, на котором находится аминокислота со свободной аминогруппой, называют N-концом. Другой конец, на котором находится аминокислота со свободной карбоксильной группой, называют С-концом. Пептиды принято записывать и называть, начиная с N-конца.
Название пептида строят на основе тривиальных названий, входящих в его состав аминокислотных остатков, которые перечисляют, начиная с N-конца. При этом в названиях всех аминокислот за исключением С-концевой суффикс “ин” заменяют на суффикс “ил”. Для сокращенного обозначения пептидов используют трехбуквенные обозначения входящих в его состав аминокислот.

Пептид характеризуется аминокислотным составом и аминокислотной последовательностью.
Аминокислотный состав пептида может быть установлен путем полного гидролиза пептида (расщепления до аминокислот) с последующим качественным и количественным анализом образовавшихся аминокислот методом ионобменной хроматографии или ГЖХ-анализом сложных эфиров аминокислот. Полный гидролиз пептидов проводят в кислой среде при кипячении их с 6н. HCl.
Одному и тому же аминокислотному составу отвечает несколько пептидов. Так, из 2-х разных аминокислот может быть построено 2 дипептида, из трех разных аминокислот – 6 трипептидов, из n разных аминокислот n! пептидов одинакового состава. Например, составу Gly:Ala:Val=1:1:1 отвечают следующие 6 трипептидов.
Gly-Ala-Val Gly- Val-Ala Val-Gly-Ala Val-Ala-Gly Ala-Gly-Val Ala-Val-Glu
Таким образом, для полной характеристики пептида необходимо знать его аминокислотный состав и аминокислотную последовательность.
Физико-химические свойства пептидов определяются аминокислотным составом, то есть пептиды могут быть нейтральными или заряженными, проявлять кислотные или основные свойства, они имеют изоэлектрическую точку и поэтому могут быть разделены электрофоретическими методами или же храматографически.
В природе существует два вида пептидов, один из которых синтезируется и выполняет физиологическую роль в процессе жизнидеятельности организма, другой образуется за счет химического или ферментативного гидролиза белков в организме или вне его. Пептиды, образующиеся в процессе гидролиза вне организма (in vitro), широко используются для анализа аминокислотной последовательности белков.
Ферментативное образование пептидов происходит в желудочно-кишечном тракте человека в процессе переваривания белков пищи. Оно начинается в желудке под действием пепсина, гастриксина и заканчивается в желудке под действием пепсина, гастриксина и заканчивается в кишечнике при участии трипсина, химотрипсина, амино- и карбоксипептидаз. Распад коротких пептидов завершается ди- и трипептидами с образованием свободных аминокислот, которые расходуются на синтез белков и других активных соединений.
Для многих природных пептидов установлена структура и роль. На рисунке отображены физиологическое значение и функциональная роль наиболее распространенных групп пептидов, от которых зависят здоровье человека и органолептические и санитарно-гигиенические свойства пищевых продуктов.
Специфичность ферментов
Под специфичностью ферментов понимают способность каждого из них катализировать одну или несколько близких по природе хими-ческих реакций. Это одно из важнейших биологических явлений, без которого невозможен упорядоченный обмен веществ в живом организме, а следовательно, и сама жизнь.
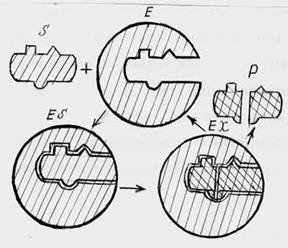
Исследуя природу ферментативного катализа Э.Фишер в 1890-х годах пришел к выводу, что специфичность ферментов можно уподобить соответствию между “ключом и замком”. При этом под-разумевается, что активный центр фермента имеет жесткую структуру, подобно замку. Молекула субстрата должна иметь комплементарную структуру, чтобы входить в активный центр, подобно ключу (рис 4.2). Представление Э.Фишера об активном центре фермента, как жесткой структуре, не подвергалось сомнению в течение полустолетия.
По мере изучения механизма действия ферментов был выявлен ряд данных, которые нельзя согласовать с теорией “ключа и замка”. Например, фермент не может атаковать (подвергнуть превращению) молекулы веществ, обладающие меньшим или большим размером по сравнению с субстратом, но имеющие такие же группы для взаимодействия с ферментом, что и субстрат. Следует отметить, что в ряде случаев такие молекулы связываются с контактным участком активного центра, но при этом превращение субстрата не происходит.
Специфичность у разных ферментов выражена в неодинаковой степени. Различают следующие типы специфичности.
1. А б с о л ю т н а я с п е ц и ф и ч н о с т ь. При этом типе специфичности фермент катализирует превращение только одного субстрата. Фермент каталаза катализирует расщепление пероксида водорода на воду и кислород; ее действие ограничивается только этим субстратом.
Рис 4.2. Схема связывания фермента и субстрата согласно теории “ключа и замка”
Обозначение: E- фермент; S-субстрат; Р - продукты; ES- комплекс фермент-субстрат; ЕХ - истинный активированный комплекс; А - активный центр фермента.
2. Г р у п п о в а я с п е ц и ф и ч н о с т ь. Основным признаком для ферментов этого типа специфичности служит характер разрушаемой или создаваемой связи в близких по строению группах веществ. К ферментам с групповой специфичностью относятся липазы, катализирующие гидролиз сложных эфиров глицерина и карбоновых кислот; фосфатазы, действующие на эфиры фосфорной кислоты; пептидгидролазы, катализирующие гидролиз пептидных связей в белках и пептидах и др.
3. С т е р е о х и м и ч е с к а я с п е ц и ф и ч н о с т ь. Ферменты этого типа специфичности действуют на определенный изомер одного и того же вещества: D- или L-, a- или b-, транс- или цис-. Пептидгидролазы действуют только на пептиды, образованные аминокислотами L-ряда.
Пластический обмен
Все химические реакций живой клетки можно разделить на два типа: реакции синтеза (биосинтеза), с помощью которых осуществляется пластический обмен, и реакции расщепления - энергетический обмен.
Обмен веществ и энергии - это совокупность физических, химических и физиологических процессов превращения веществ и энергии в живых организмах, а также обмен веществами и энергией между организмом и окружающей средой.
Обмен веществ у живых организмов заключается в поступлении из внешней среды различных веществ, в превращении и использовании их в процессах жизнедеятельности и в выделении образующихся продуктов распада в окружающую среду.
Все происходящие в организме преобразования вещества и энергии объединены общим названием - метаболизм (обмен веществ). На клеточном уровне эти преобразования осуществляются через сложные последовательности реакций, называемые путями метаболизма, и могут включать тысячи разнообразных реакций. Эти реакции протекают не хаотически, а в строго определенной последовательности и регулируются множеством генетических и химических механизмов. Метаболизм можно разделить на два взаимосвязанных, но разнонаправленных процесса: анаболизм (ассимиляция) и катаболизм (диссимиляция).
Анаболизм - это совокупность процессов биосинтеза органических веществ (компонентов клетки и других структур органов и тканей). Он обеспечивает рост, развитие, обновление биологических структур, а также накопление энергии (синтез макроэргов). Анаболизм заключается в химической модификации и перестройке поступающих с пищей молекул в другие более сложные биологические молекулы. Например, включение аминокислот в синтезируемые клеткой белки в соответствии с инструкцией, содержащейся в генетическом материале данной клетки.
Катаболизм - это совокупность процессов расщепления сложных молекул до более простых веществ с использованием части из них в качестве субстратов для биосинтеза и расщеплением другой части до конечных продуктов метаболизма с образованием энергии. К конечным продуктам метаболизма относятся вода (у человека примерно 350 мл в день), двуокись углерода (около 230 мл/мин), окись углерода (0,007 мл/мин), мочевина (около 30 г/день), а также другие вещества, содержащие азот (примерно б г/день). Катаболизм обеспечивает извлечение химической энергии из содержащихся в пище молекул и использование этой энергии на обеспечение необходимых функций. Например, образование свободных аминокислот в результате расщепления поступающих с пищей белков и последующее окисление этих аминокислот в клетке с образованием СО2, и Н2О, что сопровождается высвобождением энергии.
Процессы анаболизма и катаболизма находятся в организме в состоянии динамического равновесия. Преобладание анаболических процессов над катаболическими приводит к росту, накоплению массы тканей, а преобладание катаболических процессов ведет к частичному разрушению тканевых структур. Состояние равновесного или неравновесного соотношения анаболизма и катаболизма зависит от возраста (в детском возрасте преобладает анаболизм, у взрослых обычно наблюдается равновесие, в старческом возрасте преобладает катаболизм), состояния здоровья, выполняемой организмом физической или психоэмоциональной нагрузки.
Энергетический обмен состоит из трех этапов.
Первый из них: подготовительный этап. На этом этапе крупные молекулы белков, нуклеиновых кислот, жиров, углеводов расщепляются на более мелкие: глюкозу, глицерин, жирные кислоты, нуклеотиды. При этом выделяется небольшое количество энергии, которая рассеивается в виде тепла.
Второй этап - бескислородный или анаэробный. Этот этап можно рассмотреть на примере расщепления глюкозы. Обратите внимание на то, что при этом не используется кислород и образуется всего две молекулы АТФ. Необходимо учитывать, что в виде АТФ запасается всего 40% энергии, остальное рассеивается в виде тепла.
Третий этап - кислородный или аэробный. Особенность данного этапа состоит в том, что в реакциях гликолиза участвует кислород и образуется 36 молекул АТФ.
Имейте в виду, что в случаях большой надобности в энергии в клетках эукариот может идти процесс энергетического обмена только до второго этапа, то есть только анаэробный гликолиз.
При изучении пластического обмена обратите внимание на то, в каких органоидах клетки происходит синтез тех или иных органических веществ (углеводов, жиров, белков, нуклеиновых кислот).
Фотосинтез -это процесс образования органических веществ из неорганических с помощью световой энергии. Исходными для фотосинтеза являются углекислый газ и вода, содержащие значительно меньше энергии, чем глюкоза. Следовательно, в процессе фотосинтеза солнечная энергия преобразуется в химическую. (Энергия переходит из одной формы в другую).
Обратите внимание: процесс фотосинтеза имеет несколько ключевых моментов. Молекула хлорофилла содержит атом Mg. Электроны на внешнихорбиталях металла неустойчивы. При ударе фотоном электрон вылетает из атома. Но в таком состоянии он долго существовать не может. Он должен вернуться на свое место, излучив предварительно энергию, полученную от фотона, или отдать ее. У растений в хлоропластах эта энергия не теряется. Она частично идет на синтез АТФ, но, самое важное, этот электрон идет на фотолиз воды. Образовавшиеся ионы водорода идут на синтез органических веществ, а кислород выделяется в атмосферу. Это реакции световой фазы. Следующая фаза условно получила название темновой. Это ряд ферментативных реакций, в процессе которых связывется углекислый газ и синтезируются углеводы. При этом расходуется энергия АТФ и атомы водорода.
Биосинтез АТФ в клетке
- Окислительное фосфорилирование
- Фотофосфорилирование
- Субстратное фосфорилирование
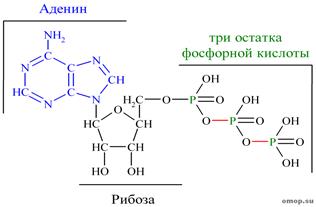
Таблица 1. Номера вопросов контрольной работы
| Последняя
цифра шифра
| Предпоследняя цифра шифра
|
|
|
|
|
|
|
|
| 1,20,23,
34,42,55,
| 2,19,24,
35,43,56,
| 3,18,25,
36,44,57,
| 4,17,26,
37,45,58
| 5,16,27,
38,46,59
|
|
| 10 19 24
| 9 13 25
37 44 57
| 8 17 26
38 45 58
| 7 16 27
39 46 59
| 6 11 28
40 47 60
|
|
| 8 18 25
38 44 57
| 7 17 26
39 45 58
| 6 19 27
40 46 59
| 5 11 28
31 47 60
| 4 15 29
32 48 51
|
|
| 6 16 27
37 43 58
| 5 11 23
38 44 59
| 4 13 28
39 45 60
| 3 14 29
40 46 51
| 2 17 30
31 47 52
|
|
| 4 14 26
35 44 59
| 3 12 27
36 45 60
| 2 11 29
37 46 51
| 1 18 30
38 47 52
| 10 12 21
39 48 53
|
|
| 3 12 28
33 43 60
| 2 13 29
34 44 51
| 1 12 30
35 45 52
| 10 15 21
3 46 53
| 9 16 22
37 47 54
|
|
| 2 15 27
32 46 51
| 1 14 28
33 47 52
| 10 16 24
34 48 53
| 9 17 22
35 49 54
| 8 13 23
36 50 55
|
|
| 5 17 30
31 45 52
| 8 15 21
32 46 53
| 9 18 23
33 47 54
| 6 13 23
34 48 55
| 3 19 24
35 49 56
|
|
| 7 13 22
39 47 51
| 10 19 22
40 48 52
| 5 20 21
31 49 53
| 2 12 24
32 50 54
| 1 17 25
33 41 55
|
|
| 9 11 21
40 41 53
| 4 18 30
31 42 54
| 7 15 22
32 43 55
| 8 20 25
33 44 56
| 7 14 26
34 45 57
|
Продолжение таблицы № 1
| Последняя
цифра шифра
| Предпоследняя цифра шифра
|
|
|
|
|
|
|
|
| 6 15 28
39 47 60
| 7 14 29
40 48 54
| 8 13 30
31 49 53
| 9 12 21
33 50 52
| 10 11 22
32 41 51
|
|
| 5 12 29
31 48 51
| 4 15 30
32 49 52
| 3 17 21
33 50 53
| 2 16 22
34 41 54
| 1 15 23
35 42 55
|
|
| 3 16 30
33 49 52
| 2 18 21
34 50 53
| 1 20 22
35 41 54
| 10 13 23
36 42 55
| 9 14 24
37 43 56
|
|
| 1 19 21
32 48 53
| 10 14 22
33 49 54
| 9 12 23
34 50 55
| 8 18 24
35 41 56
| 7 20 25
36 42 57
|
|
| 9 15 22
40 49 54
| 8 13 23
31 50 55
| 7 16 24
32 41 56
| 6 17 25
33 42 57
| 5 19 26
34 43 58
|
|
| 8 14 23
38 48 55
| 7 11 24
39 49 56
| 6 18 25
40 50 57
| 5 20 26
31 41 58
| 4 17 27
32 42 59
|
|
| 7 18 24
37 41 56
| 6 12 25
38 42 57
| 5 11 26
39 43 58
| 4 19 27
40 44 59
| 3 20 28
31 45 60
|
|
| 4 11 25
36 50 57
| 1 16 27
37 41 58
| 10 14 27
38 42 59
| 7 20 28
39 43 60
| 2 14 29
40 44 51
|
|
| 10 13 26
34 42 56
| 9 19 28
35 43 57
| 4 15 28
36 44 58
| 3 11 29
37 45 59
| 8 16 30
38 46 60
|
|
| 2 20 27
35 46 58
| 5 17 26
36 47 59
| 2 19 29
37 48 60
| 1 15 30
38 49 51
| 6 12 21
39 50 52
|
Задания для контрольных работ
По курсу необходимо выполнить одну контрольную работу. По контрольной работе даются вопросы для выбора контрольного задания. В контрольном задании необходимо ответить на 7 вопросов, которые берутся из разделов «Перечень вопросов контрольной работы».
Ответы даются в краткой форме, но должны содержать конкретный материал, включая формулы химических соединений и уравнения реакций изучаемых вопросов, по которым рецензент определяет степень проработки вопросов студентом. Примерный объем всего контрольного задания – стандартная школьная тетрадь. Задание должно быть написано четким и разборчивым почерком. С правой стороны тетради обязательно оставлять поля для рецензии и заметок. Неряшливое выполнение работы не допускается. Такие работы возвращаются без проверки и не зачитываются. В конце контрольной работы следует указать, какая литература использована и год ее издания, а также год издания методических указаний. Кроме того, должна быть личная подпись студента, выполнившего задание, и дата выполнения. Номера вопросов для контрольного задания берутся из таблиц, приложенным ниже, соответственно двум последним цифрам шифра (т. е. номеру зачетной книжки). Последняя цифра шифра находится в первой колонке по вертикали, а предпоследняя – сверху по горизонтали. В точке пересечения этих двух колонок обозначены номера вопросов, на которые вам необходимо ответить.
Например, при шифре 4245 берем две последние цифры – 45; по вертикали отыскиваем последнюю цифру – 5, а по горизонтали (сверху) находим предпоследнюю цифру – 4. В точке пересечения строчки 5 и колонки 4 находим номера вопросов. На которые необходимо ответить, а именно 9,16,22,37,47,54,66.
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РФ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«Орловский государственный аграрный университет»
ОСНОВЫ БИОХИМИИ И МОЛЕКУЛЯРНОЙ БИОЛОГИИ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ИЗУЧЕНИЮ ДИСЦИПЛИНЫ И ЗАДАНИЯ ДЛЯ КОНТРОЛЬНЫХ РАБОТ
студентам-заочникам
направления подготовки
БИОТЕХНОЛОГИЯ
Орел-2014 г
ОСНОВЫ БИОХИМИИ И МОЛЕКУЛЯРНОЙ БИОЛОГИИ.
Методические указания и задания для контрольных работ./Павловская Н.Е., Солохина И.Ю.
Рецензенты:
Прудникова Е.Г., к.с.-х.н., доцент кафедры химии
Методические указания составлены в соответствии с программой курса «Основы биохимии и молекулярной биологии»
Одобрено и рекомендовано кафедрой биотехнологии и методической комиссией ФГБОУ ВО Орел ГАУ
Издательство Орел ГАУ
1.Цели и задачи дисциплины
Цель дисциплины–сформировать у студентов современные представления о химическом составе организмов, о биохимических процессах, протекающих в живых клетках и организмах, а также о биологических субстратах, участвующих в этих процессах.
В задачи изучения дисциплины входит изучение строения и биологических функций важнейших биополимеров и биорегуляторов: белков, нуклеиновых кислот, углеводов, липидов, витаминов, коферментов, гормонов; механизмов ферментативных биоэнергетических превращений; специфических процессов, характерных для живых систем: ферментативный катализ, обмен углеводов, белков и липидов, мембранный транспорт, превращениям энергии, метаболизм ксенобиотиков, генетика прокариот и эукариот.
Задачей курса «Основы биохимии и молекулярной биологии» является изучение строения и свойств макромолекул, входящих в состав живой материи, их химических превращениях и значении этих превращений для понимания физико-химических основ жизнедеятельности, молекулярных механизмов наследственности и адаптации биохимических процессов в организмах к изменяющимся условиям окружающей среды. Знание биохимии имеет большое значение для формирования понимания единства метаболических процессов в организме и их регуляции на молекулярном, клеточном и организменном уровнях.
Рекомендуемая литература
Основная
1. Авдеева, Л.В. Биохимия: Учебник / Л.В. Авдеева, Т.Л. Алейникова, Л.Е. Андрианова; Под ред. Е.С. Северин. - М.: ГЭОТАР-МЕД, 2013. - 768 c.
2.Биологическая химия /(Ю.Б. Филиппович, Н.И. Ковалевская, Г.А. Севастьянова и др.); под ред. Н.И. Ковалевской.- М.: ИЦ «Академия», 2008.-256с.
3.Березов Т.Т., Коровкин Б.Ф. Биологическая химия: учебник. -3-е изд., стер. -М.: Медицина, 2008.03, [1] с.: рис., табл
4.. Коничев, А. С. Молекулярная биология: учебник для студентов пед. вузов / А. С. Коничев, Г. А. Севастьянова. – М.: Дрофа, 2008. - 359 с.
5. Ленинджер А. Основы биохимии. В 3-х тт. – М.: Мир, 2010.
6. Щербаков В.Г. Биохимия: учебник / В.Г. Щербаков, В.Г. Лобанов, Т.Н. Прудникова, А.Д. Минакова. – СПб.: ГИОРД, 2009
Дополнительная
1. Кнорре Д.Г., Мызина С.Д. Биологическая химия.– М., 2004. 479 с.
2. Тюкавкина Н.А. Биоорганическая химия: Учебн. для вузов / Н.А. Тюкавкина, Ю.И. Бауков. – М.: Дрофа, 2004. – 544 с.
3 Коничев, А. С. Молекулярная биологи: учебник для студентов пед. вузов / А. С. Коничев, Г. А. Севастьянова. – М.: Изд. центр «Академия», 2003. – 400 с.
4. Комов В.П., Шведова В.Н. Биохимия. СМ.: Дрофа, - 2004. -638 с.
5.Николаев А.Я. Биологическая химия: учебник / А.Я. Николаев. – М.: Медицинское информационное агентство, 2007.
6. Рогожин В.В. Биохимия растений: учебник / В.В. Рогожин. – СПб.: ГИОРД, 2011
7. Терах Е.И. Биохимия. Метаболизм веществ и энергии в клетке: учебное пособие / Е.И. Терах. – Новосибирск: СибУПК, 2010.
8. Чернова Н.Н. Биохимия. Руководство к практическим занятиям: учебное пособие / Н.Н. Чернова. – М.: ГЭОТАР-Медиа, 2009.