Ионная сила-полусумма произведений ионных конц-й в р-ре на квадрат их валентности.
I=1/2∑zi^2*mi,где zi – заряд иона, mi – моляльность иона. Согласно первому приближению Д-Х(предельный закон): lgγ±=−A∣z+ z-∣√I, где I – ионная сила раствора,
z+ z—заряды ионов; A=(1,825∗10^6)/(ε T)^3 /2, где ε — диэлектрическая проницаемость, T – температура. Для воды при 25 градусах A = 0,509.
Пр-ло Льюиса-Рендала:
Средний ионный коэф.активностизависит только от ионной силы р-ра и не зависит от других ионов,нах-ся в р-ре. Область применения: 0,01-0,02 моль/кг
(При добавлении в р-р сильного эл-та, не имеющего общих ионов с нашей малораств.солью ПР не изм-ся,т.к.зависит только от Т и р.Раств-ть уменьшится, т.к. увеличится I.)
Возникновение скачка потенциала на границе раздела проводников I и II рода. Обратимые электроды и обратимые гальванические элементы. Условная запись правильно разомкнутого гальванического элемента. Электродвижущая сила (ЭДС) гальванического элемента.
Потенциал µ(cu2+пластина) > µ(cu2+р-ра)=>пласт.в р-р до выравнивания потенциала=>возн.эл.слой на границе раздела ж-тв=>возникает скачок потенциала от Ме и ж-ти.Явление возник-я скачка потенциала на границе раздела фаз лежит в основе работы гальв.эл-тов.
Электроды могут быть обратимыми по катиону или по аниону. По катиону обратимы электроды 1 рода с металлической пластинкой и газовые электроды, которые в растворе дают катион. По аниону — 1 рода с неметаллической пластинкой, газовые, которые в растворе дают анион, и электроды II рода. Гальванический элемент называется обратимым, если при пропускании через него тока в обратном направлении в нем происходят обратные химические реакции. Такой гальванический элемент составлен из двух обратимых электродов. Условная запись: слева записывается электрод, имеющий более отрицательный стандартный электродный потенциал; границы фаз обозначаются сплошной вертикальной чертой, граница растворов обозначается одинарной вертикальной пунктирной прямой, если есть диффузионный потенциал, либо двойной вертикальной пунктирной прямой, если он отсутствует. Исключение составляет водородный электрод, который всегда располагается слева. Пример правильно разомкнутого гальванического элемента: Pt, H2 | HCl || CuSO4 | Cu | Pt ЭДС гальванического элемента равна разности электродных потенциалов составляющих его электродов. Согласно принятой форме записи гальванического элемента, его ЭДС равна разности электродных потенциалов правого и левого электродов: E = Eпр — Eлев > 0
40.Приведите пример химического гальванического элемента, составленного из газового электрода и электрода второго рода, электрохимическая цепь без жидкостных соединений - «без переноса». Запишите уравнения электродных полуреакций и уравнение химической реакции, за счет энергии которой вырабатывается электрическая энергия данным элементом.
Примером такой цепи является водород-хлорсеребряный элемент
Pt | (H2) | HCl | AgCl | Ag, (I)
кот состоит из водородного и хлорсеребряного эл-дов, погруженных в р-р хлороводорода. При работе в таком элементе протекают эл-дные реакции: 1/2H2(газ)®H+(р-р) + e; AgCl (тв) + e ®Ag (тв) + Cl–(р-р)
Т о, суммарный процесс представляет собой химическую реакцию: 1/2H2(газ) + AgCl (тв)®Ag (тв) + Н+(р-р) + Cl–(p-p);
ЭДС такой цепи равна разности потенциалов хлорсеребряного и водородного электродов. Учитывая ур-ия получим

Разность стандартных потенциалов хлорсеребряного и водородного эл-дов дают стандрт ЭДС цепи Е о, но т к стандартный потенциал водородного эл-да принят равным нулю, то Е о равна стандартному потенциалу хлорсеребряного электрода. Если давление водорода =1, то
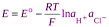 .
.
Если хлороводород полностью диссоциирован в р-ре, то произведение активностей ионов водорода и хлора можно заменить средней ионной активностью 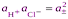 , тогда
, тогда
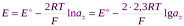

Газовые электроды, водородный электрод. Вывод и анализ уравнения, выражающего зависимость потенциала водородного электрода от активности водородных ионов и давления молекулярного водорода. Область применения водородного электрода.
Газовые электроды - пластинка инертного металла, омываемая газом, опущенная в раствор, содержащий ионы этого газа. Пример электрода: Pt, H2 | H+ Уравнение полуреакции: H+ + e → ½ H2 Уравнение Нернста: 
Е0=0В.
Водород.эл-д-пластинка или проволока из Ме,хорошо поглощ.газообр.водород,насыщ.водородом(при атм.давл) и погруженный в вод.р-р,содерж.ионы водорода.
Pt, H2 | H+ Уравнение полуреакции: H+ + e →<= ½ H2 Уравнение Нернста:

z=1,E=0В
Применение вод.эл-да в произ-ве очень неудобно,потому что связано с подачей газообр.Н2.Преимущество:широкая область применимости.М.использовать в большом диапазоне темп,давл, и рН, а также во многих неводных или частично водных р-рах.
Водородный электрод. Условная шкала потенциалов. Уравнение Нернста для потенциала водородного электрода. Зависимость потенциала электрода от рН раствора и давления молекулярного водорода. Область применения водородного электрода.
Водород.эл-д-пластинка или проволока из Ме,хорошо поглощ.газообр.водород,насыщ.водородом(при атм.давл) и погруженный в вод.р-р,содерж.ионы водорода.
Pt, H2 | H+ Уравнение полуреакции: H+ + e →<= ½ H2 Уравнение Нернста:

z=1,E=0В
Применение вод.эл-да в произ-ве очень неудобно,потому что связано с подачей газообр.Н2.Преимущество:широкая область применимости.М.использовать в большом диапазоне темп,давл, и рН, а также во многих неводных или частично водных р-рах.
Вод.шкала:Нернст предложил считать усл. 0 потенциал вод.эл-да при конц-ии водород.ионов в р-ре =1 и давл.газообр.вод-да 1атм.
Усл.вод.шкала при к-ой при всех темп.за 0 выбран потенциал станд.вод.эл-да.Она отлич-ся от шкалы Нернста тем, что в ней вместо единичных конц-ий и давл.выбраны единичная активность и летучесть.
рН=-lg[aH+]=>E=-0.059pH
Стандартный водородный электрод. Условный электродный потенциал (потенциал электрода в водородной шкале). Связь ЭДС гальванического элемента с условными электродными потенциалами. Правило знаков ЭДС и электродных потенциалов.
Станд.вод.эл-д – вод.эл-д. давление подаваемого водорода к-го составляет 1атм, а активность ионов Н2 в р-ре=1при Т=298К
Усл.эл-ый потенциал(или эл-ный потенциал по водород.шкале)Е=ЭДС элемента,состав-го из данноого эл-да и станд.вод.эл-да, т.е. Е = ЭДС эл-та.
Связь ЭДС: а)находим разница усл.эл.потенц: Е2-Е1=L2YM2-L1YM1+(m2Ypt-m1Ypt)= L2YM2-L1YM1+m2 YM1
б)сопостав-е с ур.для ЭДС дан.эл-та Е=Е2-Е1
Правило знаков: 1. Основополагающее правило – ЭДС положительна, если внутри гальванического элемента положительное электри-чество (катионы) перемещается слева направо (Стокгольм, международная конференция 1953г.)
2. Выводы. При разряде ионов на правом электроде - процесс восстановления (электрод заряжается положительно), а сам электрод – положительный полюс г.э. (катод); на левом электроде – процесс окисления (отрицательный полюс, анод).
3. Соответствие знака ЭДС системе знаков теории хим. сродства а) 

б)  и
и  , самопроизвольный процесс
, самопроизвольный процесс




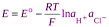 .
.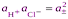 , тогда
, тогда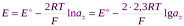





 и
и  , самопроизвольный процесс
, самопроизвольный процесс


